2023年江苏合格考考点各个击破 课时12 化学用语 元素周期表(包括化学键)(含答案)
文档属性
| 名称 | 2023年江苏合格考考点各个击破 课时12 化学用语 元素周期表(包括化学键)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 684.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-26 21:14:23 | ||
图片预览


文档简介
课时12 化学用语 元素周期表 (包括化学键)
考点各个击破
原子的结构[元素X的含义(同位素)]
原子
质量数—A
原子中:质量数(A)= (Z)+ (N)
质子数=核电荷数=核外电子数=原子序数
例1 (2021·江苏学测)“月壤”中含有He,该原子的中子数是 ( )
A. 1 B. 2 C. 3 D. 5
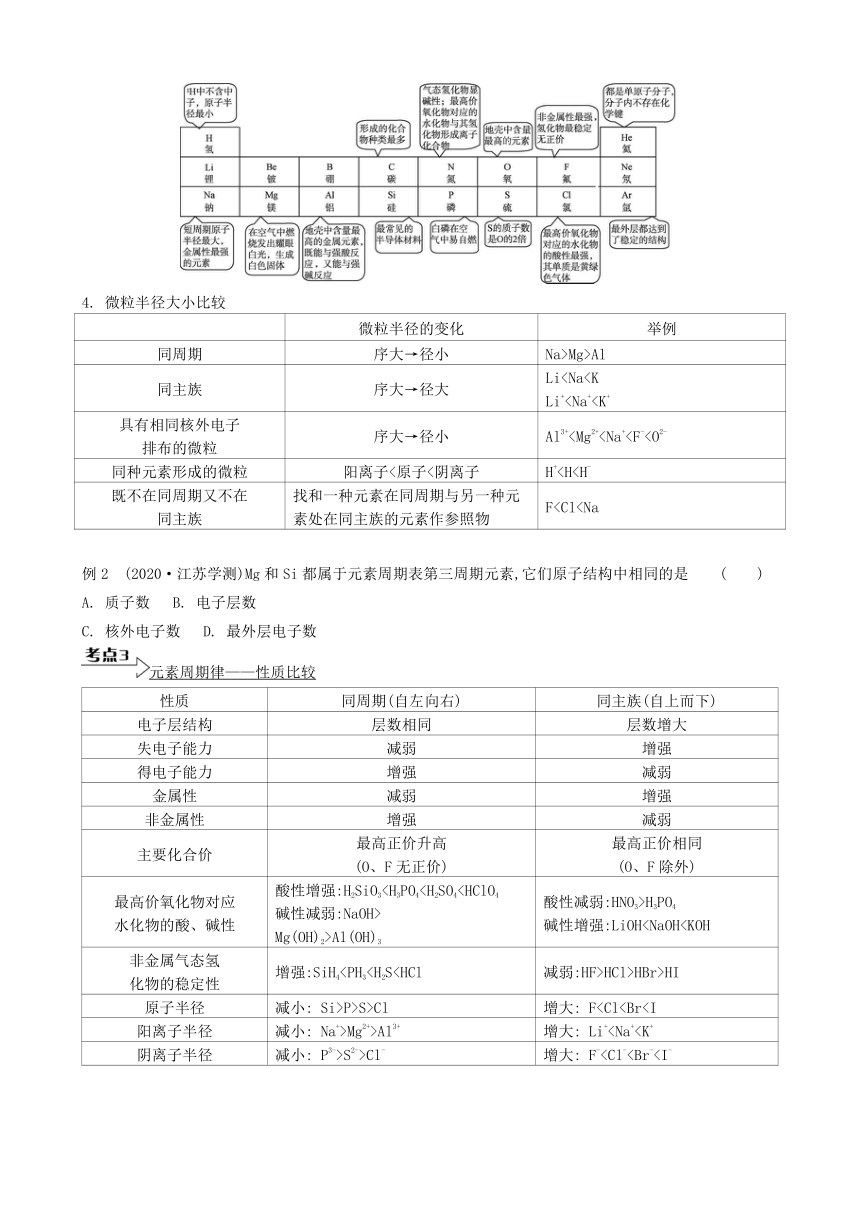
元素周期表与元素周期律
1. 元素周期表的结构
周期
(7个周期)
族
(18个
纵行)
2. 元素周期表的周期和族
元素周期
短周期元素,周期数 电子层数;
主族序数 最外层电子数。
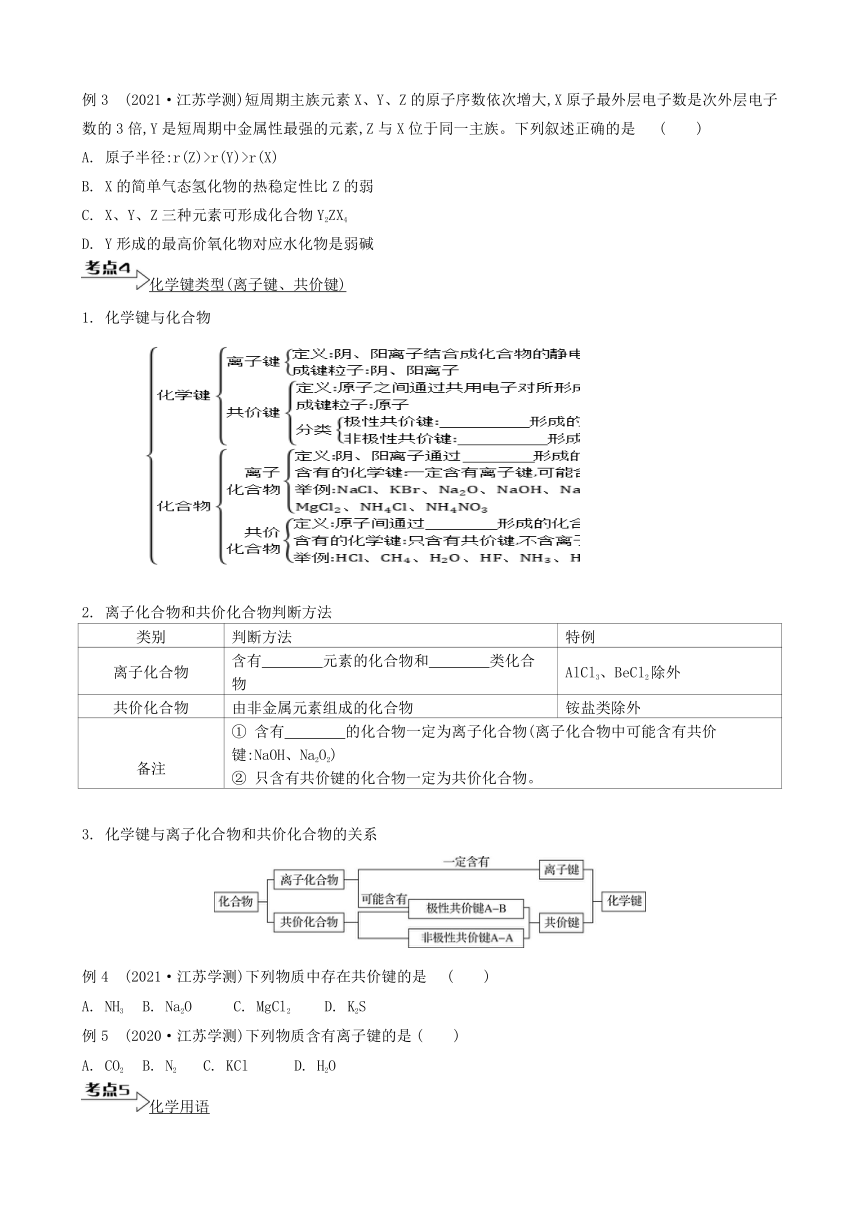
3. 短周期元素的特性
4. 微粒半径大小比较
微粒半径的变化 举例
同周期 序大→径小 Na>Mg>Al
同主族 序大→径大 Li具有相同核外电子排布的微粒 序大→径小 Al3+同种元素形成的微粒 阳离子<原子<阴离子 H+既不在同周期又不在同主族 找和一种元素在同周期与另一种元素处在同主族的元素作参照物 F例2 (2020·江苏学测)Mg和Si都属于元素周期表第三周期元素,它们原子结构中相同的是 ( )
A. 质子数 B. 电子层数
C. 核外电子数 D. 最外层电子数
元素周期律——性质比较
性质 同周期(自左向右) 同主族(自上而下)
电子层结构 层数相同 层数增大
失电子能力 减弱 增强
得电子能力 增强 减弱
金属性 减弱 增强
非金属性 增强 减弱
主要化合价 最高正价升高 (O、F无正价) 最高正价相同 (O、F除外)
最高价氧化物对应水化物的酸、碱性 酸性增强:H2SiO3Mg(OH)2>Al(OH)3 酸性减弱:HNO3>H3PO4碱性增强:LiOH非金属气态氢化物的稳定性 增强:SiH4HCl>HBr>HI
原子半径 减小: Si>P>S>Cl 增大: F阳离子半径 减小: Na+>Mg2+>Al3+ 增大: Li+阴离子半径 减小: P3->S2->Cl- 增大: F-例3 (2021·江苏学测)短周期主族元素X、Y、Z的原子序数依次增大,X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是 ( )
A. 原子半径:r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z的弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物对应水化物是弱碱
化学键类型(离子键、共价键)
1. 化学键与化合物
2. 离子化合物和共价化合物判断方法
类别 判断方法 特例
离子化合物 含有 元素的化合物和 类化合物 AlCl3、BeCl2除外
共价化合物 由非金属元素组成的化合物 铵盐类除外
备注 ① 含有 的化合物一定为离子化合物(离子化合物中可能含有共价键:NaOH、Na2O2) ② 只含有共价键的化合物一定为共价化合物。
3. 化学键与离子化合物和共价化合物的关系
例4 (2021·江苏学测)下列物质中存在共价键的是 ( )
A. NH3 B. Na2O C. MgCl2 D. K2S
例5 (2020·江苏学测)下列物质含有离子键的是 ( )
A. CO2 B. N2 C. KCl D. H2O
化学用语
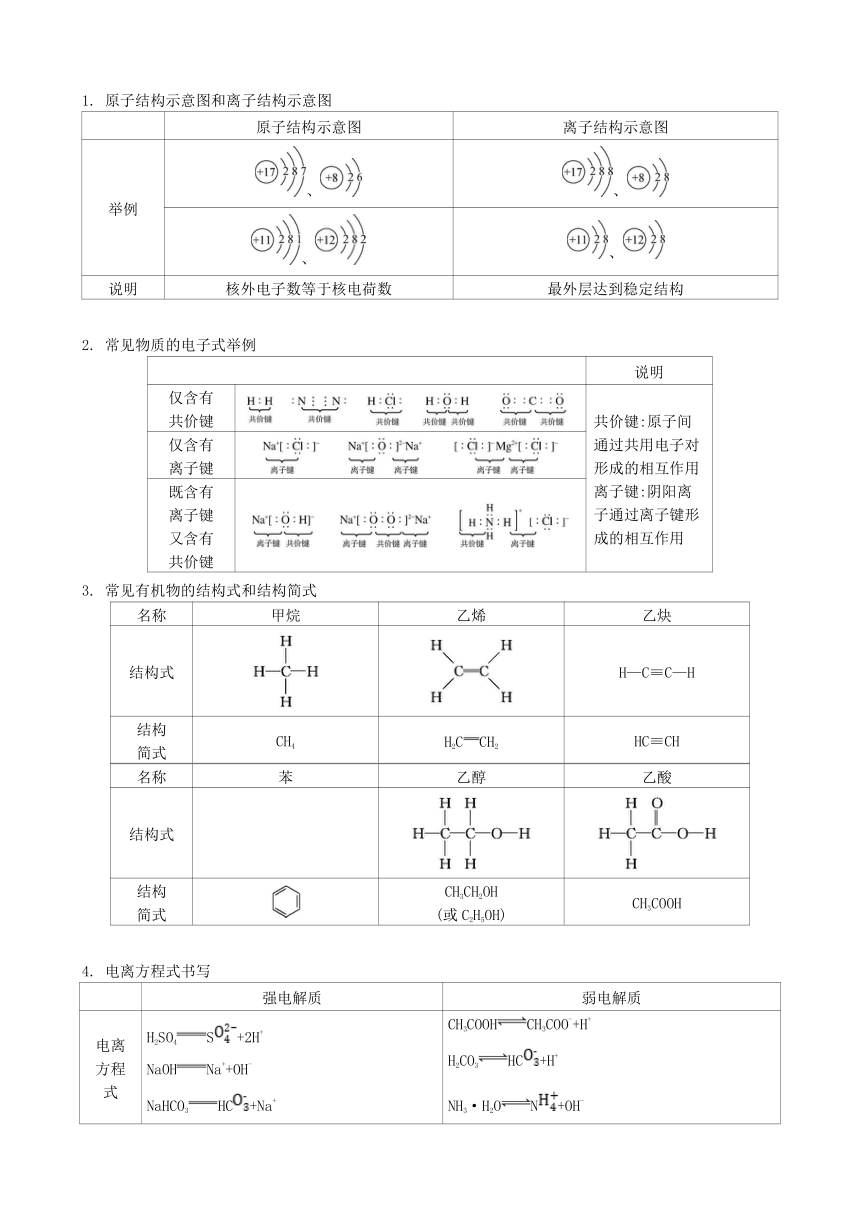
1. 原子结构示意图和离子结构示意图
原子结构示意图 离子结构示意图
举例 、 、
、 、
说明 核外电子数等于核电荷数 最外层达到稳定结构
2. 常见物质的电子式举例
说明
仅含有共价键 共价键:原子间通过共用电子对形成的相互作用离子键:阴阳离子通过离子键形成的相互作用
仅含有离子键
既含有离子键又含有共价键
3. 常见有机物的结构式和结构简式
名称 甲烷 乙烯 乙炔
结构式 H—C≡C—H
结构简式 CH4 H2CCH2 HC≡CH
名称 苯 乙醇 乙酸
结构式
结构简式 CH3CH2OH(或C2H5OH) CH3COOH
4. 电离方程式书写
强电解质 弱电解质
电离方程式 H2SO4S+2H+NaOHNa++OH-NaHCO3HC+Na+FeSO4Fe2++SFe2(SO4)32Fe3++3SNaHSO4S+H++Na+ CH3COOHCH3COO-+H+H2CO3HC+H+NH3·H2ON+OH-H2OH++OH-
说明 完全电离“” 部分电离“”
例6 (2021·江苏学测)下列化学用语表示正确的是 ( )
A. HCl的电子式:Cl
B. 正丁烷的结构简式:
C. 硫原子的结构示意图:
D. Ba(OH)2的电离方程式: Ba(OH)2Ba2++2OH-
达标巩固检测
【考向1 化学用语】
1. (2019·江苏学测)下列化学用语表示正确的是 ( )
A. 乙醛的结构简式:C2H4O
B. N2的电子式:N
C. S2-的结构示意图:
D. KCl的电离方程式:KClK++Cl-
2. (2022·南京学测合格考)下列有关化学用语表示正确的是 ( )
A. 中子数为20的氯原子Cl
B. Mg2+的结构示意图:
C. 二氧化碳的电子式:O
D. 乙酸乙酯的结构简式:C4H8O2
3. (2021·常州学测合格考)反应2NH3+3Cl26HCl+N2,NH3+HClNH4Cl(白烟)可用于氯气管道泄漏的检查。下列表示反应中的相关微粒的化学用语正确的是 ( )
A. 氯离子的结构示意图: B. HCl的电子式:H+]-
C. 中子数为20的氯原子Cl D. 氮气的结构式:N—N
4. (2022·盐城学测合格考)下列化学用语表达正确的是 ( )
A. 氧的原子结构示意图:
B. NaHCO3的电离方程式:NaHCO3Na++H++C
C. 氯化氢的电子式:H+]-
D. 乙酸的结构简式:CH3COOH
5. (2022·连云港学测合格考)下列化学用语表示正确的是 ( )
A. 氧离子的结构示意图:
B. 乙烯的结构简式:C2H4
C. 氢氧化钠的电子式:Na+H]-
D. 硫酸氢钠的电离方程式:NaHSO4Na++HS
【考向2 原子结构】
6. (2020·江苏学测)为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md的质量数为 ( )
A. 101 B. 157 C. 258 D. 359
7. (2019·江苏学测I可用于治疗甲状腺疾病。该原子的质子数是 ( )
A. 53 B. 78 C. 131 D. 184
8. (2020·学业水平合格性考试样卷) C常用于测定动植物标本的年龄。该原子的中子数是 ( )
A. 6 B. 8 C. 14 D. 20
9. (2022·南京学测合格考)某原子的核外有2个电子层,最外层有6个电子,则该原子的核电荷数为 ( )
A. 6 B. 8 C. 16 D. 4
10. (2022·连云港学测合格考O常用作“示踪原子”。下列关于O 的说法正确的是 ( )
A. 质子数是8 B. 电子数是10
C. 中子数是18 D. 质量数是26
11. (2022·扬州学测合格考Ac (Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于Ac 的说法中,正确的是 ( )
A. 质子数为225 B. 中子数为89
C. 核外电子数为136 D. 质子数与中子数之和为225
12. (2021·徐州合格考模拟Ts是一种人工合成的超重化学元素,其中子数为 ( )
A. 117 B. 293 C. 176 D. 410
【考向3 元素周期表 元素周期律】
13. (2020·江苏学测)判断Cl的非金属性比S的强,可依据的事实是 ( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
14. (2020·江苏学测)锂是第二周期ⅠA族元素,下列有关锂元素性质推测正确的是 ( )
A. 最高化合价为+2
B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈
D. 最高价氧化物对应的水化物碱性比钠的弱
15. (2022·盐城学测合格考)硼和氮都属于元素周期表第二周期元素,它们原子结构中相同的是 ( )
A. 电子层数 B. 质子数
C. 最外层电子数 D. 核外电子数
16. (2022·盐城学测合格考)短周期主族元素M、N、X、Y、Z的原子序数依次增大。已知:M与X同主族,N原子的最外层电子数是电子层数的3倍,M的原子半径小于N的原子半径,Z的原子半径是同周期元素中最小的,Y原子的电子层数与最外层电子数相等。下列叙述正确的是 ( )
A. 金属性强弱:Y>X
B. 元素M与N只能形成一种共价化合物
C. M、Z的单质的混合物在光照条件下可发生爆炸
D. 元素X的最高价氧化物对应的水化物为弱碱
17. (2022·南京学测合格考)短周期主族元素X、Y、Z的原子序数依次增大。X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是 ( )
A. 原子半径r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物的水化物是弱碱
18. (2022·扬州学测合格考)X、Y、Z、W、Q属于周期表前20号主族元素,且原子序数依次增大。X原子的最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素,Z和X位于同一主族,Q是第19号元素。下列说法正确的是 ( )
A. 自然界中由X元素形成的单质只有一种
B. 原子半径:r(X)C. 简单气态氢化物的热稳定性:Z>W
D. 最高价氧化物对应水化物的碱性:Y>Q
19. (2022·连云港学测合格考)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y原子最外层有1个电子,Z元素与X处在同一主族。下列叙述正确的是 ( )
A. Z的非金属性比X的强
B. X、Y形成的化合物是共价化合物
C. W的简单气态氢化物的热稳定性比Z的强
D. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
20. (2020·南通学考模拟)短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分占三个不同的周期。W与X同主族,R与Z同主族,R原子最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素。下列说法正确的是 ( )
A. 金属性:XB. 原子半径:WC. R位于第二周期ⅣA族
D. 简单气态氢化物的热稳定性:Z21. (2021·徐州合格考模拟)X、Y、Z、Q、W是原子序数依次增大的短周期主族元素,X的原子半径最小,Y的原子最外层电子数是其电子层数的2倍,Z是短周期金属性最强的元素,元素Q的单质可被用作输电的导线,W的单质为黄绿色有毒气体。下列说法正确的是 ( )
A. 最高价氧化物所对应水化物的酸性:Y>W
B. 原子半径:W>Q>Z
C. 化合物XW与ZW含有相同类型的化学键
D. 元素Z、Q的最高价氧化物对应水化物能发生反应
22. (2020·扬州学测一模)短周期主族元素X、Y、Z、W的原子序数依次增大, X原子的核内质子数为8,Y原子最外层只有1个电子,Z原子最外层电子数是其电子层数的2倍,W原子最外层电子数为7。下列叙述正确的是 ( )
A. Z的非金属性比X的强
B. X、Y形成的化合物是共价化合物
C. W的简单气态氢化物的热稳定性比Z的强
D. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
【考向4 化学键 化合物】
23. (2022·连云港学测合格考)下列物质中含有离子键的是 ( )
A. MgO B. CO C. HBr D. H2O
24. (2022·南京学测合格考)下列物质中只含离子键的是 ( )
A. NH4Cl B. HCl C. K2S D. HNO3
25. (2022·盐城学测合格考)下列物质中含有共价键的离子化合物是 ( )
A. NaCl B. H2O C. NaOH D. Cl2
26. (2021·常州学测合格考)下列物质属于离子化合物的是 ( )
A. NaCl B. H2O C. CO2 D. CH4
27. (2022·扬州学测合格考)下列物质中,含离子键的是 ( )
A. H2O B. CO2 C. MgCl2 D. Cl2
课时12 化学用语 元素周期表(包括化学键)
【考点各个击破】
考点1 质子数 中子数
例1 A
考点2 2. 电子层数 核电荷数 最外层电子数 等于 等于
例2 B
例3 C 解析:X、Y、Z分别为O、Na、S,原子半径:Na>S>O,A错误;非金属性越强则气体氢化物越稳定,稳定性:H2O>H2S,B错误;O、Na、S可形成Na2SO4,C正确;NaOH属于强碱,D错误。
考点4 1. 不同种原子 同种原子 离子键 共价键
2. 活泼金属 铵盐 离子键
例4 A 例5 C
例6 D 解析:HCl的电子式,A错误;正丁烷的结构简式为CH3(CH2)2CH3,B错误;该图是硫离子的结构示意图,C错误。
【达标巩固检测】
1. D 2. B
3. C 解析:氯离子的核内有17个质子,核外有18个电子,A错误;HCl电子式为,B错误;氮气中N原子之间以三键结合,结构式为N≡N,D错误。
4. D 解析:该图是氧离子的结构示意图,A错误;NaHCO3Na++HC,B错误;氯化氢的电子式:,C错误。
5. C 解析:该图为氧原子的结构示意图,A错误;乙烯的结构简式CH2CH2,B错误;C正确;NaHSO4Na++H++S,D错误。
6. C 7. A 8. B 9. B 10. A 11. D 12. C
13. A 解析:比较非金属性可根据单质与氢气的化合的难易程度,气态氢化物的稳定性强弱进行比较,A正确。
14. D 解析:锂是第二周期ⅠA族元素,最高化合价是+1,A错误;同主族元素从上到下原子半径逐渐增大,锂的原子半径小于钠的原子半径,B错误;同主族元素的单质从上到下金属性逐渐增强,与水反应剧烈程度增大,最高价氧化物对应的水化物的碱性增强,C错误。
15. A 解析:同一周期中原子具有相同的电子层数,A正确。
16. C 解析:M、N、X、Y、Z分别为H、O、Na、Al、Cl,金属性Na>Al,A错误;H、O可形成H2O、H2O2,B错误;氢气和氯气在光照条件下会发生爆炸,C正确;NaOH是强碱,D错误。
17. C
18. B 解析:X、Y、Z、W、Q分别为O、Al、S、Cl、K。O元素形成单质有氧气和臭氧两种,A错误;非金属性:S19. C 解析:X、Y、Z、W分别为O、Na、S、Cl。非金属性SH2S,C正确;原子半径S>Cl,D错误。
20. D 解析:W为H,R为O,X为Na,Y为Al,Z为S,金属性Na>Al,A错误;H位于第一周期,Al和S位于第三周期,R为第二周期元素,同一周期核电荷数越大原子半径越小,则原子半径HS,则简单气态氢化物的热稳定性:Z21. D 解析:X为H、Y为C、Z为Na、Q为Al、W为Cl,非金属性Cl大于C,则最高价氧化物所对应水化物的酸性:Y22. C 解析:X、Y、Z、W分别为O、Na、S、Cl元素。非金属性O>S,A错误;O和Na可形成Na2O和Na2O2均为离子化合物,B错误;稳定性HCl>H2S,C正确;Na原子半径最大,D错误。
23. A 24. C 25. C 26. A 27. C
考点各个击破
原子的结构[元素X的含义(同位素)]
原子
质量数—A
原子中:质量数(A)= (Z)+ (N)
质子数=核电荷数=核外电子数=原子序数
例1 (2021·江苏学测)“月壤”中含有He,该原子的中子数是 ( )
A. 1 B. 2 C. 3 D. 5
元素周期表与元素周期律
1. 元素周期表的结构
周期
(7个周期)
族
(18个
纵行)
2. 元素周期表的周期和族
元素周期
短周期元素,周期数 电子层数;
主族序数 最外层电子数。
3. 短周期元素的特性
4. 微粒半径大小比较
微粒半径的变化 举例
同周期 序大→径小 Na>Mg>Al
同主族 序大→径大 Li
A. 质子数 B. 电子层数
C. 核外电子数 D. 最外层电子数
元素周期律——性质比较
性质 同周期(自左向右) 同主族(自上而下)
电子层结构 层数相同 层数增大
失电子能力 减弱 增强
得电子能力 增强 减弱
金属性 减弱 增强
非金属性 增强 减弱
主要化合价 最高正价升高 (O、F无正价) 最高正价相同 (O、F除外)
最高价氧化物对应水化物的酸、碱性 酸性增强:H2SiO3
原子半径 减小: Si>P>S>Cl 增大: F
A. 原子半径:r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z的弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物对应水化物是弱碱
化学键类型(离子键、共价键)
1. 化学键与化合物
2. 离子化合物和共价化合物判断方法
类别 判断方法 特例
离子化合物 含有 元素的化合物和 类化合物 AlCl3、BeCl2除外
共价化合物 由非金属元素组成的化合物 铵盐类除外
备注 ① 含有 的化合物一定为离子化合物(离子化合物中可能含有共价键:NaOH、Na2O2) ② 只含有共价键的化合物一定为共价化合物。
3. 化学键与离子化合物和共价化合物的关系
例4 (2021·江苏学测)下列物质中存在共价键的是 ( )
A. NH3 B. Na2O C. MgCl2 D. K2S
例5 (2020·江苏学测)下列物质含有离子键的是 ( )
A. CO2 B. N2 C. KCl D. H2O
化学用语
1. 原子结构示意图和离子结构示意图
原子结构示意图 离子结构示意图
举例 、 、
、 、
说明 核外电子数等于核电荷数 最外层达到稳定结构
2. 常见物质的电子式举例
说明
仅含有共价键 共价键:原子间通过共用电子对形成的相互作用离子键:阴阳离子通过离子键形成的相互作用
仅含有离子键
既含有离子键又含有共价键
3. 常见有机物的结构式和结构简式
名称 甲烷 乙烯 乙炔
结构式 H—C≡C—H
结构简式 CH4 H2CCH2 HC≡CH
名称 苯 乙醇 乙酸
结构式
结构简式 CH3CH2OH(或C2H5OH) CH3COOH
4. 电离方程式书写
强电解质 弱电解质
电离方程式 H2SO4S+2H+NaOHNa++OH-NaHCO3HC+Na+FeSO4Fe2++SFe2(SO4)32Fe3++3SNaHSO4S+H++Na+ CH3COOHCH3COO-+H+H2CO3HC+H+NH3·H2ON+OH-H2OH++OH-
说明 完全电离“” 部分电离“”
例6 (2021·江苏学测)下列化学用语表示正确的是 ( )
A. HCl的电子式:Cl
B. 正丁烷的结构简式:
C. 硫原子的结构示意图:
D. Ba(OH)2的电离方程式: Ba(OH)2Ba2++2OH-
达标巩固检测
【考向1 化学用语】
1. (2019·江苏学测)下列化学用语表示正确的是 ( )
A. 乙醛的结构简式:C2H4O
B. N2的电子式:N
C. S2-的结构示意图:
D. KCl的电离方程式:KClK++Cl-
2. (2022·南京学测合格考)下列有关化学用语表示正确的是 ( )
A. 中子数为20的氯原子Cl
B. Mg2+的结构示意图:
C. 二氧化碳的电子式:O
D. 乙酸乙酯的结构简式:C4H8O2
3. (2021·常州学测合格考)反应2NH3+3Cl26HCl+N2,NH3+HClNH4Cl(白烟)可用于氯气管道泄漏的检查。下列表示反应中的相关微粒的化学用语正确的是 ( )
A. 氯离子的结构示意图: B. HCl的电子式:H+]-
C. 中子数为20的氯原子Cl D. 氮气的结构式:N—N
4. (2022·盐城学测合格考)下列化学用语表达正确的是 ( )
A. 氧的原子结构示意图:
B. NaHCO3的电离方程式:NaHCO3Na++H++C
C. 氯化氢的电子式:H+]-
D. 乙酸的结构简式:CH3COOH
5. (2022·连云港学测合格考)下列化学用语表示正确的是 ( )
A. 氧离子的结构示意图:
B. 乙烯的结构简式:C2H4
C. 氢氧化钠的电子式:Na+H]-
D. 硫酸氢钠的电离方程式:NaHSO4Na++HS
【考向2 原子结构】
6. (2020·江苏学测)为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素 Md的质量数为 ( )
A. 101 B. 157 C. 258 D. 359
7. (2019·江苏学测I可用于治疗甲状腺疾病。该原子的质子数是 ( )
A. 53 B. 78 C. 131 D. 184
8. (2020·学业水平合格性考试样卷) C常用于测定动植物标本的年龄。该原子的中子数是 ( )
A. 6 B. 8 C. 14 D. 20
9. (2022·南京学测合格考)某原子的核外有2个电子层,最外层有6个电子,则该原子的核电荷数为 ( )
A. 6 B. 8 C. 16 D. 4
10. (2022·连云港学测合格考O常用作“示踪原子”。下列关于O 的说法正确的是 ( )
A. 质子数是8 B. 电子数是10
C. 中子数是18 D. 质量数是26
11. (2022·扬州学测合格考Ac (Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于Ac 的说法中,正确的是 ( )
A. 质子数为225 B. 中子数为89
C. 核外电子数为136 D. 质子数与中子数之和为225
12. (2021·徐州合格考模拟Ts是一种人工合成的超重化学元素,其中子数为 ( )
A. 117 B. 293 C. 176 D. 410
【考向3 元素周期表 元素周期律】
13. (2020·江苏学测)判断Cl的非金属性比S的强,可依据的事实是 ( )
A. HCl的热稳定性比H2S的强
B. 氯气能溶于水,硫难溶于水
C. 常温下,氯单质呈气态,硫单质呈固态
D. AgCl是白色固体,Ag2S是黑色固体
14. (2020·江苏学测)锂是第二周期ⅠA族元素,下列有关锂元素性质推测正确的是 ( )
A. 最高化合价为+2
B. 原子半径比钠的大
C. 单质与水的反应比钠更剧烈
D. 最高价氧化物对应的水化物碱性比钠的弱
15. (2022·盐城学测合格考)硼和氮都属于元素周期表第二周期元素,它们原子结构中相同的是 ( )
A. 电子层数 B. 质子数
C. 最外层电子数 D. 核外电子数
16. (2022·盐城学测合格考)短周期主族元素M、N、X、Y、Z的原子序数依次增大。已知:M与X同主族,N原子的最外层电子数是电子层数的3倍,M的原子半径小于N的原子半径,Z的原子半径是同周期元素中最小的,Y原子的电子层数与最外层电子数相等。下列叙述正确的是 ( )
A. 金属性强弱:Y>X
B. 元素M与N只能形成一种共价化合物
C. M、Z的单质的混合物在光照条件下可发生爆炸
D. 元素X的最高价氧化物对应的水化物为弱碱
17. (2022·南京学测合格考)短周期主族元素X、Y、Z的原子序数依次增大。X原子最外层电子数是次外层电子数的3倍,Y是短周期中金属性最强的元素,Z与X位于同一主族。下列叙述正确的是 ( )
A. 原子半径r(Z)>r(Y)>r(X)
B. X的简单气态氢化物的热稳定性比Z弱
C. X、Y、Z三种元素可形成化合物Y2ZX4
D. Y形成的最高价氧化物的水化物是弱碱
18. (2022·扬州学测合格考)X、Y、Z、W、Q属于周期表前20号主族元素,且原子序数依次增大。X原子的最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素,Z和X位于同一主族,Q是第19号元素。下列说法正确的是 ( )
A. 自然界中由X元素形成的单质只有一种
B. 原子半径:r(X)
D. 最高价氧化物对应水化物的碱性:Y>Q
19. (2022·连云港学测合格考)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y原子最外层有1个电子,Z元素与X处在同一主族。下列叙述正确的是 ( )
A. Z的非金属性比X的强
B. X、Y形成的化合物是共价化合物
C. W的简单气态氢化物的热稳定性比Z的强
D. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
20. (2020·南通学考模拟)短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分占三个不同的周期。W与X同主族,R与Z同主族,R原子最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素。下列说法正确的是 ( )
A. 金属性:X
D. 简单气态氢化物的热稳定性:Z
A. 最高价氧化物所对应水化物的酸性:Y>W
B. 原子半径:W>Q>Z
C. 化合物XW与ZW含有相同类型的化学键
D. 元素Z、Q的最高价氧化物对应水化物能发生反应
22. (2020·扬州学测一模)短周期主族元素X、Y、Z、W的原子序数依次增大, X原子的核内质子数为8,Y原子最外层只有1个电子,Z原子最外层电子数是其电子层数的2倍,W原子最外层电子数为7。下列叙述正确的是 ( )
A. Z的非金属性比X的强
B. X、Y形成的化合物是共价化合物
C. W的简单气态氢化物的热稳定性比Z的强
D. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
【考向4 化学键 化合物】
23. (2022·连云港学测合格考)下列物质中含有离子键的是 ( )
A. MgO B. CO C. HBr D. H2O
24. (2022·南京学测合格考)下列物质中只含离子键的是 ( )
A. NH4Cl B. HCl C. K2S D. HNO3
25. (2022·盐城学测合格考)下列物质中含有共价键的离子化合物是 ( )
A. NaCl B. H2O C. NaOH D. Cl2
26. (2021·常州学测合格考)下列物质属于离子化合物的是 ( )
A. NaCl B. H2O C. CO2 D. CH4
27. (2022·扬州学测合格考)下列物质中,含离子键的是 ( )
A. H2O B. CO2 C. MgCl2 D. Cl2
课时12 化学用语 元素周期表(包括化学键)
【考点各个击破】
考点1 质子数 中子数
例1 A
考点2 2. 电子层数 核电荷数 最外层电子数 等于 等于
例2 B
例3 C 解析:X、Y、Z分别为O、Na、S,原子半径:Na>S>O,A错误;非金属性越强则气体氢化物越稳定,稳定性:H2O>H2S,B错误;O、Na、S可形成Na2SO4,C正确;NaOH属于强碱,D错误。
考点4 1. 不同种原子 同种原子 离子键 共价键
2. 活泼金属 铵盐 离子键
例4 A 例5 C
例6 D 解析:HCl的电子式,A错误;正丁烷的结构简式为CH3(CH2)2CH3,B错误;该图是硫离子的结构示意图,C错误。
【达标巩固检测】
1. D 2. B
3. C 解析:氯离子的核内有17个质子,核外有18个电子,A错误;HCl电子式为,B错误;氮气中N原子之间以三键结合,结构式为N≡N,D错误。
4. D 解析:该图是氧离子的结构示意图,A错误;NaHCO3Na++HC,B错误;氯化氢的电子式:,C错误。
5. C 解析:该图为氧原子的结构示意图,A错误;乙烯的结构简式CH2CH2,B错误;C正确;NaHSO4Na++H++S,D错误。
6. C 7. A 8. B 9. B 10. A 11. D 12. C
13. A 解析:比较非金属性可根据单质与氢气的化合的难易程度,气态氢化物的稳定性强弱进行比较,A正确。
14. D 解析:锂是第二周期ⅠA族元素,最高化合价是+1,A错误;同主族元素从上到下原子半径逐渐增大,锂的原子半径小于钠的原子半径,B错误;同主族元素的单质从上到下金属性逐渐增强,与水反应剧烈程度增大,最高价氧化物对应的水化物的碱性增强,C错误。
15. A 解析:同一周期中原子具有相同的电子层数,A正确。
16. C 解析:M、N、X、Y、Z分别为H、O、Na、Al、Cl,金属性Na>Al,A错误;H、O可形成H2O、H2O2,B错误;氢气和氯气在光照条件下会发生爆炸,C正确;NaOH是强碱,D错误。
17. C
18. B 解析:X、Y、Z、W、Q分别为O、Al、S、Cl、K。O元素形成单质有氧气和臭氧两种,A错误;非金属性:S
20. D 解析:W为H,R为O,X为Na,Y为Al,Z为S,金属性Na>Al,A错误;H位于第一周期,Al和S位于第三周期,R为第二周期元素,同一周期核电荷数越大原子半径越小,则原子半径H
23. A 24. C 25. C 26. A 27. C
同课章节目录
