2023年江苏合格考考点各个击破 课时13 反应热 原电池 化学反应速率与限度(含答案)
文档属性
| 名称 | 2023年江苏合格考考点各个击破 课时13 反应热 原电池 化学反应速率与限度(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 445.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-26 21:17:38 | ||
图片预览




文档简介
课时13 反应热 原电池化学反应速率与限度
考点各个击破
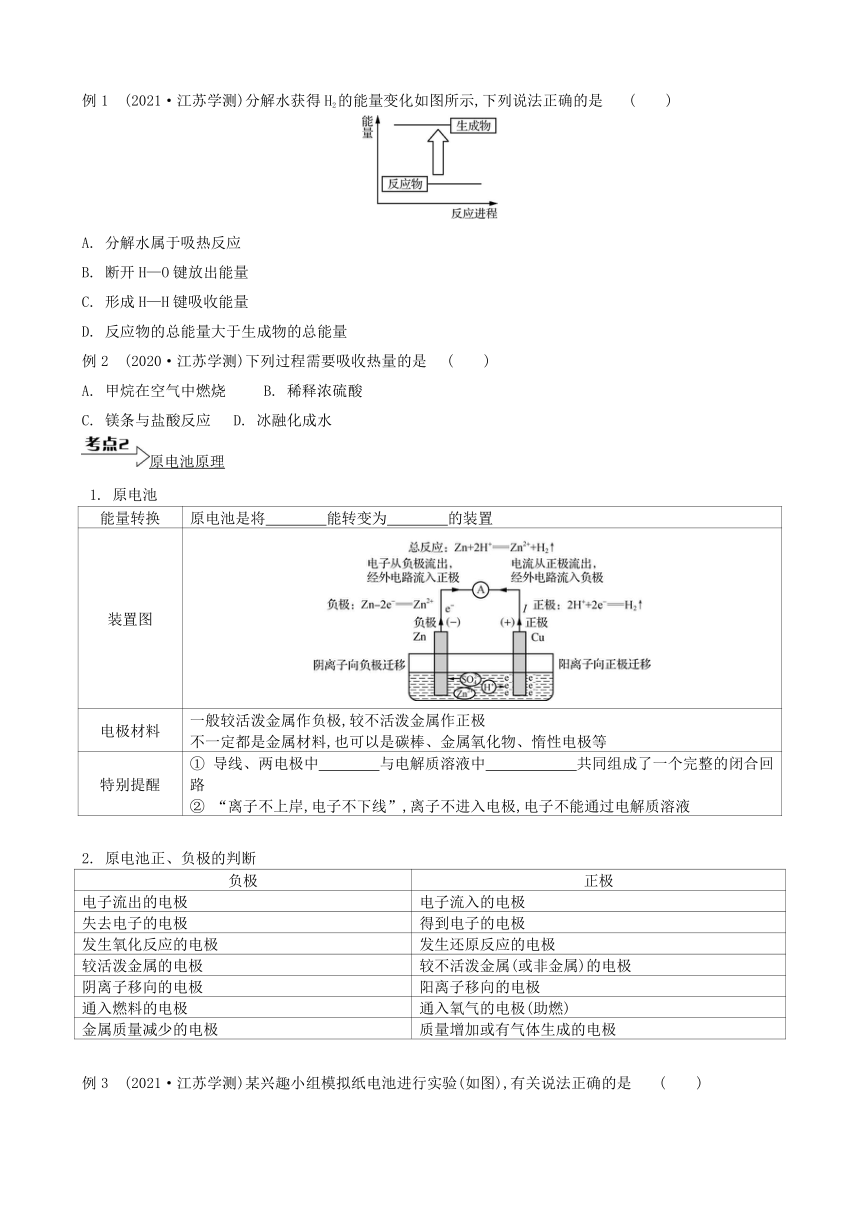
放热反应与吸热反应
1. 放热反应与吸热反应能量图
吸热反应 放热反应
图像
能量关系 反应物的总能量 生成物的总能量 反应物的总能量 生成物的总能量
微观解释 断开化学键要 能量,形成化学键要 能量
说明 是吸热反应还是放热反应,取决于反应物的总能量和生成物的总能量的相对大小,与反应条件无关
2. 放热反应和吸热反应的举例
吸热反应 放热反应
常见类型 一般的分解反应 燃烧、中和反应、铝热反应、金属与氧气(水、酸)的反应,氧化物与水
举例 2H2O2H2↑+O2↑CaCO3CO2↑+ CaOC+H2O(g)CO+H2C+CO22COBa(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O 2H2+O22H2O2NaOH+H2SO4Na2SO4+2H2OFe2O3+2Al2Fe+Al2O32Na+2H2O2NaOH+H2↑Mg+2HClMgCl2+H2↑SO3+H2OH2SO4CaO+H2OCa(OH)2
3. 吸热过程和放热过程
吸热过程 放热过程
举例 断开化学键碘升华(固→气)液氨汽化(液→气)冰→水→水蒸气(固→液→气)铵盐溶于水 形成化学键水蒸气液化(气→液)水结冰(液→固)浓硫酸溶于水强碱溶于水
例1 (2021·江苏学测)分解水获得H2的能量变化如图所示,下列说法正确的是 ( )
A. 分解水属于吸热反应
B. 断开H—O键放出能量
C. 形成H—H键吸收能量
D. 反应物的总能量大于生成物的总能量
例2 (2020·江苏学测)下列过程需要吸收热量的是 ( )
A. 甲烷在空气中燃烧 B. 稀释浓硫酸
C. 镁条与盐酸反应 D. 冰融化成水
原电池原理
1. 原电池
能量转换 原电池是将 能转变为 的装置
装置图
电极材料 一般较活泼金属作负极,较不活泼金属作正极不一定都是金属材料,也可以是碳棒、金属氧化物、惰性电极等
特别提醒 ① 导线、两电极中 与电解质溶液中 共同组成了一个完整的闭合回路 ② “离子不上岸,电子不下线”,离子不进入电极,电子不能通过电解质溶液
2. 原电池正、负极的判断
负极 正极
电子流出的电极 电子流入的电极
失去电子的电极 得到电子的电极
发生氧化反应的电极 发生还原反应的电极
较活泼金属的电极 较不活泼金属(或非金属)的电极
阴离子移向的电极 阳离子移向的电极
通入燃料的电极 通入氧气的电极(助燃)
金属质量减少的电极 质量增加或有气体生成的电极
例3 (2021·江苏学测)某兴趣小组模拟纸电池进行实验(如图),有关说法正确的是 ( )
A. Zn为正极
B. 工作时Cu电极发生氧化反应
C. 工作时电子经外电路由Cu流向Zn
D. 工作一段时间后Cu电极质量增加
化学反应速率与化学平衡
1. 化学反应速率概念、公式、单位
2. 影响化学反应速率的因素
内因 参加反应的物质的结构和性质
外因 温度 升高温度,反应速率增大
催化剂 一般加快反应速率(正催化剂)
浓度 增大反应物的浓度,反应速率增大(溶液或气体才有浓度可言)
压强 增大压强,反应速率增大(适用于有气体参加的反应)
其他 如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变反应速率
3. 化学平衡状态的判断
可逆反应平衡状态(反应限度)的判定
反应速率 v(正)=v(逆)≠0
浓度 各组分的浓度不再改变,不要求浓度之比等于化学计量数之比
百分含量 混合体系中,各组分的百分含量不再改变
颜色 对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
化学键 对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
4. 化学平衡
(1) 概念:一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应物的浓度和生成物的浓度都不改变的状态。
(2) 平衡特点
(3) 平衡状态的本质特征[ ,各组分的 ]
(4) 常考有关速率、限度举例[按n(SO2)∶n(O2)=2∶1,2SO2(g)+O2(g)2SO3(g)]
举 例 正误 解 释
升高温度正反应速率增大,逆反应速率减小 × 正、逆反应速率都增大
降低温度加快反应速率 × 降低温度,反应速率减小
c(SO2)∶c(O2)∶c(SO3)=2∶1∶2,反应达平衡 × 各组分浓度不变才是平衡状态
经充分反应,SO2的转化率为100% × 可逆反应,反应物不能完全转化
加入催化剂能够加快反应速率 √ 加入催化剂可加快反应速率
达到平衡时,v(正)=v(逆)=0 × 达到平衡时v(正)=v(逆)≠0
例4 (2021·江苏学测)水-碳催化制氢的反应为C+H2OH2+CO,下列说法正确的是 ( )
A. 增大压强能减慢化学反应速率
B. 合适的催化剂能加快化学反应速率
C. 增大水蒸气的浓度能减慢化学反应速率
D. 达到化学平衡时,H2O全部转化为H2
达标巩固检测
【考向1 反应热】
1. (2019·江苏学测)下列反应属于吸热反应的是 ( )
A. 木炭在氧气中的燃烧反应
B. 生石灰与水的反应
C. 氢氧化钠溶液与盐酸的中和反应
D. 氢氧化钡晶体与氯化铵晶体的反应
2. (2018·江苏学测)下列过程放出热量的是 ( )
A. 甲烷燃烧 B. 碳酸钙分解
C. 液氨汽化 D. 化学键断裂
3. (2017·江苏学测)下列过程放出热量的是 ( )
A. 冰的融化 B. 水的分解
C. 硝酸铵溶于水 D. 浓硫酸稀释
4. (2016·江苏学测)下列属于吸热反应的是 ( )
A. 镁的燃烧反应 B. 盐酸与氢氧化钠的反应
C. 水的分解反应 D. 铝与氧化铁的铝热反应
5. (2015·江苏学测)下列过程吸收热量的是 ( )
A. 汽油燃烧 B. 氨气液化
C. 碳酸钙分解 D. 浓硫酸稀释
6. (2022·连云港学测合格考)下列反应属于吸热反应的是 ( )
A. 甲烷在空气中燃烧
B. 生石灰和水反应
C. 锌粒与稀硫酸反应
D. 石灰石在高温下分解反应
7. (2022·盐城学测合格考)先进的甲醇蒸气重整-变压吸附技术可得到高浓度CO2混合气、H2,化学反应原理是CH3OH+H2OCO2+3H2,其能量变化如右图所示。下列说法正确的是 ( )
A. CH3OH转变成H2的过程是一个吸收能量的过程
B. 反应物的总能量小于生成物的总能量
C. 形成H—H键放出能量
D. 断开H—C键放出能量
8. (2022·南京学测合格考)下列过程有热量放出的是 ( )
A. 断开氢气中的H-H键
B. C与H2O(g)反应
C. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
D. Na与H2O反应
9. (2022·扬州学测合格考)在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示,下列说法正确的是 ( )
A. 该反应属于吸热反应
B. 断开氧气中的化学键会放出能量
C. 形成H—O键吸收能量
D. 反应物的总能量大于生成物的总能量
【考向2 原电池】
10. (2020·江苏学测)某同学用右图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是 ( )
A. 锌片不断溶解,说明Zn失去电子
B. 铜片上产生气泡,说明溶液中H+在其表面得到电子
C. 电流计指针发生偏转,说明该装置将电能转换为化学能
D. 该装置中发生的总反应为Zn+H2SO4ZnSO4+H2↑
11. (2019·江苏学测)某同学设计的原电池装置如右图所示。电池工作时,下列说法正确的是 ( )
A. 锌片作正极
B. 盐酸作为电解质溶液
C. 电能转化为化学能
D. 电子由铜片经导线流向锌片
12. (2018·江苏学测)锂-海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2 Li+2H2O2 LiOH+H2↑。电池工作时,下列说法错误的是 ( )
A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 海水作为电解质溶液
D. 可将电能转化为化学能
13. (2020·学业水平合格性考试样卷)某原电池装置如图所示。该电池工作时,下列说法正确的是 ( )
A. 石墨棒为负极
B. 铁皮的质量减少
C. 硫酸被氧化
D. 电子从石墨棒经导线流向铁片
14. (2022·连云港学测合格考)如图原电池的反应原理为2N+ZnZn2++2NH3↑+H2↑。下列说法正确的是 ( )
A. 石墨为电池的负极
B. 电池工作时Zn逐渐被消耗
C. 电子由石墨电极经外电路流向Zn电极
D. 反应2NH+4+2e-2NH3↑+H2↑在负极上发生
15. (2019·扬州学测二模)《科学美国人》评近三年十大创新技术之一是碳呼吸电池,电池装置如图所示,下列说法正确的是 ( )
A. 金属铝作正极
B. 负极发生了还原反应
C. 利用该技术可捕捉大气中的CO2
D. 该电池工作时电能转变为化学能
16. (2022·南京学测合格考)下列关于锌铜原电池的说法中错误的是 ( )
A. 能将化学能转化为电能
B. 电子从Cu经导线流向Zn
C. 溶液中H+、S分别向铜、锌电极移动
D. 该原电池中发生的总反应为Zn + 2H+Zn2+ + H2↑
17. (2022·扬州学测合格考)关于如图所示的装置,下列说法正确的是 ( )
A. 锌片为正极
B. 铜片质量逐渐减小
C. 电子由锌片通过导线流向铜片
D. H+在锌片表面被还原
18. (2021·连云港合格考模拟)某原电池装置如右图所示,该电池工作时,下列说法正确的是 ( )
A. 铜棒为负极
B. 铜棒质量增加
C. 锌棒发生还原反应
D. 电子从铜棒经外电路流向锌棒
【考向3 反应速率 反应平衡】
19. (2020·江苏学测)反应2NO+2CON2+2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是 ( )
A. 升高温度能减慢反应速率
B. 减小CO浓度能加快反应速率
C. 使用恰当的催化剂能加快反应速率
D. 达到化学平衡时,NO能100%转化为产物
20. (2019·江苏学测)CO2+4H2CH4+2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是 ( )
A. 适当升温能加快反应速率
B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0
D. 达到平衡时,CO2能100%转化为CH4
21. (2018·江苏学测)4NH3+5O24NO+6H2O是硝酸工业中的一个反应。下列关于该反应的说法正确的是 ( )
A. 增大反应物浓度能减慢反应速率
B. 降低温度能加快反应速率
C. 使用催化剂能加快反应速率
D. NH3与O2能100%转化为产物
22. (2017·江苏学测)实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率减慢的是 ( )
A. 向稀硫酸中加水 B. 增加锌粒的量
C. 用锌粉代替锌粒 D. 升高反应温度
23. (2016·江苏学测)实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的 ( )
A. 降低反应温度 B. 延长反应时间
C. 粉碎大理石 D. 加水稀释盐酸
24. (2015·江苏学测)反应2SO2+O22SO3在密闭容器中进行。下列关于该反应的说法错误的是 ( )
A. 升高温度能加快反应速率
B. 使用恰当的催化剂能加快反应速率
C. 增大O2浓度能加快反应速率
D. SO2与O2能100%转化为SO3
25. (2022·连云港学测合格考)反应2NO2(g)N2O4(g)在一定体积的密闭容器中进行。下列说法正确的是 ( )
A. 升高温度能减慢反应速率
B. 减小N2O4浓度能加快反应速率
C. 缩小反应容器的体积能加快反应速率
D. 达到化学平衡时,NO2能100%转化为N2O4
26. (2022·盐城学测合格考)工业上H2可以发生反应:CO+2H2CH3OH。下列有关说法不正确的是 ( )
A. 增大H2的浓度,可加快反应速率
B. 使用合适催化剂,可加快反应速率
C. 达到平衡时,正反应速率与逆反应速率相等
D. 达到平衡时,CO可以完全转化
27. (2022·南京学测合格考)恒温恒容条件下,能说明反应H2(g)+I2(g)2HI(g)一定处于化学平衡状态的是 ( )
A. 消耗1 mol H2的同时生成2 mol HI
B. 混合气体的颜色不再改变
C. 容器内的压强保持不变
D. 混合气体的密度保持不变
28. (2022·扬州学测合格考)H2和CO2反应生成H2O和CH4的反应为4H2+ CO2 2H2O + CH4。下列关于该反应的说法正确的是 ( )
A. 合适的催化剂能加快反应速率
B. 适当升高温度会减慢化学反应速率
C. 增大CO2的浓度能减慢化学反应速率
D. 达到化学平衡时,CO2能全部转化为CH4
课时13 反应热 原电池 化学反应速率与限度
【考点各个击破】
考点1 小于 大于 吸收 放出
例1 A 解析:分解水属于吸热反应,A正确;断开化学键需要吸收热量,B错误;形成化学键放出热量,C错误;反应物的总能量小于生成物的总能量属于吸热反应,D错误。
例2 D 解析:燃烧属于放热反应,A错误;稀释浓硫酸放出热量,B错误;金属与酸反应属于放热反应,C错误;冰融化成水需要吸收热量,D正确。
考点2 化学 电能 电子的定向移动 阴阳离子的定向移动
例3 D 解析:Zn、Cu、CuSO4组成原电池,Zn为负极,发生氧化反应,A、B错误;电子从Zn极经外电路流入Cu极,C错误;正极电极反应式:Cu2++2e-Cu,质量增加,D正确。
考点3 4. 可逆 动态平衡 v(正)=v(逆)≠0 浓度保持不变 v(正)=v(逆)≠0 浓度保持不变
例4 B 解析:有气体参加的反应,增大压强,反应速率加快,A错误;合适的催化剂可加快反应速率,B正确;增大反应物的浓度可加快反应速率,C错误;该反应为可逆反应,反应物不能完全转化,D错误。
【达标巩固检测】
1. D 2. A 3. D 4. C 5. C 6. D
7. C 解析:根据能量变化图可知该反应为放热反应,A错误;反应物的总能量大于生成物的总能量,B错误;形成化学键放出能量,C正确;断开化学键吸收能量,D错误。
8. D
9. D 解析:该反应的反应物的总能量大于生成物的总能量为放热反应,A错误;断开化学键要吸收能量,形成化学键要放出能量,B、C错误。
10. C 11. B 12. D 13. B
14. B 解析:2N+ZnZn2++2NH3↑+H2↑,Zn失去电子为负极,被消耗,A错误;B正确;电子由负极(Zn极)流出,C错误;2N+2e-2NH3↑+H2↑在正极上发生,D错误。
15. C 16. B
17. C 解析:锌比铜易失去电子,锌为负极,锌逐渐溶解,A、B错误;电子从负极(锌片)通过导线流向铜片,C正确;H+在铜片表面被还原,D错误。
18. B 解析:负极锌失去电子,发生氧化反应,锌棒作负极,电子从锌棒流出,铜棒作正极,正极反应为Cu2++2e-Cu,铜棒质量增加,B正确。
19. C 20. A 21. C 22. A 23. C 24. D
25. C 解析:升高温度、缩小反应容器的体积均可使反应速率增大,A错误、C正确;减小反应物浓度能减慢反应速率,B错误;该反应为可逆反应,反应物不能完全转化为生成物,D错误。
26. D 解析:增大H2的浓度、使用合适催化剂均可加快反应速率,A、B正确;达到平衡时,正反应速率与逆反应速率相等,C正确;该反应为可逆反应,反应物不可能完全转化为生成物,D错误。
27. B
28. A 解析:合适的催化剂能加快反应速率,A正确;升高温度反应速率加快,B错误,增大CO2的浓度能加快化学反应速率,C错误;该反应是可逆反应,CO2不可能全部转化为CH4,D错误。
。
考点各个击破
放热反应与吸热反应
1. 放热反应与吸热反应能量图
吸热反应 放热反应
图像
能量关系 反应物的总能量 生成物的总能量 反应物的总能量 生成物的总能量
微观解释 断开化学键要 能量,形成化学键要 能量
说明 是吸热反应还是放热反应,取决于反应物的总能量和生成物的总能量的相对大小,与反应条件无关
2. 放热反应和吸热反应的举例
吸热反应 放热反应
常见类型 一般的分解反应 燃烧、中和反应、铝热反应、金属与氧气(水、酸)的反应,氧化物与水
举例 2H2O2H2↑+O2↑CaCO3CO2↑+ CaOC+H2O(g)CO+H2C+CO22COBa(OH)2·8H2O+2NH4ClBaCl2+2NH3↑+10H2O 2H2+O22H2O2NaOH+H2SO4Na2SO4+2H2OFe2O3+2Al2Fe+Al2O32Na+2H2O2NaOH+H2↑Mg+2HClMgCl2+H2↑SO3+H2OH2SO4CaO+H2OCa(OH)2
3. 吸热过程和放热过程
吸热过程 放热过程
举例 断开化学键碘升华(固→气)液氨汽化(液→气)冰→水→水蒸气(固→液→气)铵盐溶于水 形成化学键水蒸气液化(气→液)水结冰(液→固)浓硫酸溶于水强碱溶于水
例1 (2021·江苏学测)分解水获得H2的能量变化如图所示,下列说法正确的是 ( )
A. 分解水属于吸热反应
B. 断开H—O键放出能量
C. 形成H—H键吸收能量
D. 反应物的总能量大于生成物的总能量
例2 (2020·江苏学测)下列过程需要吸收热量的是 ( )
A. 甲烷在空气中燃烧 B. 稀释浓硫酸
C. 镁条与盐酸反应 D. 冰融化成水
原电池原理
1. 原电池
能量转换 原电池是将 能转变为 的装置
装置图
电极材料 一般较活泼金属作负极,较不活泼金属作正极不一定都是金属材料,也可以是碳棒、金属氧化物、惰性电极等
特别提醒 ① 导线、两电极中 与电解质溶液中 共同组成了一个完整的闭合回路 ② “离子不上岸,电子不下线”,离子不进入电极,电子不能通过电解质溶液
2. 原电池正、负极的判断
负极 正极
电子流出的电极 电子流入的电极
失去电子的电极 得到电子的电极
发生氧化反应的电极 发生还原反应的电极
较活泼金属的电极 较不活泼金属(或非金属)的电极
阴离子移向的电极 阳离子移向的电极
通入燃料的电极 通入氧气的电极(助燃)
金属质量减少的电极 质量增加或有气体生成的电极
例3 (2021·江苏学测)某兴趣小组模拟纸电池进行实验(如图),有关说法正确的是 ( )
A. Zn为正极
B. 工作时Cu电极发生氧化反应
C. 工作时电子经外电路由Cu流向Zn
D. 工作一段时间后Cu电极质量增加
化学反应速率与化学平衡
1. 化学反应速率概念、公式、单位
2. 影响化学反应速率的因素
内因 参加反应的物质的结构和性质
外因 温度 升高温度,反应速率增大
催化剂 一般加快反应速率(正催化剂)
浓度 增大反应物的浓度,反应速率增大(溶液或气体才有浓度可言)
压强 增大压强,反应速率增大(适用于有气体参加的反应)
其他 如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变反应速率
3. 化学平衡状态的判断
可逆反应平衡状态(反应限度)的判定
反应速率 v(正)=v(逆)≠0
浓度 各组分的浓度不再改变,不要求浓度之比等于化学计量数之比
百分含量 混合体系中,各组分的百分含量不再改变
颜色 对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
化学键 对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
4. 化学平衡
(1) 概念:一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应物的浓度和生成物的浓度都不改变的状态。
(2) 平衡特点
(3) 平衡状态的本质特征[ ,各组分的 ]
(4) 常考有关速率、限度举例[按n(SO2)∶n(O2)=2∶1,2SO2(g)+O2(g)2SO3(g)]
举 例 正误 解 释
升高温度正反应速率增大,逆反应速率减小 × 正、逆反应速率都增大
降低温度加快反应速率 × 降低温度,反应速率减小
c(SO2)∶c(O2)∶c(SO3)=2∶1∶2,反应达平衡 × 各组分浓度不变才是平衡状态
经充分反应,SO2的转化率为100% × 可逆反应,反应物不能完全转化
加入催化剂能够加快反应速率 √ 加入催化剂可加快反应速率
达到平衡时,v(正)=v(逆)=0 × 达到平衡时v(正)=v(逆)≠0
例4 (2021·江苏学测)水-碳催化制氢的反应为C+H2OH2+CO,下列说法正确的是 ( )
A. 增大压强能减慢化学反应速率
B. 合适的催化剂能加快化学反应速率
C. 增大水蒸气的浓度能减慢化学反应速率
D. 达到化学平衡时,H2O全部转化为H2
达标巩固检测
【考向1 反应热】
1. (2019·江苏学测)下列反应属于吸热反应的是 ( )
A. 木炭在氧气中的燃烧反应
B. 生石灰与水的反应
C. 氢氧化钠溶液与盐酸的中和反应
D. 氢氧化钡晶体与氯化铵晶体的反应
2. (2018·江苏学测)下列过程放出热量的是 ( )
A. 甲烷燃烧 B. 碳酸钙分解
C. 液氨汽化 D. 化学键断裂
3. (2017·江苏学测)下列过程放出热量的是 ( )
A. 冰的融化 B. 水的分解
C. 硝酸铵溶于水 D. 浓硫酸稀释
4. (2016·江苏学测)下列属于吸热反应的是 ( )
A. 镁的燃烧反应 B. 盐酸与氢氧化钠的反应
C. 水的分解反应 D. 铝与氧化铁的铝热反应
5. (2015·江苏学测)下列过程吸收热量的是 ( )
A. 汽油燃烧 B. 氨气液化
C. 碳酸钙分解 D. 浓硫酸稀释
6. (2022·连云港学测合格考)下列反应属于吸热反应的是 ( )
A. 甲烷在空气中燃烧
B. 生石灰和水反应
C. 锌粒与稀硫酸反应
D. 石灰石在高温下分解反应
7. (2022·盐城学测合格考)先进的甲醇蒸气重整-变压吸附技术可得到高浓度CO2混合气、H2,化学反应原理是CH3OH+H2OCO2+3H2,其能量变化如右图所示。下列说法正确的是 ( )
A. CH3OH转变成H2的过程是一个吸收能量的过程
B. 反应物的总能量小于生成物的总能量
C. 形成H—H键放出能量
D. 断开H—C键放出能量
8. (2022·南京学测合格考)下列过程有热量放出的是 ( )
A. 断开氢气中的H-H键
B. C与H2O(g)反应
C. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
D. Na与H2O反应
9. (2022·扬州学测合格考)在人体内,O2与葡萄糖反应生成H2O和CO2的能量变化如图所示,下列说法正确的是 ( )
A. 该反应属于吸热反应
B. 断开氧气中的化学键会放出能量
C. 形成H—O键吸收能量
D. 反应物的总能量大于生成物的总能量
【考向2 原电池】
10. (2020·江苏学测)某同学用右图所示装置探究原电池的工作原理,并推出下列结论,其中不正确的是 ( )
A. 锌片不断溶解,说明Zn失去电子
B. 铜片上产生气泡,说明溶液中H+在其表面得到电子
C. 电流计指针发生偏转,说明该装置将电能转换为化学能
D. 该装置中发生的总反应为Zn+H2SO4ZnSO4+H2↑
11. (2019·江苏学测)某同学设计的原电池装置如右图所示。电池工作时,下列说法正确的是 ( )
A. 锌片作正极
B. 盐酸作为电解质溶液
C. 电能转化为化学能
D. 电子由铜片经导线流向锌片
12. (2018·江苏学测)锂-海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2 Li+2H2O2 LiOH+H2↑。电池工作时,下列说法错误的是 ( )
A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 海水作为电解质溶液
D. 可将电能转化为化学能
13. (2020·学业水平合格性考试样卷)某原电池装置如图所示。该电池工作时,下列说法正确的是 ( )
A. 石墨棒为负极
B. 铁皮的质量减少
C. 硫酸被氧化
D. 电子从石墨棒经导线流向铁片
14. (2022·连云港学测合格考)如图原电池的反应原理为2N+ZnZn2++2NH3↑+H2↑。下列说法正确的是 ( )
A. 石墨为电池的负极
B. 电池工作时Zn逐渐被消耗
C. 电子由石墨电极经外电路流向Zn电极
D. 反应2NH+4+2e-2NH3↑+H2↑在负极上发生
15. (2019·扬州学测二模)《科学美国人》评近三年十大创新技术之一是碳呼吸电池,电池装置如图所示,下列说法正确的是 ( )
A. 金属铝作正极
B. 负极发生了还原反应
C. 利用该技术可捕捉大气中的CO2
D. 该电池工作时电能转变为化学能
16. (2022·南京学测合格考)下列关于锌铜原电池的说法中错误的是 ( )
A. 能将化学能转化为电能
B. 电子从Cu经导线流向Zn
C. 溶液中H+、S分别向铜、锌电极移动
D. 该原电池中发生的总反应为Zn + 2H+Zn2+ + H2↑
17. (2022·扬州学测合格考)关于如图所示的装置,下列说法正确的是 ( )
A. 锌片为正极
B. 铜片质量逐渐减小
C. 电子由锌片通过导线流向铜片
D. H+在锌片表面被还原
18. (2021·连云港合格考模拟)某原电池装置如右图所示,该电池工作时,下列说法正确的是 ( )
A. 铜棒为负极
B. 铜棒质量增加
C. 锌棒发生还原反应
D. 电子从铜棒经外电路流向锌棒
【考向3 反应速率 反应平衡】
19. (2020·江苏学测)反应2NO+2CON2+2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是 ( )
A. 升高温度能减慢反应速率
B. 减小CO浓度能加快反应速率
C. 使用恰当的催化剂能加快反应速率
D. 达到化学平衡时,NO能100%转化为产物
20. (2019·江苏学测)CO2+4H2CH4+2H2O是CO2综合利用的一种方法。下列关于该反应的说法正确的是 ( )
A. 适当升温能加快反应速率
B. 催化剂对反应速率无影响
C. 达到平衡时,正反应速率为0
D. 达到平衡时,CO2能100%转化为CH4
21. (2018·江苏学测)4NH3+5O24NO+6H2O是硝酸工业中的一个反应。下列关于该反应的说法正确的是 ( )
A. 增大反应物浓度能减慢反应速率
B. 降低温度能加快反应速率
C. 使用催化剂能加快反应速率
D. NH3与O2能100%转化为产物
22. (2017·江苏学测)实验室用锌粒和稀硫酸制取H2,下列措施可使反应速率减慢的是 ( )
A. 向稀硫酸中加水 B. 增加锌粒的量
C. 用锌粉代替锌粒 D. 升高反应温度
23. (2016·江苏学测)实验室用大理石和盐酸制备CO2。下列措施可使反应速率加快的 ( )
A. 降低反应温度 B. 延长反应时间
C. 粉碎大理石 D. 加水稀释盐酸
24. (2015·江苏学测)反应2SO2+O22SO3在密闭容器中进行。下列关于该反应的说法错误的是 ( )
A. 升高温度能加快反应速率
B. 使用恰当的催化剂能加快反应速率
C. 增大O2浓度能加快反应速率
D. SO2与O2能100%转化为SO3
25. (2022·连云港学测合格考)反应2NO2(g)N2O4(g)在一定体积的密闭容器中进行。下列说法正确的是 ( )
A. 升高温度能减慢反应速率
B. 减小N2O4浓度能加快反应速率
C. 缩小反应容器的体积能加快反应速率
D. 达到化学平衡时,NO2能100%转化为N2O4
26. (2022·盐城学测合格考)工业上H2可以发生反应:CO+2H2CH3OH。下列有关说法不正确的是 ( )
A. 增大H2的浓度,可加快反应速率
B. 使用合适催化剂,可加快反应速率
C. 达到平衡时,正反应速率与逆反应速率相等
D. 达到平衡时,CO可以完全转化
27. (2022·南京学测合格考)恒温恒容条件下,能说明反应H2(g)+I2(g)2HI(g)一定处于化学平衡状态的是 ( )
A. 消耗1 mol H2的同时生成2 mol HI
B. 混合气体的颜色不再改变
C. 容器内的压强保持不变
D. 混合气体的密度保持不变
28. (2022·扬州学测合格考)H2和CO2反应生成H2O和CH4的反应为4H2+ CO2 2H2O + CH4。下列关于该反应的说法正确的是 ( )
A. 合适的催化剂能加快反应速率
B. 适当升高温度会减慢化学反应速率
C. 增大CO2的浓度能减慢化学反应速率
D. 达到化学平衡时,CO2能全部转化为CH4
课时13 反应热 原电池 化学反应速率与限度
【考点各个击破】
考点1 小于 大于 吸收 放出
例1 A 解析:分解水属于吸热反应,A正确;断开化学键需要吸收热量,B错误;形成化学键放出热量,C错误;反应物的总能量小于生成物的总能量属于吸热反应,D错误。
例2 D 解析:燃烧属于放热反应,A错误;稀释浓硫酸放出热量,B错误;金属与酸反应属于放热反应,C错误;冰融化成水需要吸收热量,D正确。
考点2 化学 电能 电子的定向移动 阴阳离子的定向移动
例3 D 解析:Zn、Cu、CuSO4组成原电池,Zn为负极,发生氧化反应,A、B错误;电子从Zn极经外电路流入Cu极,C错误;正极电极反应式:Cu2++2e-Cu,质量增加,D正确。
考点3 4. 可逆 动态平衡 v(正)=v(逆)≠0 浓度保持不变 v(正)=v(逆)≠0 浓度保持不变
例4 B 解析:有气体参加的反应,增大压强,反应速率加快,A错误;合适的催化剂可加快反应速率,B正确;增大反应物的浓度可加快反应速率,C错误;该反应为可逆反应,反应物不能完全转化,D错误。
【达标巩固检测】
1. D 2. A 3. D 4. C 5. C 6. D
7. C 解析:根据能量变化图可知该反应为放热反应,A错误;反应物的总能量大于生成物的总能量,B错误;形成化学键放出能量,C正确;断开化学键吸收能量,D错误。
8. D
9. D 解析:该反应的反应物的总能量大于生成物的总能量为放热反应,A错误;断开化学键要吸收能量,形成化学键要放出能量,B、C错误。
10. C 11. B 12. D 13. B
14. B 解析:2N+ZnZn2++2NH3↑+H2↑,Zn失去电子为负极,被消耗,A错误;B正确;电子由负极(Zn极)流出,C错误;2N+2e-2NH3↑+H2↑在正极上发生,D错误。
15. C 16. B
17. C 解析:锌比铜易失去电子,锌为负极,锌逐渐溶解,A、B错误;电子从负极(锌片)通过导线流向铜片,C正确;H+在铜片表面被还原,D错误。
18. B 解析:负极锌失去电子,发生氧化反应,锌棒作负极,电子从锌棒流出,铜棒作正极,正极反应为Cu2++2e-Cu,铜棒质量增加,B正确。
19. C 20. A 21. C 22. A 23. C 24. D
25. C 解析:升高温度、缩小反应容器的体积均可使反应速率增大,A错误、C正确;减小反应物浓度能减慢反应速率,B错误;该反应为可逆反应,反应物不能完全转化为生成物,D错误。
26. D 解析:增大H2的浓度、使用合适催化剂均可加快反应速率,A、B正确;达到平衡时,正反应速率与逆反应速率相等,C正确;该反应为可逆反应,反应物不可能完全转化为生成物,D错误。
27. B
28. A 解析:合适的催化剂能加快反应速率,A正确;升高温度反应速率加快,B错误,增大CO2的浓度能加快化学反应速率,C错误;该反应是可逆反应,CO2不可能全部转化为CH4,D错误。
。
同课章节目录
