化学人教版(2019)必修一4.3.3 分子间作用力和氢键(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修一4.3.3 分子间作用力和氢键(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-27 20:17:31 | ||
图片预览








文档简介
(共23张PPT)
4.3.3
范德华力和氢键
第四章 物质结构 元素周期律
学习目标
01
理解范德华力和氢键;
02
了解分子间作用力和化学键的关系
03
了解分子间作用力对物质性质的影响
﹒冰山融化现象是物理变化还是化学变化?
﹒冰山融化过程中有没有破坏其中的化学键?
﹒那为什么冰山融化过程仍要吸收能量呢?
问题探究 1
我们知道:分子内部原子间存在强的相互作用——化学键,形成或破坏化学键都伴随着能量变化。
如水在通电情况下分解为氢气和氧气,水分子中H-O键被破坏,生成H-H、O-O键。
2H2O==2H2 + O2
通电
物质三态之间的转化也伴随着能量变化。这说明:分子间也存在着相互作用力。
固态水
液态水
气态水
水的三态转变
ONE
分子间作用力
1、分子间作用力(范德华力):
A.定义:分子之间普遍存在的,把分子聚集在一起的作用力,它能使许多物质以一定的凝聚态(固态和液态)存在。
B.存在范围:广泛存在(由分子构成的物质中)
※范德华力很弱,约比化学键的键能小1-2数量级。
C.范德华力大小
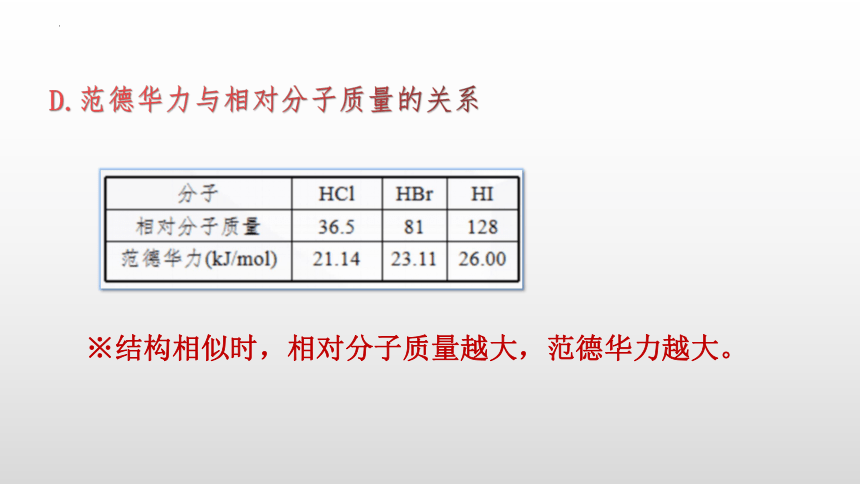
D.范德华力与相对分子质量的关系
※结构相似时,相对分子质量越大,范德华力越大。
E.范德华力与分子的极性的关系
※相对分子质量相同或相近时,分子的极性越大,范德华力越大。
F.范德华力对物质熔沸点的影响
※结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
小结:
范德华力:把分子聚集在一起的作用力。
分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
对点练习
下列物质的变化,破坏的主要是分子间作用力的是( )
A、碘单质的升华
B、NaCl溶于水
C、将水加热变为气态
D、NH4Cl受热分解
AC
对点练习
比较下列物质的熔沸点的高低
CH4 CF4 CCl4 CBr4 CI4
H2O H2S H2Se H2Te
<
<
<
<
<
<
<
联系生活实际 你能发现出什么矛盾吗
思考:有些氢化物的熔沸点的递变规律出现反常,如NH3、H2O、HF的沸点就反常的高,这是什么原因造成的呢
问题探究 2
TWO
氢键
当氢原子与非金属性较强(电负性大)的X原子以共价键结合时,它们之间的共用电子对强烈地偏向X,使H几乎成为“裸露”的质子,这样相对显正电性的H与另一分子中相对显负电性的X(或Y)原子相接近并产生静电相互作用和一定程度的轨道的重叠作用,这种相互作用称为氢键。
2、氢键:
A.定义:是比范德华力稍强另一种分子间作用力,不属于化学键。
B.大小:比化学键弱,比范德华力强。
C.分类:
①分子间氢键:会使物质的熔沸点升高<因为固体熔化或液体汽化时必须破坏分子间氢键,消耗更多能量>。 如:H2O、NH3、HF的熔沸点反常高
②分子内氢键:使物质熔沸点降低
(形成分子内氢键物质比分子间氢键的沸点和熔点更低)
D.对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合,形成(H2O)n缔合分子;
在固态水(冰)中,水分子大范围地以氢键互相联结。导致冰密度减小,会浮在水面上。
冰
对点练习
1、下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
2、固体冰中不存在的作用力是
A.离子键 B.极性键 C. 氢键 D. 范德华力
A
化学键与范德华力氢键的比较
化学键 范德华力 氢键
概念
存在范围
作用力强弱
对物质的影响
相邻的原子间强烈的相互作用
把分子聚集在一起的作用力
分子内、原子间
分子之间
较强
比化学键弱的多
主要影响化学性质
主要影响物理性质(如熔沸点)
分子内“裸露”的氢核与另一分子中带负电荷的原子产生的静电作用
分子之间
主要影响物理性质(如熔沸点)
小于化学键,大于范德华力
课后作业
1、整理笔记;
2、完成课本上P24-25习题1-9。
注:拍照上传!
4.3.3
范德华力和氢键
第四章 物质结构 元素周期律
学习目标
01
理解范德华力和氢键;
02
了解分子间作用力和化学键的关系
03
了解分子间作用力对物质性质的影响
﹒冰山融化现象是物理变化还是化学变化?
﹒冰山融化过程中有没有破坏其中的化学键?
﹒那为什么冰山融化过程仍要吸收能量呢?
问题探究 1
我们知道:分子内部原子间存在强的相互作用——化学键,形成或破坏化学键都伴随着能量变化。
如水在通电情况下分解为氢气和氧气,水分子中H-O键被破坏,生成H-H、O-O键。
2H2O==2H2 + O2
通电
物质三态之间的转化也伴随着能量变化。这说明:分子间也存在着相互作用力。
固态水
液态水
气态水
水的三态转变
ONE
分子间作用力
1、分子间作用力(范德华力):
A.定义:分子之间普遍存在的,把分子聚集在一起的作用力,它能使许多物质以一定的凝聚态(固态和液态)存在。
B.存在范围:广泛存在(由分子构成的物质中)
※范德华力很弱,约比化学键的键能小1-2数量级。
C.范德华力大小
D.范德华力与相对分子质量的关系
※结构相似时,相对分子质量越大,范德华力越大。
E.范德华力与分子的极性的关系
※相对分子质量相同或相近时,分子的极性越大,范德华力越大。
F.范德华力对物质熔沸点的影响
※结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
小结:
范德华力:把分子聚集在一起的作用力。
分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
对点练习
下列物质的变化,破坏的主要是分子间作用力的是( )
A、碘单质的升华
B、NaCl溶于水
C、将水加热变为气态
D、NH4Cl受热分解
AC
对点练习
比较下列物质的熔沸点的高低
CH4 CF4 CCl4 CBr4 CI4
H2O H2S H2Se H2Te
<
<
<
<
<
<
<
联系生活实际 你能发现出什么矛盾吗
思考:有些氢化物的熔沸点的递变规律出现反常,如NH3、H2O、HF的沸点就反常的高,这是什么原因造成的呢
问题探究 2
TWO
氢键
当氢原子与非金属性较强(电负性大)的X原子以共价键结合时,它们之间的共用电子对强烈地偏向X,使H几乎成为“裸露”的质子,这样相对显正电性的H与另一分子中相对显负电性的X(或Y)原子相接近并产生静电相互作用和一定程度的轨道的重叠作用,这种相互作用称为氢键。
2、氢键:
A.定义:是比范德华力稍强另一种分子间作用力,不属于化学键。
B.大小:比化学键弱,比范德华力强。
C.分类:
①分子间氢键:会使物质的熔沸点升高<因为固体熔化或液体汽化时必须破坏分子间氢键,消耗更多能量>。 如:H2O、NH3、HF的熔沸点反常高
②分子内氢键:使物质熔沸点降低
(形成分子内氢键物质比分子间氢键的沸点和熔点更低)
D.对水的密度的影响
在水蒸气中,水以单个H2O 分子形式存在;
在液态水中,几个水分子通过氢键结合,形成(H2O)n缔合分子;
在固态水(冰)中,水分子大范围地以氢键互相联结。导致冰密度减小,会浮在水面上。
冰
对点练习
1、下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
2、固体冰中不存在的作用力是
A.离子键 B.极性键 C. 氢键 D. 范德华力
A
化学键与范德华力氢键的比较
化学键 范德华力 氢键
概念
存在范围
作用力强弱
对物质的影响
相邻的原子间强烈的相互作用
把分子聚集在一起的作用力
分子内、原子间
分子之间
较强
比化学键弱的多
主要影响化学性质
主要影响物理性质(如熔沸点)
分子内“裸露”的氢核与另一分子中带负电荷的原子产生的静电作用
分子之间
主要影响物理性质(如熔沸点)
小于化学键,大于范德华力
课后作业
1、整理笔记;
2、完成课本上P24-25习题1-9。
注:拍照上传!
