化学人教版(2019)必修第一册4.3.2 共价键(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2 共价键(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-27 20:37:30 | ||
图片预览






文档简介
(共23张PPT)
新人教版 化学 必修一
第四章 物质结构 元素周期表
第三节 化学键
第2课时: 共价键
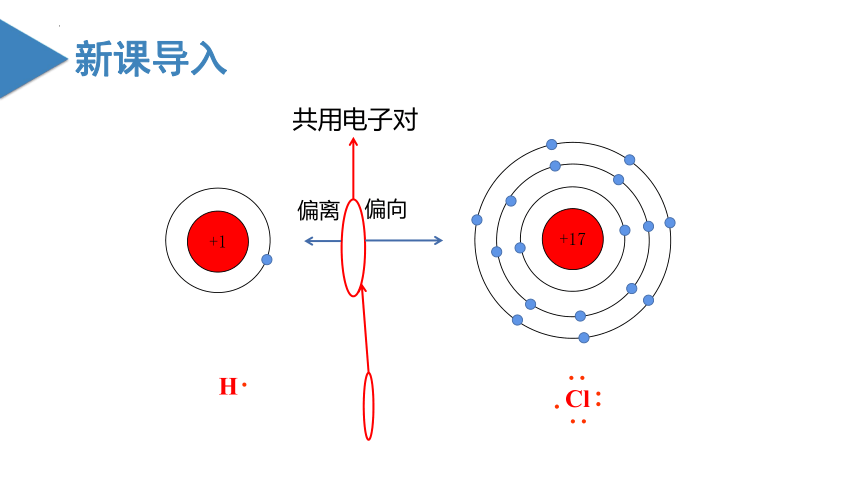
+1
+17
共用电子对
偏向
偏离
··
Cl
··
··
·
H
·
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构。
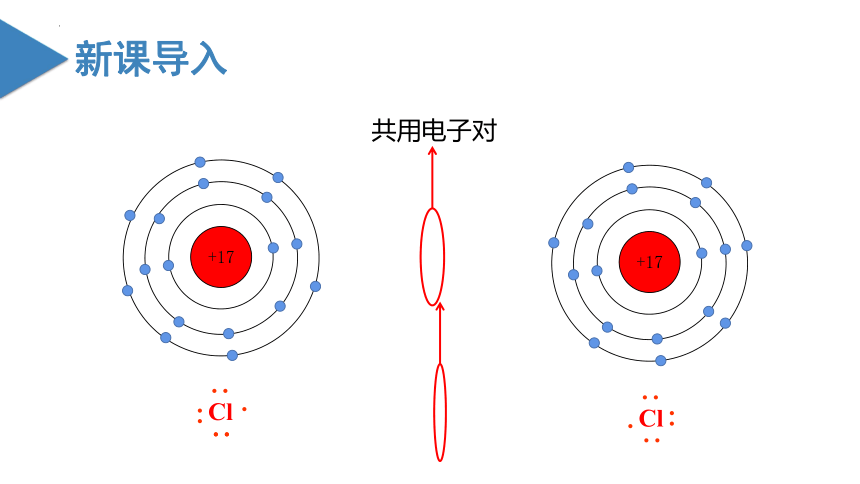
+17
+17
共用电子对
··
Cl
··
··
·
··
··
Cl
··
··
·
··
· Cl
··
:
+
→
共用电子对
··
: Cl
··
.
··
··
··
··
··
Cl
··
Cl
··
在Cl2分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构。
共价键
原子之间通过共用电子对所形成的强烈相互作用
原子
共用电子对
概念
成键粒子
成键本质
成键元素
一般由同种或不同种非金属元素形成
共价键
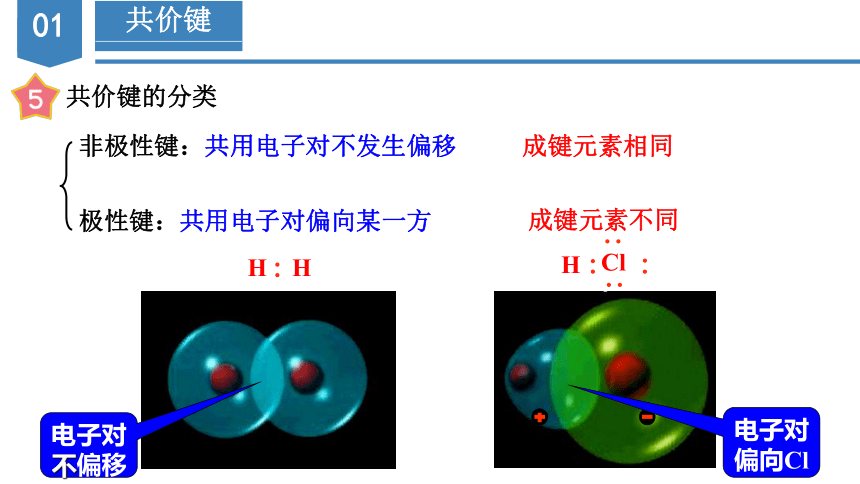
共价键的分类
非极性键:共用电子对不发生偏移
极性键:共用电子对偏向某一方
成键元素相同
成键元素不同
电子对不偏移
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
共价化合物
以共用电子对形成分子的化合物叫做共价化合物
常
见
类
型
①非金属氧化物:
②非金属氢化物:
③酸:
如CO2、SO2、NO2等
如NH3、H2O、H2S等
如H2SO4、HClO、HNO3等
④大多数有机物
如CH4、C2H5OH、C6H12O6等
⑤少数金属氯化物
如AlCl3等
共价化合物
微点拨
(1)两个“一定”
①共价化合物中一定只含有共价键
②共价化合物中一定不含有离子键
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质
如O2、N2、H2、Cl2等
②含共价键的化合物不一定是共价化合物,也可能是离子化合物
如NaOH、Na2O2、NH4Cl等
共价化合物
微提醒
(1) 共价化合物
(2) 多原子非金属单质
(3) 含根的离子化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4
HCl、 CO2 、NH3
只含有共价键的化合物
单 质
离子化合物
共价键的存在形式
电子式
H
H
H2:_____
O2:________
O
O
N2:________
Cl
Cl
Cl2:________
N
N
HCl:________
H
Cl
H2O:________
H
O
H
NH3:________
N
H
H
H
CH4:________
C
H
H
H
H
HClO:________
CO2:________
C
O
O
H
O
Cl
H2O2:________
H
O
O
H
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
微点拨
电子式
直线形
V形
正四面体形
X射线衍射法
分别用“-、═、≡”表示一对、二对和三对共用电子对
结构式
电子式
形成过程:
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
··
··
+
· O ·
··
+
.
C
.
· O ·
··
.
.
①没有电子得失,即没有弧形箭头
②相同原子可以合并
微点拨
化学键
(1) 化学键
(2) 化学键的分类
离子键
共价键
非极性键
极性键
使离子或原子相结合的强烈相互作用
(3) 化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
AgNO3 +NaCl = AgCl ↓ + NaNO3
先破坏离子键
后形成离子键
旧化学键的断裂和新化学键的形成过程
稀有气体没有化学键
离子键和共价键的比较
键型 离子键 共价键
非极性键 极性键
概念 带相反电荷离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
特点 阴、阳离子间的相互作用 共用电子对不发生偏移 共用电子对偏向吸引电子能力强的原子
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种非金属元素原子 不同种非金属元素的原子
存在 离子化合物 非金属单质,如O2;某些化合物,如Na2O2 共价化合物,如SO2;某些离子化合物,如NaOH
离子化合物 共价化合物
化学键 _______________________ ________
概念 由_______构成的化合物叫离子化合物 以___________形成分子的化合物叫共价化合物
达到稳定结构的途径 通过________达到稳定结构 通过_______________达到稳定结构
构成微粒 ___________ _____
离子化合物与共价化合物的比较
离子键或离子键与共价键
共价键
离子键
共用电子对
电子得失
形成共用电子对
阴、阳离子
原子
构成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
表示方法 以NaCl为例:电子式为 _____________; NaCl的形成过程为 ________________________ 以HCl为例:电子式为________;
HCl的形成过程为
_______________________
1.下列关于共价键的说法正确的是( )A.分子内部一定存在共价键B.由非金属元素组成的化合物,其内部一定全是共价键C.非极性键只存在于双原子单质分子中D.不同元素组成的多原子分子里一定存在极性键
D
2.下面是中学化学实验中经常进行的操作,请将对应序号填在横线上。①碘的升华 ②加热熔化氢氧化钠 ③食盐溶于水 ④氯化氢溶于水 ⑤氧气溶于水 ⑥过氧化钠溶于水其中没有发生化学键断裂的是________;只发生离子键断裂的是________;只发生共价键断裂的是________;既发生了离子键断裂,又发生共价键断裂的是________。
3.下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )A.氧分子:O===OB.S2Cl2:Cl—S—S—ClC.氢氰酸:H—C≡ND.光气(COCl2):Cl—C—O—Cl
D
4.试分析下列各种情况下粒子间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):(1)SO2溶于水时破坏________。(2)酒精溶于水时破坏_______________。(3)NaOH和HCl反应时形成________和________。(4)反应2H2+O2===2H2O中,被破坏的是________,形成的是________。(5)CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________。(6)Na2O熔化时被破坏的是________。
新人教版 化学 必修一
第四章 物质结构 元素周期表
第三节 化学键
第2课时: 共价键
+1
+17
共用电子对
偏向
偏离
··
Cl
··
··
·
H
·
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构。
+17
+17
共用电子对
··
Cl
··
··
·
··
··
Cl
··
··
·
··
· Cl
··
:
+
→
共用电子对
··
: Cl
··
.
··
··
··
··
··
Cl
··
Cl
··
在Cl2分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构。
共价键
原子之间通过共用电子对所形成的强烈相互作用
原子
共用电子对
概念
成键粒子
成键本质
成键元素
一般由同种或不同种非金属元素形成
共价键
共价键的分类
非极性键:共用电子对不发生偏移
极性键:共用电子对偏向某一方
成键元素相同
成键元素不同
电子对不偏移
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
共价化合物
以共用电子对形成分子的化合物叫做共价化合物
常
见
类
型
①非金属氧化物:
②非金属氢化物:
③酸:
如CO2、SO2、NO2等
如NH3、H2O、H2S等
如H2SO4、HClO、HNO3等
④大多数有机物
如CH4、C2H5OH、C6H12O6等
⑤少数金属氯化物
如AlCl3等
共价化合物
微点拨
(1)两个“一定”
①共价化合物中一定只含有共价键
②共价化合物中一定不含有离子键
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质
如O2、N2、H2、Cl2等
②含共价键的化合物不一定是共价化合物,也可能是离子化合物
如NaOH、Na2O2、NH4Cl等
共价化合物
微提醒
(1) 共价化合物
(2) 多原子非金属单质
(3) 含根的离子化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4
HCl、 CO2 、NH3
只含有共价键的化合物
单 质
离子化合物
共价键的存在形式
电子式
H
H
H2:_____
O2:________
O
O
N2:________
Cl
Cl
Cl2:________
N
N
HCl:________
H
Cl
H2O:________
H
O
H
NH3:________
N
H
H
H
CH4:________
C
H
H
H
H
HClO:________
CO2:________
C
O
O
H
O
Cl
H2O2:________
H
O
O
H
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
微点拨
电子式
直线形
V形
正四面体形
X射线衍射法
分别用“-、═、≡”表示一对、二对和三对共用电子对
结构式
电子式
形成过程:
HCl
H2O
H2
NH3
CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
··
··
Cl
H
··
··
··
· O ·
··
H ·
+
· H
+
··
→
O
··
H
H
:
:
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
:
· N
·
·
→
··
N
H
:
:
··
H
H
··
··
+
· O ·
··
+
.
C
.
· O ·
··
.
.
①没有电子得失,即没有弧形箭头
②相同原子可以合并
微点拨
化学键
(1) 化学键
(2) 化学键的分类
离子键
共价键
非极性键
极性键
使离子或原子相结合的强烈相互作用
(3) 化学反应的实质
点燃
Cl2+2H2 == 2HCl
先破坏非极性键
后形成极性键
AgNO3 +NaCl = AgCl ↓ + NaNO3
先破坏离子键
后形成离子键
旧化学键的断裂和新化学键的形成过程
稀有气体没有化学键
离子键和共价键的比较
键型 离子键 共价键
非极性键 极性键
概念 带相反电荷离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
特点 阴、阳离子间的相互作用 共用电子对不发生偏移 共用电子对偏向吸引电子能力强的原子
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种非金属元素原子 不同种非金属元素的原子
存在 离子化合物 非金属单质,如O2;某些化合物,如Na2O2 共价化合物,如SO2;某些离子化合物,如NaOH
离子化合物 共价化合物
化学键 _______________________ ________
概念 由_______构成的化合物叫离子化合物 以___________形成分子的化合物叫共价化合物
达到稳定结构的途径 通过________达到稳定结构 通过_______________达到稳定结构
构成微粒 ___________ _____
离子化合物与共价化合物的比较
离子键或离子键与共价键
共价键
离子键
共用电子对
电子得失
形成共用电子对
阴、阳离子
原子
构成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
表示方法 以NaCl为例:电子式为 _____________; NaCl的形成过程为 ________________________ 以HCl为例:电子式为________;
HCl的形成过程为
_______________________
1.下列关于共价键的说法正确的是( )A.分子内部一定存在共价键B.由非金属元素组成的化合物,其内部一定全是共价键C.非极性键只存在于双原子单质分子中D.不同元素组成的多原子分子里一定存在极性键
D
2.下面是中学化学实验中经常进行的操作,请将对应序号填在横线上。①碘的升华 ②加热熔化氢氧化钠 ③食盐溶于水 ④氯化氢溶于水 ⑤氧气溶于水 ⑥过氧化钠溶于水其中没有发生化学键断裂的是________;只发生离子键断裂的是________;只发生共价键断裂的是________;既发生了离子键断裂,又发生共价键断裂的是________。
3.下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )A.氧分子:O===OB.S2Cl2:Cl—S—S—ClC.氢氰酸:H—C≡ND.光气(COCl2):Cl—C—O—Cl
D
4.试分析下列各种情况下粒子间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):(1)SO2溶于水时破坏________。(2)酒精溶于水时破坏_______________。(3)NaOH和HCl反应时形成________和________。(4)反应2H2+O2===2H2O中,被破坏的是________,形成的是________。(5)CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________。(6)Na2O熔化时被破坏的是________。
