专题8.2.1 常见的酸 课件(共35张PPT 内嵌视频) -2022-2023学年九年级化学下册(科粤版)
文档属性
| 名称 | 专题8.2.1 常见的酸 课件(共35张PPT 内嵌视频) -2022-2023学年九年级化学下册(科粤版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-28 00:00:00 | ||
图片预览










文档简介
(共35张PPT)
九年级 下册
化学(科粤版)
第八章 常见的酸、碱、盐
专题8.2.1 常见的酸
(课件)
趣味导学
新知学习
02
课堂小结
随堂检测
03
04
05
知识回顾
01
知识回顾
1.(2022 柳州中考)化学课中老师给同学们变“魔术”:往浸过酚酞溶液的白色纸花上喷了某种无色溶液后,白花瞬间变成了红花,老师喷的溶液可能是( )
A.水 B.稀盐酸 C.氨水 D.氯化钠溶液
C
2.(2022 赤峰中考)用pH试纸测定苏打水的酸碱度时,如果先将试纸用蒸馏水润湿,然后再进行测定,则测得的结果与苏打水实际pH比较的结果是( )
A.偏小 B.偏大 C.不变 D.无法确定
A
知识回顾
3.(2022 桂林中考)某地的土壤呈弱碱性。如表所列作物适宜在该地种植的是( )
作物名称 马铃薯 茶树 水稻 莲
适宜生长的pH 4.8~5.5 5.0~5.5 6.0~7.0 8.0~9.0
A.马铃薯 B.茶树 C.水稻 D.莲
D
4.(2022 宜宾中考)生活中一些物质的pH范围如下,其中碱性最强的是( )A.柠檬汁(2~3) B.鸡蛋清(7~8) C.牙膏(8~9) D.炉具清洁剂(12~13)
D
趣味导学
【生活小妙招】在居家生活中,有时会在瓷砖上留下洗不掉的铁锈,非常影响美观,怎么办
酸的种类有很多,其中常见的酸有三种:
新知学习
一、常见的酸
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
新知学习
一、常见的酸
1.盐酸(HCl)
(1)物理性质:
无色、有刺激性气味的液体,易挥发。
浓盐酸的颜色、气味及挥发性
新知学习
一、常见的酸
思考:
打开浓盐酸的瓶盖后瓶口会出现白雾,这个白雾出现的原因是什么?浓盐酸敞口放置一段时间后溶质质量分数会有什么变化?
原因:浓盐酸具有很强的挥发性,挥发出来的HCl气体与空气中的水蒸气结合,形成盐酸小液滴,这就是浓盐酸敞口放置出现白雾的原因。
敞口放置在空气中的浓盐酸溶质质量会减少,同时溶质的质量分数会减少。
【练一练】(2022秋 钢城区期中)盐酸具有重要用途,下列关于盐酸的叙述中,不正确的是( )
A.盐酸是氯化氢气体的水溶液
B.浓盐酸是黄色有刺激性气味的液体
C.人的胃液里含少量的盐酸,可以帮助消化
D.浓盐酸具有挥发性,在空气中会形成白雾
B
新知学习
一、常见的酸
新知学习
一、常见的酸
2.硫酸(H2SO4)
(1)物理性质:
无色无味的油状液体,密度比水大,无挥发性。
硫酸的物理性质
(2)浓硫酸的特性
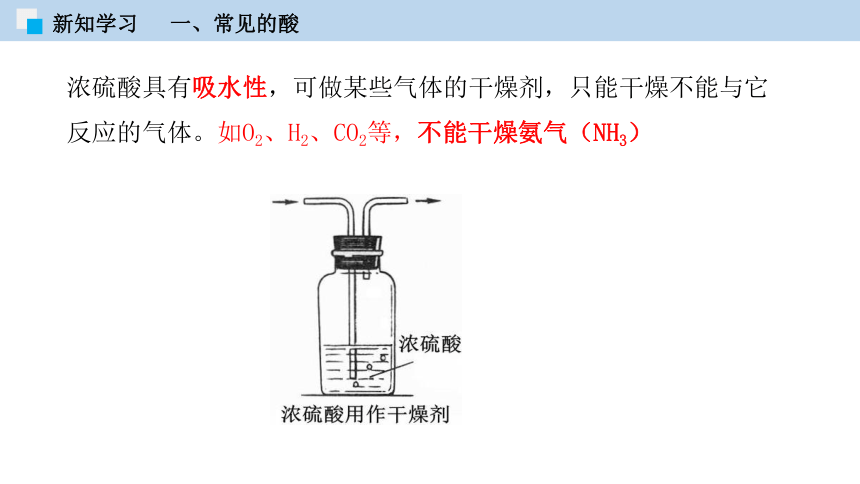
①浓硫酸具有吸水性,敞口放置易吸收空气中的水蒸气。
思考:
浓硫酸敞口放置一段时间后溶质质量、溶剂质量和溶质质量分数分别会发生什么变化?
浓硫酸具有吸水性,敞口放置会吸收空气中的水,溶剂的质量增大(溶液变稀),溶质的质量分数会减少。
新知学习
一、常见的酸
浓硫酸具有吸水性,可做某些气体的干燥剂,只能干燥不能与它反应的气体。如O2、H2、CO2等,不能干燥氨气(NH3)
新知学习
一、常见的酸
【练一练】实验室里,常用浓硫酸作为干燥剂,这是利用了浓硫酸的( )A.吸水性 B.脱水性 C.酸性 D.氧化性
【练一练】(2022秋 芝罘区期中)浓硫酸和浓盐酸敞口放置在空气中一段时间后,下列叙述正确的是( )
A.质量都增加 B.瓶口都会出现白雾
C.溶质质量分数都减少 D.都具有挥发性
A
新知学习
一、常见的酸
C
②浓硫酸具有脱水性
观察活动
目的:知道浓硫酸有脱水性
实验操作1:用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
实验现象:
写过字的地方变黑了
新知学习
一、常见的酸
实验操作2:在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
肉皮被腐蚀变黑。
实验现象:
实验操作:(3)取20g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
实验现象:
蔗糖变黑,体积增加
新知学习
一、常见的酸
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的“水分” ( 氢、氧元素 )生成黑色的炭和水。
解释与结论:
③浓硫酸具有强烈的腐蚀性
如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。如果是沾到皮肤上,还需涂上3%~5%的碳酸氢钠溶液。浓硫酸是危险品,保管和使用都要格外小心。
新知学习
一、常见的酸
浓硫酸的腐蚀性
新知学习
一、常见的酸
观察活动
目的:知道浓硫酸稀释的方法
【实验8-6】
操作 实验现象 解释
在特定容器内将少量水滴入浓硫酸中
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
水浮在水面上,立刻沸腾,液滴向四周飞溅
烧杯壁发热或烫
将密度较大的浓硫酸沿容器壁缓慢注入水里,并用玻璃棒不断搅拌使产生的热量及时扩散。
水的密度较小,浮在浓硫酸上面,溶解时放出大量热,使水立刻沸腾,使硫酸液滴向四周飞溅,非常危险
新知学习
一、常见的酸
【总结】浓硫酸的正确稀释:
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
新知学习
一、常见的酸
3.硝酸(HNO3)
(1)物理性质:
无色、有刺激性气味的液体,易挥发。
打开瓶盖后有白雾
(2)主要用途:
生产化肥、燃料、炸药
新知学习
一、常见的酸
在前面的学习中,我们知道稀酸有许多相似的性质。
如:稀酸酸溶液能使紫色石蕊溶液变成 色,不能使无色酚酞溶液变色。这是稀酸的化学通性之一。
红
那么稀酸还有没有其它的通性呢?
学生探究实验
实验目的:认识稀酸的化学性质
(1)酸与较活泼金属的反应
【回顾】回忆铁与稀硫酸的反应,并写出化学方程式。
H2SO4 + Zn = H2↑ + ZnSO4
这种由金属离子和酸根离子组成的化合物叫作盐。
如:NaCl、CaCO3等均属于盐类。
【拓展】[实验8-7]采用微型化学实验技术,选用金属活动性排在氢前面的金属(如Mg、Al、Zn、Fe等)与稀盐酸进行反应。观察现象。
【实验现象】均有气泡产生。
新知学习
二、酸的化学性质
尝试写出上述金属分别于稀盐酸和稀硫酸反应的化学方程式。
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
铝
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
思考:
上述各反应的生成物有何特点?
酸+较活泼金属===盐+氢气
新知学习
二、酸的化学性质
(2)酸与金属氧化物的反应
【回顾】回忆稀盐酸与氧化铜的反应,并写出化学方程式。
2HCl + CuO = CuCl2 +H2O
【拓展】[实验8-8]在试管中放入一支生满铁锈(主要成分是Fe2O3)的铁钉,滴入稀硫酸,加热并振荡,观察现象。
新知学习
二、酸的化学性质
实验现象:铁锈逐渐消失,溶液由无色变为黄色。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
化学方程式:
结论:酸+金属氧化物====盐+水
思考:
①你知道如何除去瓷砖表面的铁锈了吗
可用稀盐酸或稀硫酸清除瓷砖表而的锈
②用稀酸清除铁制品表而的锈时能否将铁制品长时可浸在酸中 为什么?
不能,铁锈除去之后,铁会继续跟酸反应生成氢气。
新知学习
二、酸的化学性质
(3)酸与某些盐的反应
【回顾】回忆实验室用稀盐酸与大理石制取二氧化碳的反应,并写出化学方程式。
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
【拓展】[实验8-9]采用微型化学实验技术,将稀盐酸滴入硝酸银溶液中,观察现象。
实验现象:有白色沉淀产生。
AgNO3+HCl=AgCl↓+HNO3
化学方程式:
结论:酸+盐====新酸+新盐
新知学习
二、酸的化学性质
盐酸和硫酸为什么有这些相似的化学性质
思考:
因为它们在溶于水时,都解离出相同的阳离子——H+,正是由于它的存在,才导致这些酸具有相似的化学性质,我们称为酸的通性。
利用该反应可用于检验盐酸及其它含有氯离子的化合物(如NaCl),硝酸银为检验试剂。在样品溶液中加入硝酸银溶液,若产生白色沉淀,说明该样品中含有Cl-,若没产生白色沉淀,说明该样品中不含Cl-。
新知学习
二、酸的化学性质
总结一下吧
酸的化学性质
1.能使紫色石蕊试液变红,不能使无色酚酞试液变色。
2.酸+金属反应===盐+氢气
3.酸+金属氧化物====盐+水
4.酸+盐====新酸+新盐
新知学习
二、酸的化学性质
【练一练】(2022 杭州模拟)下列物质中能与金属锌、氧化铜粉末和氯化钡溶液都发生反应的是( )
A.稀盐酸 B.稀硫酸 C.水 D.氧气
B
【练一练】(2022秋 沂源县校级期中)盐酸和硫酸具有相似的化学的性质,是因为这两种酸中都含有( )
A.H2O B.H+ C.OH﹣ D.Cl﹣
B
新知学习
二、酸的化学性质
【练一练】(2022 南川区校级模拟)物质X可发生“X+HCl→盐+水”的反应,则X可能是( )A.硝酸银 B.二氧化碳 C.氧化铜 D.锌
C
新知学习
二、酸的化学性质
【练一练】(2022 陕西中考)如图所示,稀硫酸能与相连的物质发生化学反应。(1)稀硫酸与BaCl2溶液反应的现象是 。(2)写出稀硫酸与CuO反应的化学方程式: 。
(3)若X可用作钾肥,其化学式为 。
产生白色沉淀
CuO+H2SO4═CuSO4+H2O
K2CO3或KHCO3
课堂小结
浓盐酸(HCl):易挥发,瓶口会出现白雾
浓硫酸(H2SO4):吸水性、脱水性、腐蚀性
常见的酸
酸能使石蕊溶液变红,不能使酚酞溶液变色
稀酸的化学性质
酸+较活泼金属 盐+氢气
酸+金属氧化物 盐+水
酸+盐 新酸+新盐
常见的酸及其性质
浓硝酸(HNO3):易挥发,瓶口会出现白雾
随堂检测
1.(2022秋 南岗区校级月考)下列有关酸的叙述正确的是( )
A.硫酸是重要的化工原料,可用于制化肥、农药、染料
B.盐酸敞口放置一段时间,质量会增加
C.浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%—5%的氢氧化钠溶液
D.某化合物化学式为H2SO3,该化合物不属于酸
A
2.(2022 杭州模拟)不同的酸具有相似化学性质的原因是( )
A.它们都含有酸根 B.它们都含有氢元素
C.它们溶于水后都能解离出H+ D.它们都含有氧元素
C
随堂检测
3.浓硫酸可以作某些气体的干燥剂的原因是( )A.浓硫酸具有脱水性 B.浓硫酸具有吸水性 C.浓硫酸是液体 D.浓硫酸不具有挥发性
B
4.(2022 茅箭区校级模拟)稀硫酸是实验室中常用的酸,下列属于稀硫酸的用途的是( )
A.干燥剂 B.金属除锈
C.洁厕灵的主要成分 D.存在于胃液中
B
随堂检测
5.如图表示化学反应中溶液的颜色变化,下列叙述错误的是( )
A.若X是稀硫酸,则a可能是紫色石蕊试液 B.若X是稀硫酸,则d就是CuO固体 C.若X是稀盐酸,则c可能是单质 D.若b是Fe2O3,则黄色溶液可能是氯化铁
B
6.氢溴酸是一种可溶性酸,与盐酸化学性质相似,其化学式为HBr,医药工业用其合成镇静剂和麻醉剂等医药用品,下列叙述正确的是( )A.HBr溶液能使无色酚酞变红 B.HBr溶液不能清除铁锈 C.HBr溶液和铁反应生成FeBr3 D.HBr溶液与石灰石混合能产生使澄清石灰水变浑浊的气体
随堂检测
D
随堂检测
7.(西藏·中考)某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(3)请你写出符合编号③反应的化学方程式 。(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是 。
(1)编号①反应的指示剂是 ;编号②反应的金属单质是 。(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是 反应。
紫色石蕊溶液
铁
置换
Fe2O3+6HCl═2FeCl3+3H2O
产生白色沉淀
九年级 下册
化学(科粤版)
第八章 常见的酸、碱、盐
专题8.2.1 常见的酸
(课件)
趣味导学
新知学习
02
课堂小结
随堂检测
03
04
05
知识回顾
01
知识回顾
1.(2022 柳州中考)化学课中老师给同学们变“魔术”:往浸过酚酞溶液的白色纸花上喷了某种无色溶液后,白花瞬间变成了红花,老师喷的溶液可能是( )
A.水 B.稀盐酸 C.氨水 D.氯化钠溶液
C
2.(2022 赤峰中考)用pH试纸测定苏打水的酸碱度时,如果先将试纸用蒸馏水润湿,然后再进行测定,则测得的结果与苏打水实际pH比较的结果是( )
A.偏小 B.偏大 C.不变 D.无法确定
A
知识回顾
3.(2022 桂林中考)某地的土壤呈弱碱性。如表所列作物适宜在该地种植的是( )
作物名称 马铃薯 茶树 水稻 莲
适宜生长的pH 4.8~5.5 5.0~5.5 6.0~7.0 8.0~9.0
A.马铃薯 B.茶树 C.水稻 D.莲
D
4.(2022 宜宾中考)生活中一些物质的pH范围如下,其中碱性最强的是( )A.柠檬汁(2~3) B.鸡蛋清(7~8) C.牙膏(8~9) D.炉具清洁剂(12~13)
D
趣味导学
【生活小妙招】在居家生活中,有时会在瓷砖上留下洗不掉的铁锈,非常影响美观,怎么办
酸的种类有很多,其中常见的酸有三种:
新知学习
一、常见的酸
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
新知学习
一、常见的酸
1.盐酸(HCl)
(1)物理性质:
无色、有刺激性气味的液体,易挥发。
浓盐酸的颜色、气味及挥发性
新知学习
一、常见的酸
思考:
打开浓盐酸的瓶盖后瓶口会出现白雾,这个白雾出现的原因是什么?浓盐酸敞口放置一段时间后溶质质量分数会有什么变化?
原因:浓盐酸具有很强的挥发性,挥发出来的HCl气体与空气中的水蒸气结合,形成盐酸小液滴,这就是浓盐酸敞口放置出现白雾的原因。
敞口放置在空气中的浓盐酸溶质质量会减少,同时溶质的质量分数会减少。
【练一练】(2022秋 钢城区期中)盐酸具有重要用途,下列关于盐酸的叙述中,不正确的是( )
A.盐酸是氯化氢气体的水溶液
B.浓盐酸是黄色有刺激性气味的液体
C.人的胃液里含少量的盐酸,可以帮助消化
D.浓盐酸具有挥发性,在空气中会形成白雾
B
新知学习
一、常见的酸
新知学习
一、常见的酸
2.硫酸(H2SO4)
(1)物理性质:
无色无味的油状液体,密度比水大,无挥发性。
硫酸的物理性质
(2)浓硫酸的特性
①浓硫酸具有吸水性,敞口放置易吸收空气中的水蒸气。
思考:
浓硫酸敞口放置一段时间后溶质质量、溶剂质量和溶质质量分数分别会发生什么变化?
浓硫酸具有吸水性,敞口放置会吸收空气中的水,溶剂的质量增大(溶液变稀),溶质的质量分数会减少。
新知学习
一、常见的酸
浓硫酸具有吸水性,可做某些气体的干燥剂,只能干燥不能与它反应的气体。如O2、H2、CO2等,不能干燥氨气(NH3)
新知学习
一、常见的酸
【练一练】实验室里,常用浓硫酸作为干燥剂,这是利用了浓硫酸的( )A.吸水性 B.脱水性 C.酸性 D.氧化性
【练一练】(2022秋 芝罘区期中)浓硫酸和浓盐酸敞口放置在空气中一段时间后,下列叙述正确的是( )
A.质量都增加 B.瓶口都会出现白雾
C.溶质质量分数都减少 D.都具有挥发性
A
新知学习
一、常见的酸
C
②浓硫酸具有脱水性
观察活动
目的:知道浓硫酸有脱水性
实验操作1:用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
实验现象:
写过字的地方变黑了
新知学习
一、常见的酸
实验操作2:在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
肉皮被腐蚀变黑。
实验现象:
实验操作:(3)取20g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
实验现象:
蔗糖变黑,体积增加
新知学习
一、常见的酸
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的“水分” ( 氢、氧元素 )生成黑色的炭和水。
解释与结论:
③浓硫酸具有强烈的腐蚀性
如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。如果是沾到皮肤上,还需涂上3%~5%的碳酸氢钠溶液。浓硫酸是危险品,保管和使用都要格外小心。
新知学习
一、常见的酸
浓硫酸的腐蚀性
新知学习
一、常见的酸
观察活动
目的:知道浓硫酸稀释的方法
【实验8-6】
操作 实验现象 解释
在特定容器内将少量水滴入浓硫酸中
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
水浮在水面上,立刻沸腾,液滴向四周飞溅
烧杯壁发热或烫
将密度较大的浓硫酸沿容器壁缓慢注入水里,并用玻璃棒不断搅拌使产生的热量及时扩散。
水的密度较小,浮在浓硫酸上面,溶解时放出大量热,使水立刻沸腾,使硫酸液滴向四周飞溅,非常危险
新知学习
一、常见的酸
【总结】浓硫酸的正确稀释:
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
新知学习
一、常见的酸
3.硝酸(HNO3)
(1)物理性质:
无色、有刺激性气味的液体,易挥发。
打开瓶盖后有白雾
(2)主要用途:
生产化肥、燃料、炸药
新知学习
一、常见的酸
在前面的学习中,我们知道稀酸有许多相似的性质。
如:稀酸酸溶液能使紫色石蕊溶液变成 色,不能使无色酚酞溶液变色。这是稀酸的化学通性之一。
红
那么稀酸还有没有其它的通性呢?
学生探究实验
实验目的:认识稀酸的化学性质
(1)酸与较活泼金属的反应
【回顾】回忆铁与稀硫酸的反应,并写出化学方程式。
H2SO4 + Zn = H2↑ + ZnSO4
这种由金属离子和酸根离子组成的化合物叫作盐。
如:NaCl、CaCO3等均属于盐类。
【拓展】[实验8-7]采用微型化学实验技术,选用金属活动性排在氢前面的金属(如Mg、Al、Zn、Fe等)与稀盐酸进行反应。观察现象。
【实验现象】均有气泡产生。
新知学习
二、酸的化学性质
尝试写出上述金属分别于稀盐酸和稀硫酸反应的化学方程式。
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
铝
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
思考:
上述各反应的生成物有何特点?
酸+较活泼金属===盐+氢气
新知学习
二、酸的化学性质
(2)酸与金属氧化物的反应
【回顾】回忆稀盐酸与氧化铜的反应,并写出化学方程式。
2HCl + CuO = CuCl2 +H2O
【拓展】[实验8-8]在试管中放入一支生满铁锈(主要成分是Fe2O3)的铁钉,滴入稀硫酸,加热并振荡,观察现象。
新知学习
二、酸的化学性质
实验现象:铁锈逐渐消失,溶液由无色变为黄色。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
化学方程式:
结论:酸+金属氧化物====盐+水
思考:
①你知道如何除去瓷砖表面的铁锈了吗
可用稀盐酸或稀硫酸清除瓷砖表而的锈
②用稀酸清除铁制品表而的锈时能否将铁制品长时可浸在酸中 为什么?
不能,铁锈除去之后,铁会继续跟酸反应生成氢气。
新知学习
二、酸的化学性质
(3)酸与某些盐的反应
【回顾】回忆实验室用稀盐酸与大理石制取二氧化碳的反应,并写出化学方程式。
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
【拓展】[实验8-9]采用微型化学实验技术,将稀盐酸滴入硝酸银溶液中,观察现象。
实验现象:有白色沉淀产生。
AgNO3+HCl=AgCl↓+HNO3
化学方程式:
结论:酸+盐====新酸+新盐
新知学习
二、酸的化学性质
盐酸和硫酸为什么有这些相似的化学性质
思考:
因为它们在溶于水时,都解离出相同的阳离子——H+,正是由于它的存在,才导致这些酸具有相似的化学性质,我们称为酸的通性。
利用该反应可用于检验盐酸及其它含有氯离子的化合物(如NaCl),硝酸银为检验试剂。在样品溶液中加入硝酸银溶液,若产生白色沉淀,说明该样品中含有Cl-,若没产生白色沉淀,说明该样品中不含Cl-。
新知学习
二、酸的化学性质
总结一下吧
酸的化学性质
1.能使紫色石蕊试液变红,不能使无色酚酞试液变色。
2.酸+金属反应===盐+氢气
3.酸+金属氧化物====盐+水
4.酸+盐====新酸+新盐
新知学习
二、酸的化学性质
【练一练】(2022 杭州模拟)下列物质中能与金属锌、氧化铜粉末和氯化钡溶液都发生反应的是( )
A.稀盐酸 B.稀硫酸 C.水 D.氧气
B
【练一练】(2022秋 沂源县校级期中)盐酸和硫酸具有相似的化学的性质,是因为这两种酸中都含有( )
A.H2O B.H+ C.OH﹣ D.Cl﹣
B
新知学习
二、酸的化学性质
【练一练】(2022 南川区校级模拟)物质X可发生“X+HCl→盐+水”的反应,则X可能是( )A.硝酸银 B.二氧化碳 C.氧化铜 D.锌
C
新知学习
二、酸的化学性质
【练一练】(2022 陕西中考)如图所示,稀硫酸能与相连的物质发生化学反应。(1)稀硫酸与BaCl2溶液反应的现象是 。(2)写出稀硫酸与CuO反应的化学方程式: 。
(3)若X可用作钾肥,其化学式为 。
产生白色沉淀
CuO+H2SO4═CuSO4+H2O
K2CO3或KHCO3
课堂小结
浓盐酸(HCl):易挥发,瓶口会出现白雾
浓硫酸(H2SO4):吸水性、脱水性、腐蚀性
常见的酸
酸能使石蕊溶液变红,不能使酚酞溶液变色
稀酸的化学性质
酸+较活泼金属 盐+氢气
酸+金属氧化物 盐+水
酸+盐 新酸+新盐
常见的酸及其性质
浓硝酸(HNO3):易挥发,瓶口会出现白雾
随堂检测
1.(2022秋 南岗区校级月考)下列有关酸的叙述正确的是( )
A.硫酸是重要的化工原料,可用于制化肥、农药、染料
B.盐酸敞口放置一段时间,质量会增加
C.浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%—5%的氢氧化钠溶液
D.某化合物化学式为H2SO3,该化合物不属于酸
A
2.(2022 杭州模拟)不同的酸具有相似化学性质的原因是( )
A.它们都含有酸根 B.它们都含有氢元素
C.它们溶于水后都能解离出H+ D.它们都含有氧元素
C
随堂检测
3.浓硫酸可以作某些气体的干燥剂的原因是( )A.浓硫酸具有脱水性 B.浓硫酸具有吸水性 C.浓硫酸是液体 D.浓硫酸不具有挥发性
B
4.(2022 茅箭区校级模拟)稀硫酸是实验室中常用的酸,下列属于稀硫酸的用途的是( )
A.干燥剂 B.金属除锈
C.洁厕灵的主要成分 D.存在于胃液中
B
随堂检测
5.如图表示化学反应中溶液的颜色变化,下列叙述错误的是( )
A.若X是稀硫酸,则a可能是紫色石蕊试液 B.若X是稀硫酸,则d就是CuO固体 C.若X是稀盐酸,则c可能是单质 D.若b是Fe2O3,则黄色溶液可能是氯化铁
B
6.氢溴酸是一种可溶性酸,与盐酸化学性质相似,其化学式为HBr,医药工业用其合成镇静剂和麻醉剂等医药用品,下列叙述正确的是( )A.HBr溶液能使无色酚酞变红 B.HBr溶液不能清除铁锈 C.HBr溶液和铁反应生成FeBr3 D.HBr溶液与石灰石混合能产生使澄清石灰水变浑浊的气体
随堂检测
D
随堂检测
7.(西藏·中考)某同学在实验探究中发现了一些物质之间发生化学反应的颜色变化,如图所示。
(3)请你写出符合编号③反应的化学方程式 。(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是 。
(1)编号①反应的指示剂是 ;编号②反应的金属单质是 。(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是 反应。
紫色石蕊溶液
铁
置换
Fe2O3+6HCl═2FeCl3+3H2O
产生白色沉淀
