九年级化学上学期第六单元知识点复习课件(24页)(人教版)
文档属性
| 名称 | 九年级化学上学期第六单元知识点复习课件(24页)(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 15:33:22 | ||
图片预览




文档简介
(共24张PPT)
人教版 期末复习
第六单元《碳和碳的氧化物》
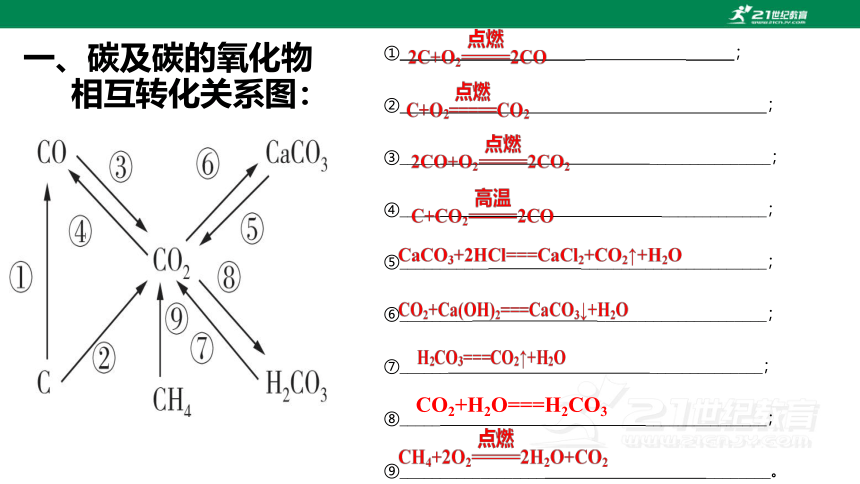
① ;
② ;
③_____ _______________;
④_____ _____________;
⑤___________ _______________________;
⑥_________ _____________________;
⑦______ ______________;
⑧_____ _______________;
⑨__________________ ________。
CO2+H2O===H2CO3
一、碳及碳的氧化物
相互转化关系图:
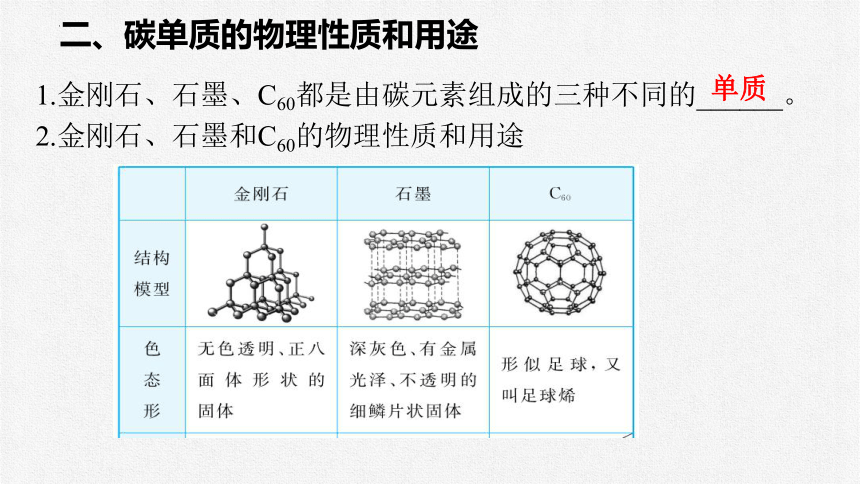
二、碳单质的物理性质和用途
1.金刚石、石墨、C60都是由碳元素组成的三种不同的______。
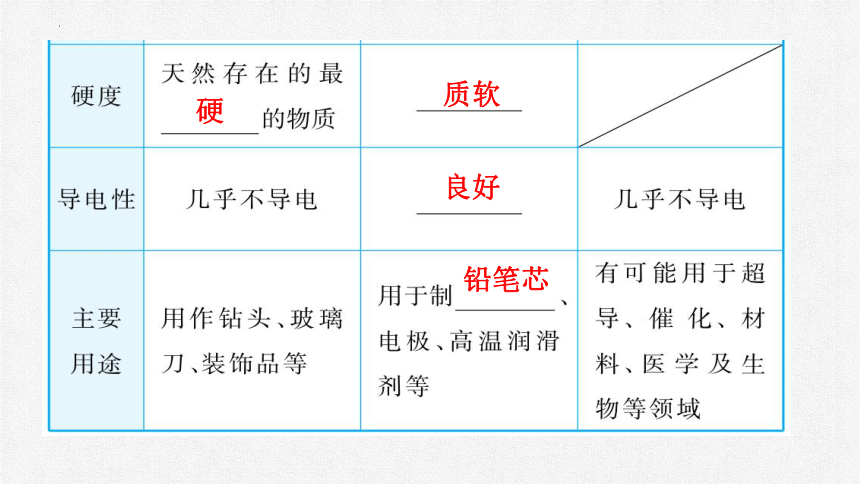
2.金刚石、石墨和C60的物理性质和用途
单质
硬
质软
良好
铅笔芯
碳元素
原子
分子
二氧化碳
化学
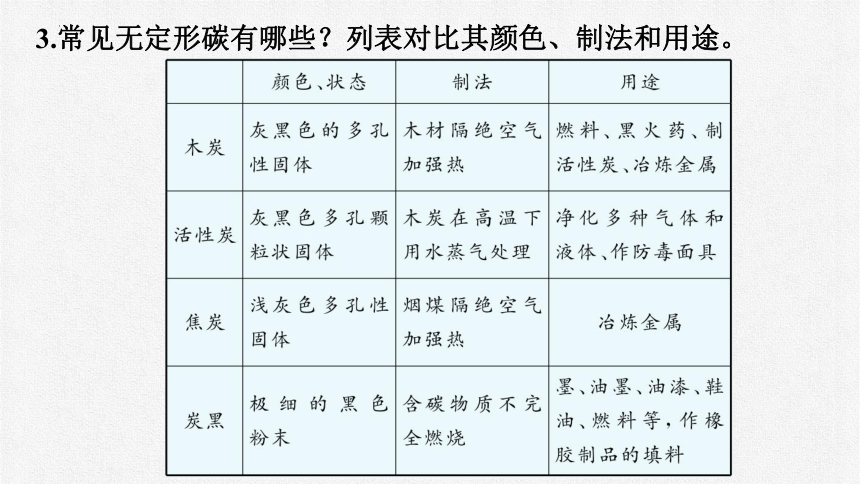
3.常见无定形碳有哪些?列表对比其颜色、制法和用途。
三、单质碳的化学性质
1.常温下,碳的化学性质 。
2.点燃条件下具有可燃性。
氧气充足时,反应的化学方程式为 ;氧气不足时,反应的化学方程式为 。
3.高温条件下具有还原性。
(1)木炭与氧化铜的反应
①实验现象: ,生成的气体能使澄清石灰水变 。
比较稳定
有红色物质生成
浑浊
②化学方程式: 。
③反应类型:含氧化合物里的氧被夺去,属于 。该性质可用于_____工业,如焦炭从铁的氧化物矿石中还原出铁的反应为_________________________。
(2)高温下与CO2反应生成CO,反应的化学方程式为
。
还原反应
冶金
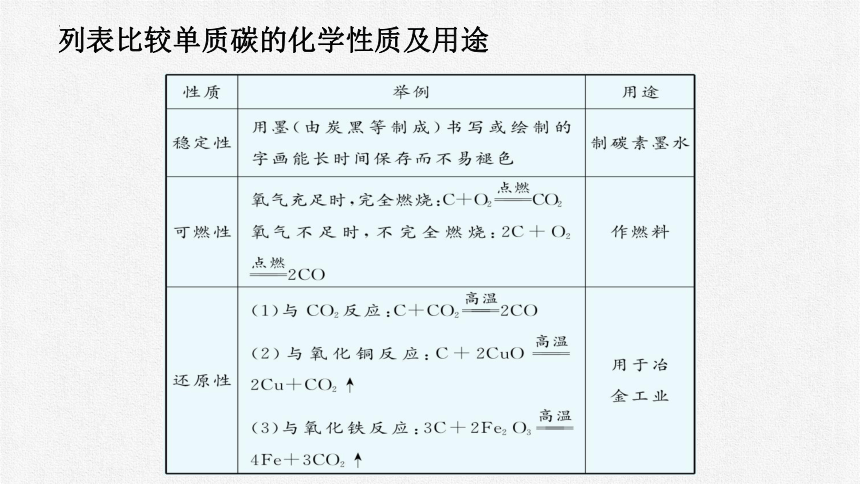
列表比较单质碳的化学性质及用途
四、二氧化碳和一氧化碳
(一)二氧化碳
1.物理性质:无色无味气体,密度比空气的大,能溶于水,固体CO2叫干冰,易升华。
2.化学性质:
(1)CO2不能燃烧,不支持燃烧,也不支持呼吸。
(2)CO2能与水反应:反应的化学方程式为 。
生成的碳酸能使紫色的石蕊溶液变 。碳酸不稳定,易分解,反应的化学方程式为 。
CO2+H2O===H2CO3
红色
H2CO3===CO2↑+H2O
(3)CO2与碱溶液反应:如能使澄清石灰水 ,该反应可用于检验CO2,反应的化学方程式
为 。
CO2也可与氢氧化钠溶液反应,该反应可用于除去H2、O2等气体中的CO2杂质,反应的化学方程式
为 。
变浑浊
CO2+Ca(OH)2===CaCO3↓+H2O
CO2+2NaOH===Na2CO3+H2O
(二)一氧化碳
1.物理性质: 色、 气味, 溶于水,
密度与空气相比 。
2.化学性质
(1)可燃性:纯净的CO在空气中点燃时,能产生 色火焰,放出大量的热,反应的化学方程式为 。
无
无
难
略小
蓝
(2)还原性:CO还原Fe2O3的化学方程式
为 ,现象为 。CO还原CuO的化学方程式为 ,现象为 。
(3)剧毒性:CO有毒是因为其极易与血液中的 结合,从而使 ,造成生物体缺氧,甚至危及生命。
3.用途 (1) ;(2) 。
红色粉末变为黑色
黑色粉末变为红色
血红蛋白
血红蛋白失去结合氧气的能力
供给呼吸
支持燃烧
1.一氧化碳和二氧化碳的鉴别方法
知识梳理:
2.一氧化碳中(二氧化碳)混有少量二氧化碳(一氧化碳)的除杂方法
五、二氧化碳的制法
1.二氧化碳的实验室制法
原理:用石灰石(大理石)和稀盐酸反应:CaCO3+2HCl===__________________
发生装置:固液不加热型
收集方法:向上排空气法
验证方法:将制得的气体通入 中,如变浑浊,则是二氧化碳。
验满方法:将 的木条放在集气瓶 ,木条熄灭,证明已收集满二氧化碳。
CaCl2+H2O+CO2↑
澄清石灰水
燃着
口
2.二氧化碳的工业制法
高温煅烧石灰石:CaCO3=====CaO+CO2↑。
[生石灰和水反应可得熟石灰:CaO+H2O===Ca(OH)2]
1.列表比较实验室制取二氧化碳的药品、原理、装置(特点)、收集方法、操作步骤等
高温
知识梳理:
2.如图为“多功能瓶”。请列举其不同功能。
注意:多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。洗气瓶一般用来检验气体(如二氧化碳)、干燥气体(如混有水蒸气的气体)、吸收气体(如二氧化硫)或除去气体中的杂质(如HCl气体等)。
(1)检验气体:检验二氧化碳的试剂是澄清的石灰水。
(2)干燥气体:试剂一般是浓硫酸。需要注意的是,浓硫酸不能干燥NH3等碱性气体。
(3)吸收气体或除去气体中的杂质:对于混在CO2中的HCl气体,不可以使用NaOH溶液吸收,但可以使用饱和NaHCO3溶液来吸收。
药品 石灰石(或大理石)和稀盐酸 反应原理 _________________________________ 制取装置(固液常温型)
发生装置特点 操作简便 便于添加液体 _______________
收集方法 向上排空气法 验满 ________________________________________________ 验证 _____________________________________________________________ CaCO3+2HCl===CaCl2+H2O+CO2↑
控制反应速率
将燃着的木条放在集气瓶口,若火焰熄灭,证明已满
倒入澄清石灰水中,若石灰水变浑浊,证明是二氧化碳
注意 1.在二氧化碳的实验室制法中,不能用稀硫酸与块状石灰石来制取CO2,这是因为H2SO4与CaCO3反应生成微溶的CaSO4,它会覆盖在石灰石的表面,阻碍反应的进行。也不能用浓盐酸与石灰石反应来制取CO2,因为浓盐酸有挥发性,挥发出氯化氢气体造成制取的CO2不纯。
2.收集二氧化碳一般不用排水法,因为二氧化碳能溶于水并能与水反应。
3.“检验”与“验满”混淆:检验CO2用的是澄清石灰水;而用向上排空气法收集CO2验满时,是将燃着的木条放在集气瓶口。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教版 期末复习
第六单元《碳和碳的氧化物》
① ;
② ;
③_____ _______________;
④_____ _____________;
⑤___________ _______________________;
⑥_________ _____________________;
⑦______ ______________;
⑧_____ _______________;
⑨__________________ ________。
CO2+H2O===H2CO3
一、碳及碳的氧化物
相互转化关系图:
二、碳单质的物理性质和用途
1.金刚石、石墨、C60都是由碳元素组成的三种不同的______。
2.金刚石、石墨和C60的物理性质和用途
单质
硬
质软
良好
铅笔芯
碳元素
原子
分子
二氧化碳
化学
3.常见无定形碳有哪些?列表对比其颜色、制法和用途。
三、单质碳的化学性质
1.常温下,碳的化学性质 。
2.点燃条件下具有可燃性。
氧气充足时,反应的化学方程式为 ;氧气不足时,反应的化学方程式为 。
3.高温条件下具有还原性。
(1)木炭与氧化铜的反应
①实验现象: ,生成的气体能使澄清石灰水变 。
比较稳定
有红色物质生成
浑浊
②化学方程式: 。
③反应类型:含氧化合物里的氧被夺去,属于 。该性质可用于_____工业,如焦炭从铁的氧化物矿石中还原出铁的反应为_________________________。
(2)高温下与CO2反应生成CO,反应的化学方程式为
。
还原反应
冶金
列表比较单质碳的化学性质及用途
四、二氧化碳和一氧化碳
(一)二氧化碳
1.物理性质:无色无味气体,密度比空气的大,能溶于水,固体CO2叫干冰,易升华。
2.化学性质:
(1)CO2不能燃烧,不支持燃烧,也不支持呼吸。
(2)CO2能与水反应:反应的化学方程式为 。
生成的碳酸能使紫色的石蕊溶液变 。碳酸不稳定,易分解,反应的化学方程式为 。
CO2+H2O===H2CO3
红色
H2CO3===CO2↑+H2O
(3)CO2与碱溶液反应:如能使澄清石灰水 ,该反应可用于检验CO2,反应的化学方程式
为 。
CO2也可与氢氧化钠溶液反应,该反应可用于除去H2、O2等气体中的CO2杂质,反应的化学方程式
为 。
变浑浊
CO2+Ca(OH)2===CaCO3↓+H2O
CO2+2NaOH===Na2CO3+H2O
(二)一氧化碳
1.物理性质: 色、 气味, 溶于水,
密度与空气相比 。
2.化学性质
(1)可燃性:纯净的CO在空气中点燃时,能产生 色火焰,放出大量的热,反应的化学方程式为 。
无
无
难
略小
蓝
(2)还原性:CO还原Fe2O3的化学方程式
为 ,现象为 。CO还原CuO的化学方程式为 ,现象为 。
(3)剧毒性:CO有毒是因为其极易与血液中的 结合,从而使 ,造成生物体缺氧,甚至危及生命。
3.用途 (1) ;(2) 。
红色粉末变为黑色
黑色粉末变为红色
血红蛋白
血红蛋白失去结合氧气的能力
供给呼吸
支持燃烧
1.一氧化碳和二氧化碳的鉴别方法
知识梳理:
2.一氧化碳中(二氧化碳)混有少量二氧化碳(一氧化碳)的除杂方法
五、二氧化碳的制法
1.二氧化碳的实验室制法
原理:用石灰石(大理石)和稀盐酸反应:CaCO3+2HCl===__________________
发生装置:固液不加热型
收集方法:向上排空气法
验证方法:将制得的气体通入 中,如变浑浊,则是二氧化碳。
验满方法:将 的木条放在集气瓶 ,木条熄灭,证明已收集满二氧化碳。
CaCl2+H2O+CO2↑
澄清石灰水
燃着
口
2.二氧化碳的工业制法
高温煅烧石灰石:CaCO3=====CaO+CO2↑。
[生石灰和水反应可得熟石灰:CaO+H2O===Ca(OH)2]
1.列表比较实验室制取二氧化碳的药品、原理、装置(特点)、收集方法、操作步骤等
高温
知识梳理:
2.如图为“多功能瓶”。请列举其不同功能。
注意:多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。洗气瓶一般用来检验气体(如二氧化碳)、干燥气体(如混有水蒸气的气体)、吸收气体(如二氧化硫)或除去气体中的杂质(如HCl气体等)。
(1)检验气体:检验二氧化碳的试剂是澄清的石灰水。
(2)干燥气体:试剂一般是浓硫酸。需要注意的是,浓硫酸不能干燥NH3等碱性气体。
(3)吸收气体或除去气体中的杂质:对于混在CO2中的HCl气体,不可以使用NaOH溶液吸收,但可以使用饱和NaHCO3溶液来吸收。
药品 石灰石(或大理石)和稀盐酸 反应原理 _________________________________ 制取装置(固液常温型)
发生装置特点 操作简便 便于添加液体 _______________
收集方法 向上排空气法 验满 ________________________________________________ 验证 _____________________________________________________________ CaCO3+2HCl===CaCl2+H2O+CO2↑
控制反应速率
将燃着的木条放在集气瓶口,若火焰熄灭,证明已满
倒入澄清石灰水中,若石灰水变浑浊,证明是二氧化碳
注意 1.在二氧化碳的实验室制法中,不能用稀硫酸与块状石灰石来制取CO2,这是因为H2SO4与CaCO3反应生成微溶的CaSO4,它会覆盖在石灰石的表面,阻碍反应的进行。也不能用浓盐酸与石灰石反应来制取CO2,因为浓盐酸有挥发性,挥发出氯化氢气体造成制取的CO2不纯。
2.收集二氧化碳一般不用排水法,因为二氧化碳能溶于水并能与水反应。
3.“检验”与“验满”混淆:检验CO2用的是澄清石灰水;而用向上排空气法收集CO2验满时,是将燃着的木条放在集气瓶口。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
