【人教版】化学九年级下册-第九单元 整理与复习 (习题课件)
文档属性
| 名称 | 【人教版】化学九年级下册-第九单元 整理与复习 (习题课件) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 10:48:31 | ||
图片预览





文档简介
(共22张PPT)
第九单元 整理与复习
第九单元 溶液
必
●
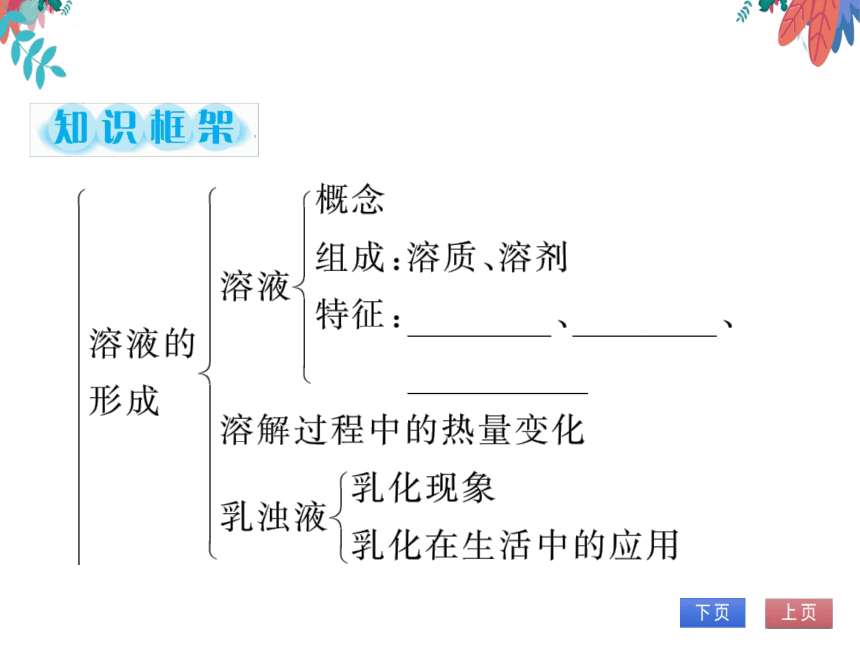
知识框架
概念
组成:溶质、溶剂
溶液
特征:
均一、
稳定
溶液的
混合物
形成
溶解过程中的热量变化
乳化现象
乳浊液
乳化在生活中的应用
饱和溶液与「概念
不饱和溶液相互转化
概念
影响因素:温度
溶液
固体溶解度
溶解度曲线
表示方法
溶解度
溶解度数据表
与溶解性的关系
概念
气体溶解度
影响因素:压强和温度
概念
结晶
蒸发溶剂
结晶的方法
冷却热饱和溶液
概念
溶质的质量分数
计算公式
溶液的
配制一定溶质质量分数的溶液
浓度
步骤、仪器、误差分析
有关溶液浓度的计算
考点突破
考点1溶液的概念
例1
下列有关溶液的说法正确的是
(A)
A.溶液一定是混合物
B.溶液是均一的、稳定的无色透明液体
C.食盐水是溶液,糖水也是溶液,两者混合在一
起则不叫溶液
D.一杯调好的糖水,喝第一口感觉特别甜,越喝
越不甜,说明后面喝到的糖水中含糖少
【獬析】溶液一定是均一、稳定的混合物,但不一定是无色透
明液体,A对B错;一种溶液中可含有多种溶质,C错;一杯
调好的糖水,喝第一口感觉特别甜,越喝越不甜,是由于人味
觉的敏感度被反复刺激后下降,故D错。
考点2
溶解度与溶解度曲线
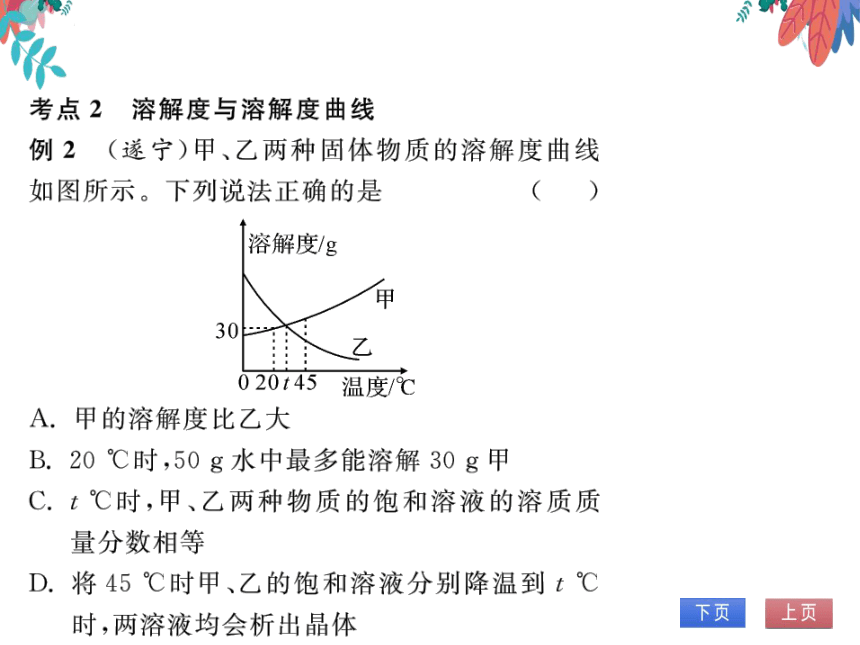
例2(遂宁)甲、乙两种固体物质的溶解度曲线
如图所示。下列说法正确的是
(C)
溶解度/g
甲
30
乙
020t45
温度/℃
A.甲的溶解度比乙大
B.20℃时,50g水中最多能溶解30g甲
C.t℃时,甲、乙两种物质的饱和溶液的溶质质
量分数相等
D.将45℃时甲、乙的饱和溶液分别降温到t℃
时,两溶液均会析出晶体
【解析】比较溶解度大小必须指明温度,故A错误;根据溶解
度曲线可知,在20℃时,甲物质的溶解度是30g,所以在该
温度下50g水中最多溶解15g甲物质,故B错误;在t℃
时,两种物质的溶解度相等,则此温度下饱和溶液中溶质的
质量分数也相等,散C正确;甲物质的溶解度随温度的升高
而增大,而乙物质相反,故将45℃时甲、乙的饱和溶液分别
降温到t℃时,甲的溶液出现结晶现象,而乙的溶液变成了
不饱和溶液,没有晶体析出,故D错误。
考点3
有关溶液的计算
例3
(绵阳)我市有丰富的石灰石资源,为了测
定某地石灰石中碳酸钙的质量分数,取7.5g样
品放入烧杯,加入稀盐酸至恰好不再产生气体时
消耗34.7g,放出气体的质量为2.2g。若石灰石
中的杂质均不溶于水且不与盐酸反应,计算石灰
石中CaCO3的质量分数和反应后所得溶液中溶
质的质量分数。(计算最终结果精确到0.1%)
第九单元 整理与复习
第九单元 溶液
必
●
知识框架
概念
组成:溶质、溶剂
溶液
特征:
均一、
稳定
溶液的
混合物
形成
溶解过程中的热量变化
乳化现象
乳浊液
乳化在生活中的应用
饱和溶液与「概念
不饱和溶液相互转化
概念
影响因素:温度
溶液
固体溶解度
溶解度曲线
表示方法
溶解度
溶解度数据表
与溶解性的关系
概念
气体溶解度
影响因素:压强和温度
概念
结晶
蒸发溶剂
结晶的方法
冷却热饱和溶液
概念
溶质的质量分数
计算公式
溶液的
配制一定溶质质量分数的溶液
浓度
步骤、仪器、误差分析
有关溶液浓度的计算
考点突破
考点1溶液的概念
例1
下列有关溶液的说法正确的是
(A)
A.溶液一定是混合物
B.溶液是均一的、稳定的无色透明液体
C.食盐水是溶液,糖水也是溶液,两者混合在一
起则不叫溶液
D.一杯调好的糖水,喝第一口感觉特别甜,越喝
越不甜,说明后面喝到的糖水中含糖少
【獬析】溶液一定是均一、稳定的混合物,但不一定是无色透
明液体,A对B错;一种溶液中可含有多种溶质,C错;一杯
调好的糖水,喝第一口感觉特别甜,越喝越不甜,是由于人味
觉的敏感度被反复刺激后下降,故D错。
考点2
溶解度与溶解度曲线
例2(遂宁)甲、乙两种固体物质的溶解度曲线
如图所示。下列说法正确的是
(C)
溶解度/g
甲
30
乙
020t45
温度/℃
A.甲的溶解度比乙大
B.20℃时,50g水中最多能溶解30g甲
C.t℃时,甲、乙两种物质的饱和溶液的溶质质
量分数相等
D.将45℃时甲、乙的饱和溶液分别降温到t℃
时,两溶液均会析出晶体
【解析】比较溶解度大小必须指明温度,故A错误;根据溶解
度曲线可知,在20℃时,甲物质的溶解度是30g,所以在该
温度下50g水中最多溶解15g甲物质,故B错误;在t℃
时,两种物质的溶解度相等,则此温度下饱和溶液中溶质的
质量分数也相等,散C正确;甲物质的溶解度随温度的升高
而增大,而乙物质相反,故将45℃时甲、乙的饱和溶液分别
降温到t℃时,甲的溶液出现结晶现象,而乙的溶液变成了
不饱和溶液,没有晶体析出,故D错误。
考点3
有关溶液的计算
例3
(绵阳)我市有丰富的石灰石资源,为了测
定某地石灰石中碳酸钙的质量分数,取7.5g样
品放入烧杯,加入稀盐酸至恰好不再产生气体时
消耗34.7g,放出气体的质量为2.2g。若石灰石
中的杂质均不溶于水且不与盐酸反应,计算石灰
石中CaCO3的质量分数和反应后所得溶液中溶
质的质量分数。(计算最终结果精确到0.1%)
同课章节目录
