2022-2023学年上学期高一化学人教版(2019)必修第一册2.3 物质的量课件(20张PPT)
文档属性
| 名称 | 2022-2023学年上学期高一化学人教版(2019)必修第一册2.3 物质的量课件(20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 11:22:06 | ||
图片预览



文档简介
(共20张PPT)
2.3.2 物质的量
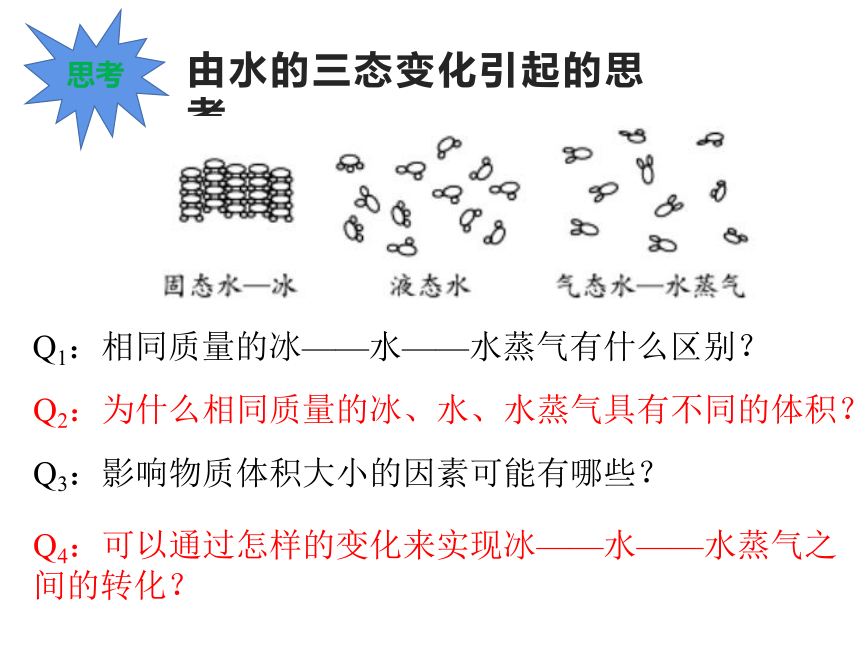
由水的三态变化引起的思考
Q1:相同质量的冰——水——水蒸气有什么区别?
Q2:为什么相同质量的冰、水、水蒸气具有不同的体积?
Q3:影响物质体积大小的因素可能有哪些?
Q4:可以通过怎样的变化来实现冰——水——水蒸气之间的转化?
思考
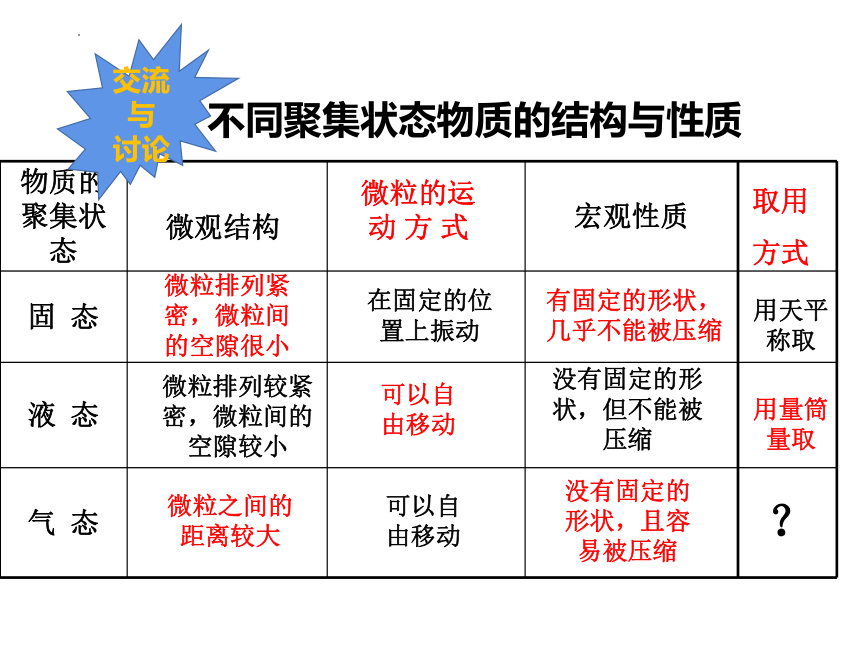
不同聚集状态物质的结构与性质
物质的聚集状态 宏观性质
固 态
液 态
气 态
微观结构
微粒的运动 方 式
有固定的形状,几乎不能被压缩
没有固定的形状,但不能被压缩
没有固定的形状,且容易被压缩
微粒排列紧密,微粒间的空隙很小
微粒排列较紧密,微粒间的空隙较小
微粒之间的距离较大
在固定的位置上振动
可以自由移动
可以自由移动
取用
方式
用天平称取
用量筒量取
?
交流与
讨论
3. 1 mol的固体和液体的体积较小,1mol气体的体积较大。
1. 1 mol不同的固态或液态的物质,体积不同。
2. 在相同状况下,1 mol气体的体积基本相同。
完成书本P11表格,归纳总结规律
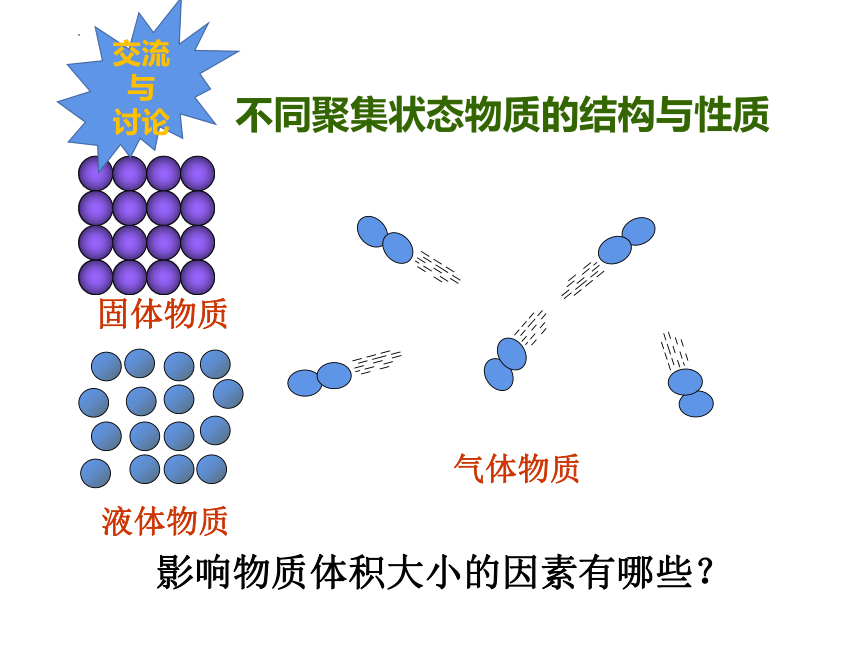
固体物质
液体物质
气体物质
不同聚集状态物质的结构与性质
影响物质体积大小的因素有哪些?
交流与
讨论
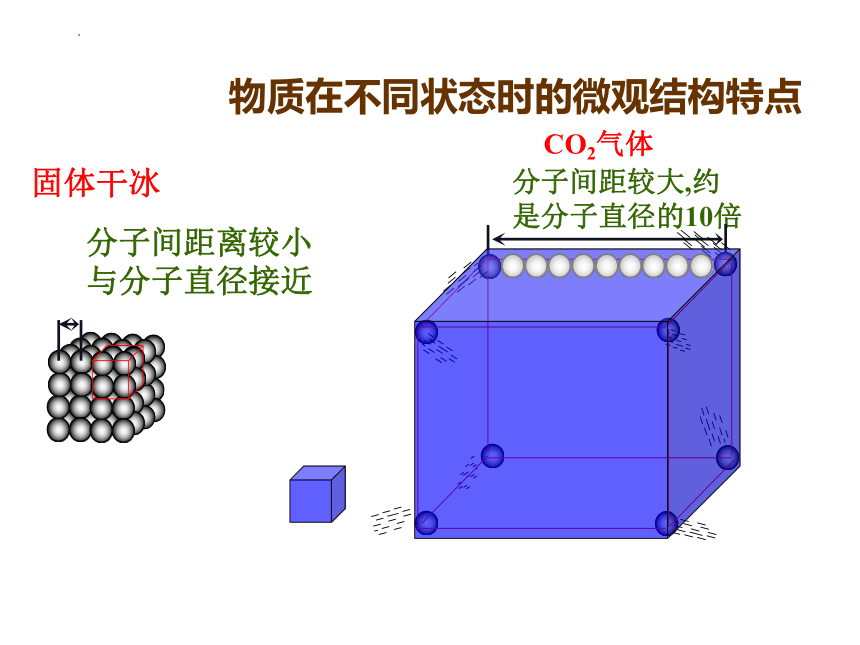
分子间距较大,约是分子直径的10倍
固体干冰
CO2气体
物质在不同状态时的微观结构特点
分子间距离较小与分子直径接近
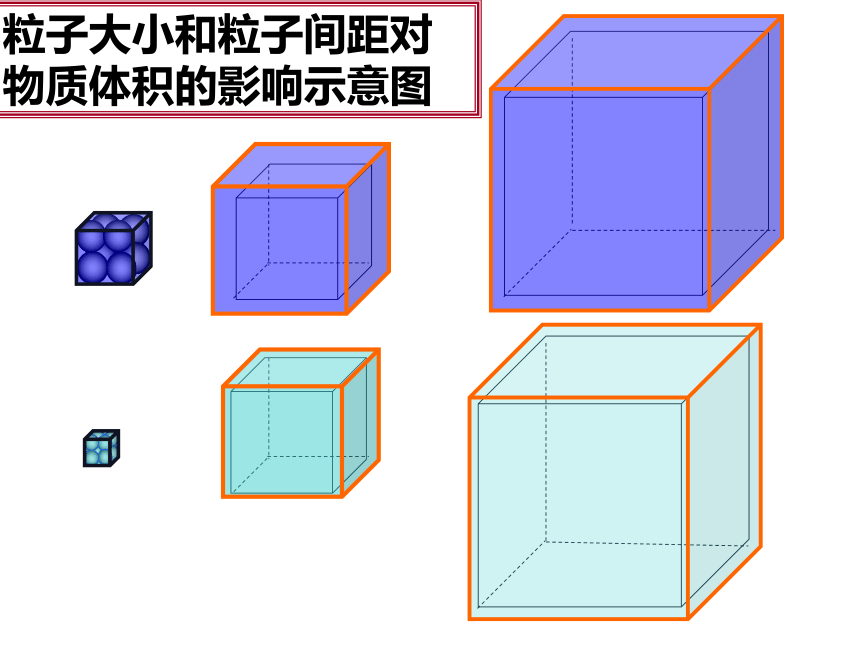
粒子大小和粒子间距对物质体积的影响示意图
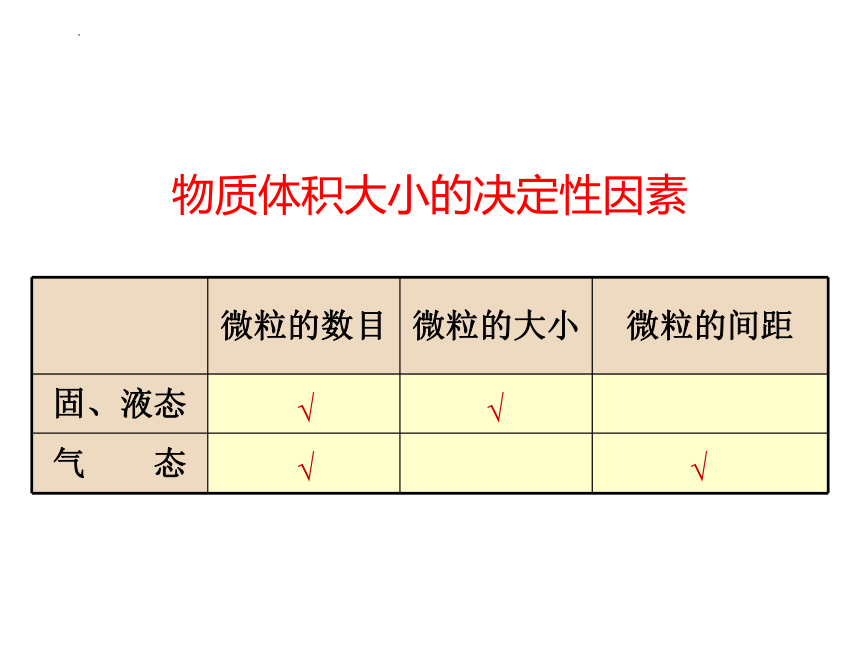
物质体积大小的决定性因素
微粒的数目 微粒的大小 微粒的间距
固、液态
气 态
√
√
√
√
气体摩尔体积
1、定义:单位物质的量的气体所占的体积
符号:
单位:L/mol或 L·mol-1
Vm
注:在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
2、表达式:
3、影响因素:
温度和压强
V= n × Vm
Vm
V
n =
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
4、特例:
在标准状况(0℃,101KPa)下, 1mol任何气体的体积约为22.4L。
【思考】
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
(1)1 mol任何气体的体积都为22.4 L ( )
(2)在标准状况下1 mol任何物质所占的体积都为22.4 L( )
(3)标准状况下,1 mol水所占的体积是22.4 L ( )
(4)在常温常压下,1 mol Cl2所占的体积22.4 L ( )
(5)在常温常压下,1 mol氦气含有的原子数为NA ( )
(6)20℃和101kPa,H2的气体摩尔体积是22.4 L ( )
判断正误
要用到Vm≈22.4L/mol来计算时,必须满足下列2个条件:
①标准状况(0℃,101KPa) ②任何气体
在标况下
(1)0.5 mol HCl气体占有的体积是多少?
(2)33.6 L H2 的物质的量是多少?
(3)标准状况下,0.2mol 氧气和氮气的混合气体,其体积约为多少
V(HCl ) =n (HCl )×Vm=0.5mol×22.4 L/mol=11.2 L
n (H2 )=V (H2 ) / Vm=33.6L÷(22.4 L/mol)=1.5mol
V (N2 +O2) = n (N2 +O2) ×Vm
=0.2mol ×22.4 L/mol
=4.48L
Vm=22.4L/mol
【解】CO2的摩尔质量为44g/mol。
2.2gCO2的物质的量为 :
0.05molCO2在标准状况下的体积为:
V(CO2)=n(CO2)·Vm
=0.05mol×22.4L/mol
=1.12L
答:在标准状况下, 2.2gCO2的体积约为1.12L。
温馨提示:在有关气体体积的计算,一定要先关注外界条件。
注意解题格式,标明粒子的类型,有必要的文字说明并带入单位进行计算!
在标准状况下,2.2gCO2的体积约为多少?
×Vm
÷ Vm
1、阿伏伽德罗定律:相同温度和压强下,相同体积的不同气体均含有相同数目的分子。
依据: PV=nRT(理想气体状态方程)
同温同压时(T 、P一定时)
=
V1
-
V2
n1
-
n2
=
N1
-
N2
阿伏伽德罗定律
(V∝N ∝n)
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
阿伏伽德罗定律的推论
PV=nRT(理想气体状态方程)
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
...................
1.关于同温同压下等体积的N2和CO的叙述:
①质量相等; ②密度相等;③所含分子数相等;
④所含原子数相等。
其中正确的是 ( A )
A.①②③④ B.②③④
C.③④ D.③
课堂练习
2.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)分子数之比为 ;
(2)原子数之比为 ;
(3)物质的量之比为 ;
(4)摩尔质量之比为 ;
(5)质量之比为 ;
1:2
3:4
1:2
11:7
11:14
2.3.2 物质的量
由水的三态变化引起的思考
Q1:相同质量的冰——水——水蒸气有什么区别?
Q2:为什么相同质量的冰、水、水蒸气具有不同的体积?
Q3:影响物质体积大小的因素可能有哪些?
Q4:可以通过怎样的变化来实现冰——水——水蒸气之间的转化?
思考
不同聚集状态物质的结构与性质
物质的聚集状态 宏观性质
固 态
液 态
气 态
微观结构
微粒的运动 方 式
有固定的形状,几乎不能被压缩
没有固定的形状,但不能被压缩
没有固定的形状,且容易被压缩
微粒排列紧密,微粒间的空隙很小
微粒排列较紧密,微粒间的空隙较小
微粒之间的距离较大
在固定的位置上振动
可以自由移动
可以自由移动
取用
方式
用天平称取
用量筒量取
?
交流与
讨论
3. 1 mol的固体和液体的体积较小,1mol气体的体积较大。
1. 1 mol不同的固态或液态的物质,体积不同。
2. 在相同状况下,1 mol气体的体积基本相同。
完成书本P11表格,归纳总结规律
固体物质
液体物质
气体物质
不同聚集状态物质的结构与性质
影响物质体积大小的因素有哪些?
交流与
讨论
分子间距较大,约是分子直径的10倍
固体干冰
CO2气体
物质在不同状态时的微观结构特点
分子间距离较小与分子直径接近
粒子大小和粒子间距对物质体积的影响示意图
物质体积大小的决定性因素
微粒的数目 微粒的大小 微粒的间距
固、液态
气 态
√
√
√
√
气体摩尔体积
1、定义:单位物质的量的气体所占的体积
符号:
单位:L/mol或 L·mol-1
Vm
注:在给定温度和压强的条件下, Vm是常数。
(若条件改变时,Vm也随之改变;也就是说要指明Vm的数值,必须指明温度和压强)
2、表达式:
3、影响因素:
温度和压强
V= n × Vm
Vm
V
n =
(1)条件:标准状况(0℃,101KPa)
(2)对象:任何气体(单一气体或混合不反应的气体)
(3)数值:Vm≈22.4L/mol
4、特例:
在标准状况(0℃,101KPa)下, 1mol任何气体的体积约为22.4L。
【思考】
是否只有在标准状况下气体摩尔体积才是22.4L/mol?
(1)1 mol任何气体的体积都为22.4 L ( )
(2)在标准状况下1 mol任何物质所占的体积都为22.4 L( )
(3)标准状况下,1 mol水所占的体积是22.4 L ( )
(4)在常温常压下,1 mol Cl2所占的体积22.4 L ( )
(5)在常温常压下,1 mol氦气含有的原子数为NA ( )
(6)20℃和101kPa,H2的气体摩尔体积是22.4 L ( )
判断正误
要用到Vm≈22.4L/mol来计算时,必须满足下列2个条件:
①标准状况(0℃,101KPa) ②任何气体
在标况下
(1)0.5 mol HCl气体占有的体积是多少?
(2)33.6 L H2 的物质的量是多少?
(3)标准状况下,0.2mol 氧气和氮气的混合气体,其体积约为多少
V(HCl ) =n (HCl )×Vm=0.5mol×22.4 L/mol=11.2 L
n (H2 )=V (H2 ) / Vm=33.6L÷(22.4 L/mol)=1.5mol
V (N2 +O2) = n (N2 +O2) ×Vm
=0.2mol ×22.4 L/mol
=4.48L
Vm=22.4L/mol
【解】CO2的摩尔质量为44g/mol。
2.2gCO2的物质的量为 :
0.05molCO2在标准状况下的体积为:
V(CO2)=n(CO2)·Vm
=0.05mol×22.4L/mol
=1.12L
答:在标准状况下, 2.2gCO2的体积约为1.12L。
温馨提示:在有关气体体积的计算,一定要先关注外界条件。
注意解题格式,标明粒子的类型,有必要的文字说明并带入单位进行计算!
在标准状况下,2.2gCO2的体积约为多少?
×Vm
÷ Vm
1、阿伏伽德罗定律:相同温度和压强下,相同体积的不同气体均含有相同数目的分子。
依据: PV=nRT(理想气体状态方程)
同温同压时(T 、P一定时)
=
V1
-
V2
n1
-
n2
=
N1
-
N2
阿伏伽德罗定律
(V∝N ∝n)
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
阿伏伽德罗定律的推论
PV=nRT(理想气体状态方程)
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
...................
1.关于同温同压下等体积的N2和CO的叙述:
①质量相等; ②密度相等;③所含分子数相等;
④所含原子数相等。
其中正确的是 ( A )
A.①②③④ B.②③④
C.③④ D.③
课堂练习
2.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)分子数之比为 ;
(2)原子数之比为 ;
(3)物质的量之比为 ;
(4)摩尔质量之比为 ;
(5)质量之比为 ;
1:2
3:4
1:2
11:7
11:14
