2022-2023学年上学期高一化学人教版(2019)必修第一册4.2 元素周期律课件(18张PPT)
文档属性
| 名称 | 2022-2023学年上学期高一化学人教版(2019)必修第一册4.2 元素周期律课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 11:23:49 | ||
图片预览



文档简介
(共18张PPT)
4.2 元素周期律
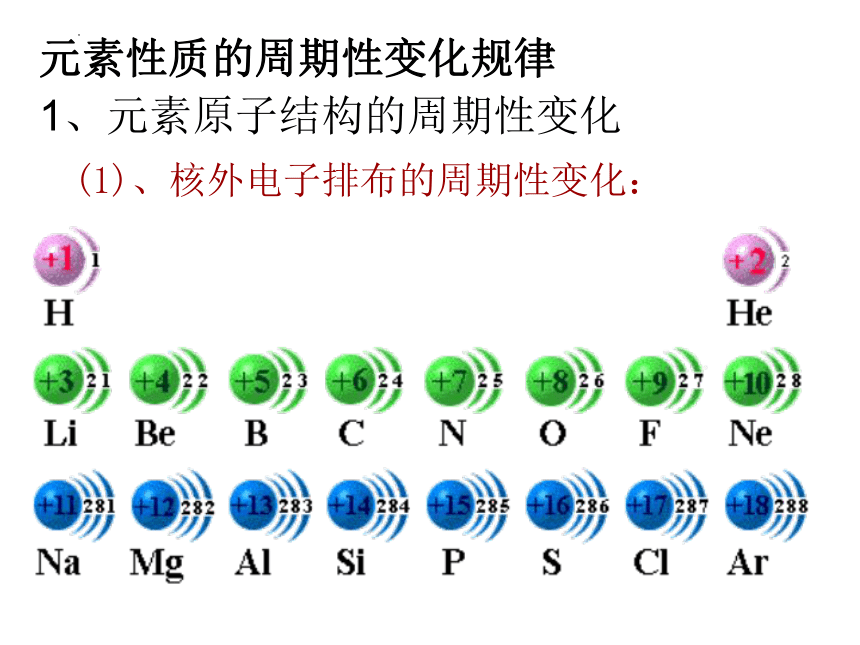
(1)、核外电子排布的周期性变化:
1、元素原子结构的周期性变化
元素性质的周期性变化规律
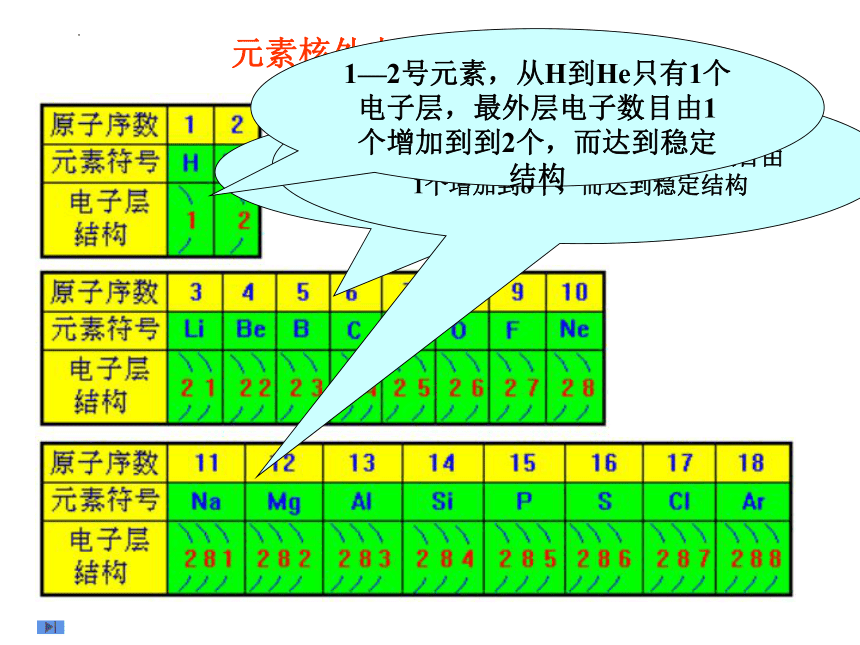
3—10号元素,从Li 到Ne有2个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构
11—18号元素,从Na 到Ar有3个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构
元素核外电子排布情况
1—2号元素,从H到He只有1个电子层,最外层电子数目由1个增加到到2个,而达到稳定结构
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。 1
2
3
1
2
1
8
1
8
8
8
2
1—8 周期性
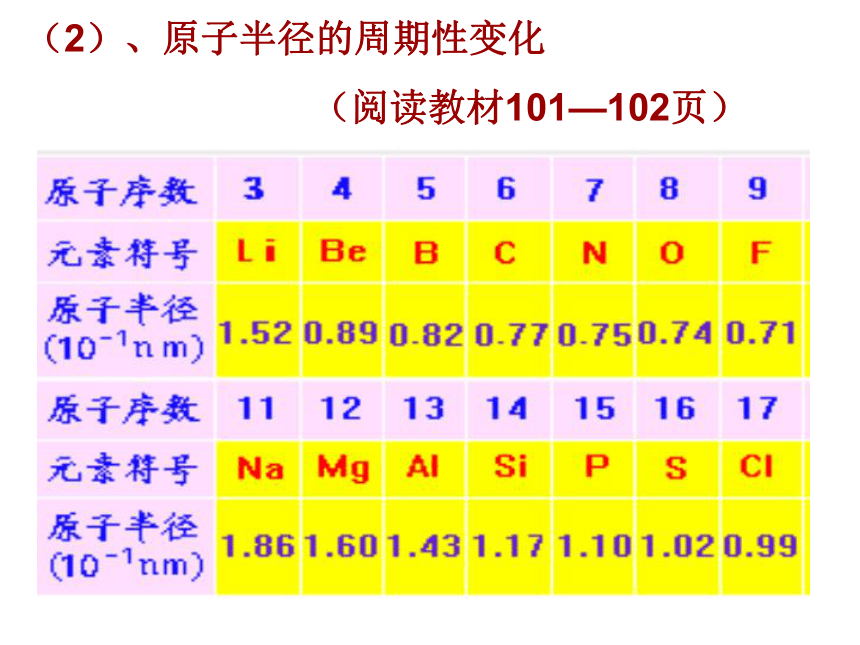
(2)、原子半径的周期性变化
(阅读教材101—102页)
总结:
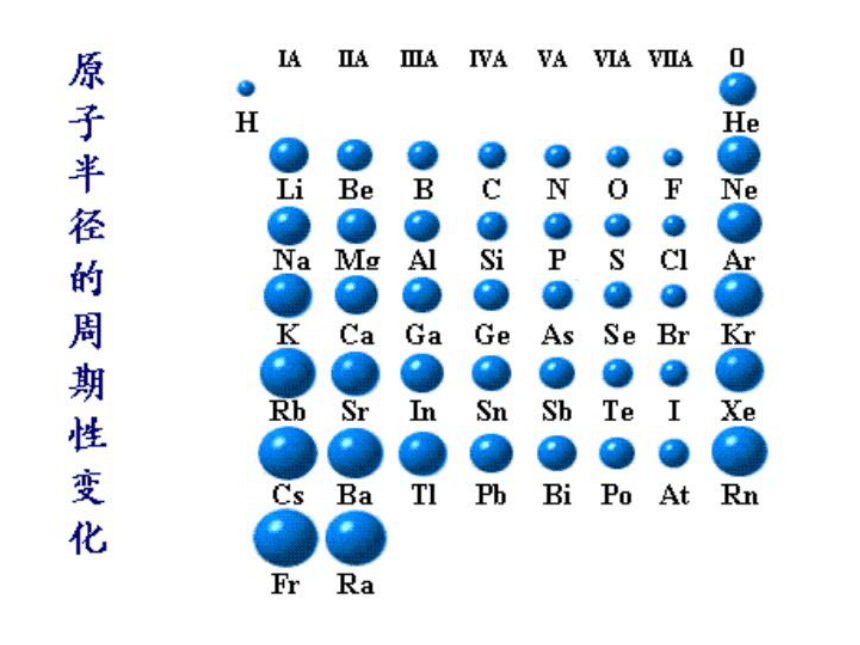
1、同一周期,随着核电荷数的递增,原子半径逐渐减小。
如:r(Na) > r(S)
2、同一主族,随着核电荷数的递增,原子半径逐渐增大。
如:r(Na) > r(Li) 、 r(Cl) > r(F)
3、稀有气体原子半径与相邻的同周期原子半径比较,突然增大。
★原子半径随原子序数的变化呈周期性变化
(1)、对于同种元素:
①阳离子半径 < 原子半径; 阴离子半径 > 原子半径
微粒半径大小比较规律
1、原子半径:
2、离子半径:
(1)、同一周期,核电荷数越大,原子半径越小。
(2)、同一主族,核电荷数越大,原子半径越大。
如:r(K+) < r(K) 、 r(Cl-) > r(Cl)
②阳离子所带正电荷数越多,则离子半径越小。
如:r(Fe2+) > r(Fe3+)
元素化合价的变化规律
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
主族元素的最高正价数与最外层电子数有什么关系?主族非金属元素的最高正价数与最低负价数有什么关系(除H、B、O、F外)?
主族元素的最高正价数=最外层电子数
最高正价数和最低负价绝对值之和=8
思考交流
实验探究:第三周期元素性质的递变
思考交流:根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
请将课本翻至95和97页,阅读一下课本下面的注释
思考:如何证明Na、Mg、Al的金属性逐渐减弱呢?
单质与水(或酸)反应的难易
最高价氧化物的水化物——氢氧化物的碱性强弱
实验操作 实验现象 实验结论及
化学方程式
结论:金属性Na Mg (1)实验探究:钠、镁与水的反应
常温下镁与水的反应较缓慢,镁条表面有一些红色;加热后反应剧烈,镁条表面有大量气泡,溶液变为红色。
Mg + 2H2O
Mg(OH)2 + H2↑
浮、游、熔、
响、红
2Na+2H2O=2NaOH+H2
↑
>
(2)实验探究:氢氧化铝、氢氧化镁分别和盐酸、氢氧化钠的反应
a.实验③中,向Al(OH)3沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,都出现溶解现象,相应的离子方程式为
b.实验④中,向Mg(OH)2沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,其中滴加稀盐酸的试管内的沉淀溶解,相应的离子方程式为Mg(OH)2+2H+══Mg2++2H2O;滴加NaOH溶液的试管内无明显变化。
结论:钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。
钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al。
(2)实验探究:现象及结论
Na Mg Al Si P S Cl
金属性减弱,非金属性增强
在同一周期中,虽然各元素的原子核外电子层数相同,但由左向右,核电荷数依次递增,原子半径逐渐_____,失电子能力逐渐______,得电子能力逐渐_____,因此金属性逐渐______,非金属性逐渐_______。
减小
减弱
增强
减弱
增强
得出结论
元素周期律
元素周期表和元素周期律的应用
4.2 元素周期律
(1)、核外电子排布的周期性变化:
1、元素原子结构的周期性变化
元素性质的周期性变化规律
3—10号元素,从Li 到Ne有2个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构
11—18号元素,从Na 到Ar有3个电子层,随原子序数的增大,最外层电子数目由1个增加到8个,而达到稳定结构
元素核外电子排布情况
1—2号元素,从H到He只有1个电子层,最外层电子数目由1个增加到到2个,而达到稳定结构
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2
3~10
11~18
结论:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。 1
2
3
1
2
1
8
1
8
8
8
2
1—8 周期性
(2)、原子半径的周期性变化
(阅读教材101—102页)
总结:
1、同一周期,随着核电荷数的递增,原子半径逐渐减小。
如:r(Na) > r(S)
2、同一主族,随着核电荷数的递增,原子半径逐渐增大。
如:r(Na) > r(Li) 、 r(Cl) > r(F)
3、稀有气体原子半径与相邻的同周期原子半径比较,突然增大。
★原子半径随原子序数的变化呈周期性变化
(1)、对于同种元素:
①阳离子半径 < 原子半径; 阴离子半径 > 原子半径
微粒半径大小比较规律
1、原子半径:
2、离子半径:
(1)、同一周期,核电荷数越大,原子半径越小。
(2)、同一主族,核电荷数越大,原子半径越大。
如:r(K+) < r(K) 、 r(Cl-) > r(Cl)
②阳离子所带正电荷数越多,则离子半径越小。
如:r(Fe2+) > r(Fe3+)
元素化合价的变化规律
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
主族元素的最高正价数与最外层电子数有什么关系?主族非金属元素的最高正价数与最低负价数有什么关系(除H、B、O、F外)?
主族元素的最高正价数=最外层电子数
最高正价数和最低负价绝对值之和=8
思考交流
实验探究:第三周期元素性质的递变
思考交流:根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
请将课本翻至95和97页,阅读一下课本下面的注释
思考:如何证明Na、Mg、Al的金属性逐渐减弱呢?
单质与水(或酸)反应的难易
最高价氧化物的水化物——氢氧化物的碱性强弱
实验操作 实验现象 实验结论及
化学方程式
结论:金属性Na Mg (1)实验探究:钠、镁与水的反应
常温下镁与水的反应较缓慢,镁条表面有一些红色;加热后反应剧烈,镁条表面有大量气泡,溶液变为红色。
Mg + 2H2O
Mg(OH)2 + H2↑
浮、游、熔、
响、红
2Na+2H2O=2NaOH+H2
↑
>
(2)实验探究:氢氧化铝、氢氧化镁分别和盐酸、氢氧化钠的反应
a.实验③中,向Al(OH)3沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,都出现溶解现象,相应的离子方程式为
b.实验④中,向Mg(OH)2沉淀中分别滴加2 mol·L-1盐酸和2 mol·L-1 NaOH溶液,其中滴加稀盐酸的试管内的沉淀溶解,相应的离子方程式为Mg(OH)2+2H+══Mg2++2H2O;滴加NaOH溶液的试管内无明显变化。
结论:钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。
钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al。
(2)实验探究:现象及结论
Na Mg Al Si P S Cl
金属性减弱,非金属性增强
在同一周期中,虽然各元素的原子核外电子层数相同,但由左向右,核电荷数依次递增,原子半径逐渐_____,失电子能力逐渐______,得电子能力逐渐_____,因此金属性逐渐______,非金属性逐渐_______。
减小
减弱
增强
减弱
增强
得出结论
元素周期律
元素周期表和元素周期律的应用
