2022-2023学年上学期高一化学人教版(2019)必修第一册2.3.1 物质的量课件(18张PPT)
文档属性
| 名称 | 2022-2023学年上学期高一化学人教版(2019)必修第一册2.3.1 物质的量课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 14:04:24 | ||
图片预览






文档简介
(共18张PPT)
2.3.1 物质的量
从宏观上看,发生化学反应的物质之间是按照一定质量关系进行的,如称取12g碳,放在32g氧气中恰好完全反应。物质是可称量的。
从微观上看,化学反应是微观粒子按一定的数目关系进行的,如1个碳原子和1个氧分子反应生成1个二氧化碳分子。而微观粒子是难以称量的。
C + O2 = CO2
宏观意义 12g 碳 32g氧气 44g二氧化碳
微观意义 1个碳原子 1个氧分子 1个二氧化碳分子
对化学反应进行定量研究时,能否将可称量的物质与难以称量的微观粒子之间联系起来呢?
物质的量及其单位——摩尔
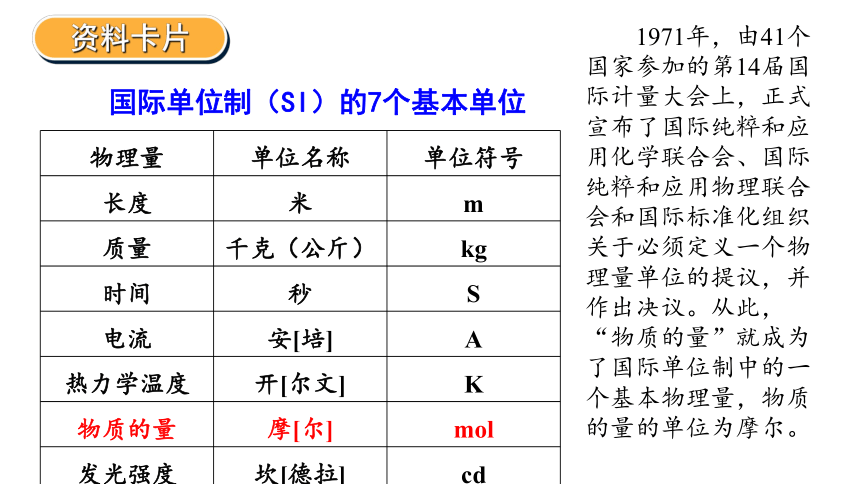
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 S
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
资料卡片
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量,物质的量的单位为摩尔。
1、概念:
2、单位:
符号:n
表示含有一定数目粒子的集合体。
摩尔,简称摩。
符号:mol
原子、分子、离子、原子团、电子、质子、中子等。
集合体的理解
1包可乐
4捆衣架
1令纸
1打鸡蛋
6盒粉笔
1袋糖果
思考:1mol的微粒含有多少个粒子呢?
国际上规定,1mol粒子集合体所含的粒子数与0.012kg12C所含的碳原子数相同,约为6.02×1023
阿伏伽德罗常数
1.定义
1mol任何粒子的粒子数
2.符号、数值及单位
NA
≈ 6.02×1023 mol-1
符号
数值
单位
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
微粒数目(N)
阿伏加德罗常数(NA)
三、物质的量、阿伏加德罗常数与粒子数间的关系
物质的量(n)=
(1)1mol铁原子的个数约是___________个.
(2)1molH2约含____________个氢分子.
(3)6.02×1023个O是____molO.
(4)5×6.02×1023个CO2是____molCO2.
6.02×1023
1
5
6.02×1023
1、下列关于摩尔的说法中,正确的是( )
A.摩尔是一个物理量,含6.02×1023个粒子
B .摩尔是国际单位制的七个基本单位之一
C.摩尔既是物质的量的单位,又是粒子的数量单位
D.摩尔的基准是0.012 Kg 12C中所含的碳原子数
BD
2、下列关于阿伏加德罗常数的说法正确的是 ( )
A.阿伏加德罗常数是一个纯数,没有单位
B.阿伏加德罗常数就是6.02×1023
C.阿伏加德罗常数是指1 mol 的任何粒子的粒子数
D.阿伏加德罗常数的近似值为:6.02×1023 mol-1
CD
粒子符号 物质的式量 每个粒子的质量(g/个) 1摩物质含有 粒子数(个) 1摩物质质量(g)
C 12 1.993X10-23
Fe 56 9.032X10-23
H2SO4 98 1.628X10-22
H2O 18 2.990X10-23
Na+ 23 3.821X10-23
OH- 17 2.824X10-23
12
56
98
18
23
17
NA
NA
NA
NA
NA
NA
6.02 1023
结论: 1mol任何粒子或物质的质量以克为单位时在数值上都与该粒子相对原子质量或相对分子质量相等。
1mol物质的质量
(1)定义:单位物质的量的物质所具有的质量
(2)符号:M
【结论】摩尔质量(以g mol-1为单位时)在数值上等于该物质的相对原子质量 或相对分子质量
(4)单位:g mol-1 或 kg/mol
(3)表达式:M = m/n
(5)表示方法:
如:M(S)=32 g/mol M(H2O)=18 g mol-1
M(NaCl)=58.5 g mol-1 M(SO42-)=96 g mol-1
摩尔质量
(1).1molC的质量是C的摩尔质量
(2).摩尔质量的单位必须是“ g/mol”
(3).分子组成的物质,其摩尔质量在数值上一定等于
该物质的相对分子质量
(4).CO2的摩尔质量是44
(5).1molH2SO4的质量是98g/mol
演练获得:判断正误
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
(四)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
物质的量是联系宏观和微观的纽带或桥梁。
表达式:
M=
m
M
n=
m=
n M
思考2:完成下列问题,并思考摩尔质量、物质的量、粒子数之间的关系:
(1)1mol H2O质量是 ?2mol H2O质量是 ?
(2)32g O2的物质的量是 ?48g O2物质的量是 ?
(3)1mol N2含有 个 N,质量为 ?
(4)含有6.02×1023个Fe原子的Fe的物质的量是 ,质量为 ?
18g
36g
1mol
1.5mol
2NA
28g
1mol
56g
再见
2.3.1 物质的量
从宏观上看,发生化学反应的物质之间是按照一定质量关系进行的,如称取12g碳,放在32g氧气中恰好完全反应。物质是可称量的。
从微观上看,化学反应是微观粒子按一定的数目关系进行的,如1个碳原子和1个氧分子反应生成1个二氧化碳分子。而微观粒子是难以称量的。
C + O2 = CO2
宏观意义 12g 碳 32g氧气 44g二氧化碳
微观意义 1个碳原子 1个氧分子 1个二氧化碳分子
对化学反应进行定量研究时,能否将可称量的物质与难以称量的微观粒子之间联系起来呢?
物质的量及其单位——摩尔
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 S
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
资料卡片
1971年,由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量,物质的量的单位为摩尔。
1、概念:
2、单位:
符号:n
表示含有一定数目粒子的集合体。
摩尔,简称摩。
符号:mol
原子、分子、离子、原子团、电子、质子、中子等。
集合体的理解
1包可乐
4捆衣架
1令纸
1打鸡蛋
6盒粉笔
1袋糖果
思考:1mol的微粒含有多少个粒子呢?
国际上规定,1mol粒子集合体所含的粒子数与0.012kg12C所含的碳原子数相同,约为6.02×1023
阿伏伽德罗常数
1.定义
1mol任何粒子的粒子数
2.符号、数值及单位
NA
≈ 6.02×1023 mol-1
符号
数值
单位
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子
1×NA
0.3×NA
10×NA
6×NA
0.5×NA
微粒数目(N)
阿伏加德罗常数(NA)
三、物质的量、阿伏加德罗常数与粒子数间的关系
物质的量(n)=
(1)1mol铁原子的个数约是___________个.
(2)1molH2约含____________个氢分子.
(3)6.02×1023个O是____molO.
(4)5×6.02×1023个CO2是____molCO2.
6.02×1023
1
5
6.02×1023
1、下列关于摩尔的说法中,正确的是( )
A.摩尔是一个物理量,含6.02×1023个粒子
B .摩尔是国际单位制的七个基本单位之一
C.摩尔既是物质的量的单位,又是粒子的数量单位
D.摩尔的基准是0.012 Kg 12C中所含的碳原子数
BD
2、下列关于阿伏加德罗常数的说法正确的是 ( )
A.阿伏加德罗常数是一个纯数,没有单位
B.阿伏加德罗常数就是6.02×1023
C.阿伏加德罗常数是指1 mol 的任何粒子的粒子数
D.阿伏加德罗常数的近似值为:6.02×1023 mol-1
CD
粒子符号 物质的式量 每个粒子的质量(g/个) 1摩物质含有 粒子数(个) 1摩物质质量(g)
C 12 1.993X10-23
Fe 56 9.032X10-23
H2SO4 98 1.628X10-22
H2O 18 2.990X10-23
Na+ 23 3.821X10-23
OH- 17 2.824X10-23
12
56
98
18
23
17
NA
NA
NA
NA
NA
NA
6.02 1023
结论: 1mol任何粒子或物质的质量以克为单位时在数值上都与该粒子相对原子质量或相对分子质量相等。
1mol物质的质量
(1)定义:单位物质的量的物质所具有的质量
(2)符号:M
【结论】摩尔质量(以g mol-1为单位时)在数值上等于该物质的相对原子质量 或相对分子质量
(4)单位:g mol-1 或 kg/mol
(3)表达式:M = m/n
(5)表示方法:
如:M(S)=32 g/mol M(H2O)=18 g mol-1
M(NaCl)=58.5 g mol-1 M(SO42-)=96 g mol-1
摩尔质量
(1).1molC的质量是C的摩尔质量
(2).摩尔质量的单位必须是“ g/mol”
(3).分子组成的物质,其摩尔质量在数值上一定等于
该物质的相对分子质量
(4).CO2的摩尔质量是44
(5).1molH2SO4的质量是98g/mol
演练获得:判断正误
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
(四)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
物质的量是联系宏观和微观的纽带或桥梁。
表达式:
M=
m
M
n=
m=
n M
思考2:完成下列问题,并思考摩尔质量、物质的量、粒子数之间的关系:
(1)1mol H2O质量是 ?2mol H2O质量是 ?
(2)32g O2的物质的量是 ?48g O2物质的量是 ?
(3)1mol N2含有 个 N,质量为 ?
(4)含有6.02×1023个Fe原子的Fe的物质的量是 ,质量为 ?
18g
36g
1mol
1.5mol
2NA
28g
1mol
56g
再见
