2022-2023学年高一上学期化学人教版(2019)必修第一册1.3.2 氧化还原反应课件(21张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版(2019)必修第一册1.3.2 氧化还原反应课件(21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 522.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 14:06:02 | ||
图片预览





文档简介
(共21张PPT)
1.3.2 氧化还原反应
氧化剂:得电子的反应物,所含元素化合价降低,
本身被还原。具有氧化性。
还原剂:失电子的反应物,所含元素化合价升高,
本身被氧化。具有还原性。
氧化产物:发生氧化反应的生成物(被氧化的产物)
还原产物:发生还原反应的生成物(被还原的产物)
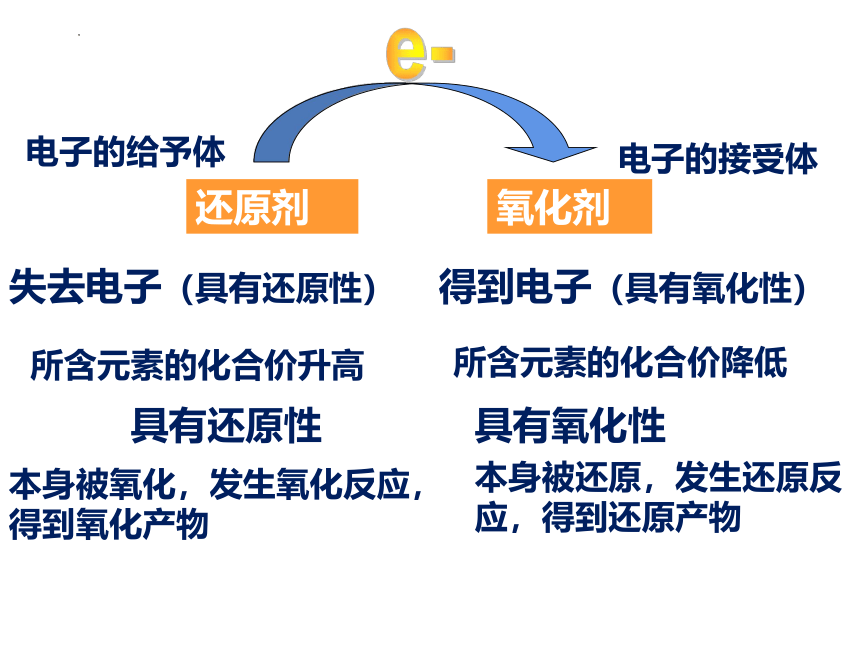
1、定义:
氧化剂和还原剂
还原剂
氧化剂
得到电子(具有氧化性)
失去电子(具有还原性)
所含元素的化合价升高
所含元素的化合价降低
具有还原性
具有氧化性
本身被氧化,发生氧化反应,得到氧化产物
本身被还原,发生还原反应,得到还原产物
电子的给予体
电子的接受体
e-
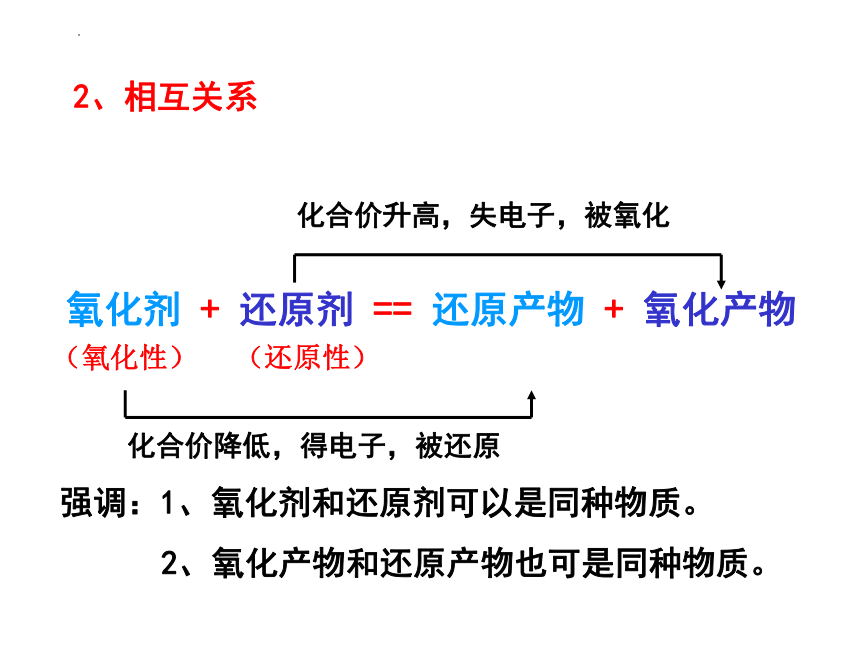
2、相互关系
氧化剂 + 还原剂 == 还原产物 + 氧化产物
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
(氧化性)
(还原性)
强调:1、氧化剂和还原剂可以是同种物质。
2、氧化产物和还原产物也可是同种物质。
3、记忆口诀:
还原剂:化合价升高→物质失电子→被氧化→还原性→氧化产物
氧化剂:化合价降低→物质得电子→被还原→氧化性→还原产物
失e-
升、失、氧、还(剂)
降、得、还、氧(剂)
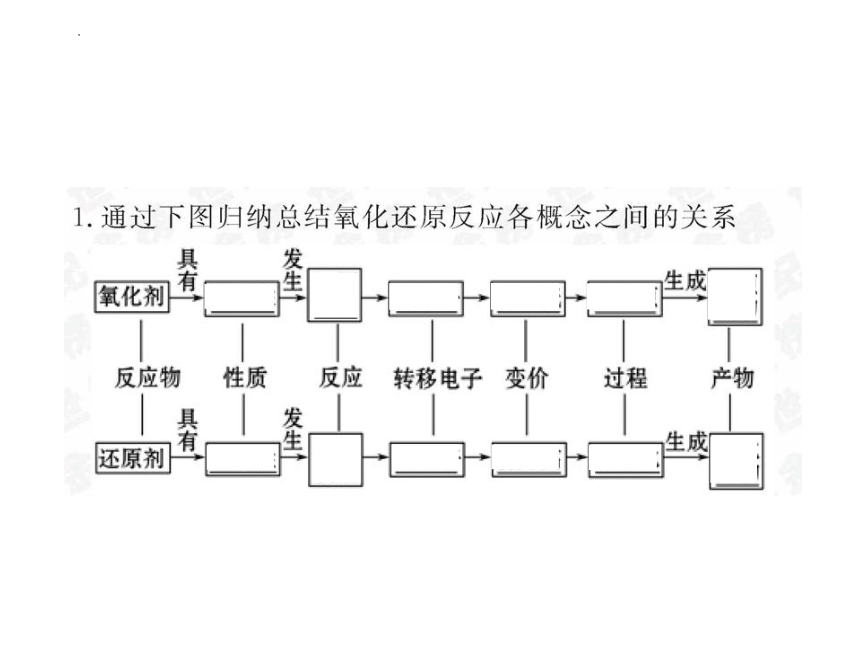
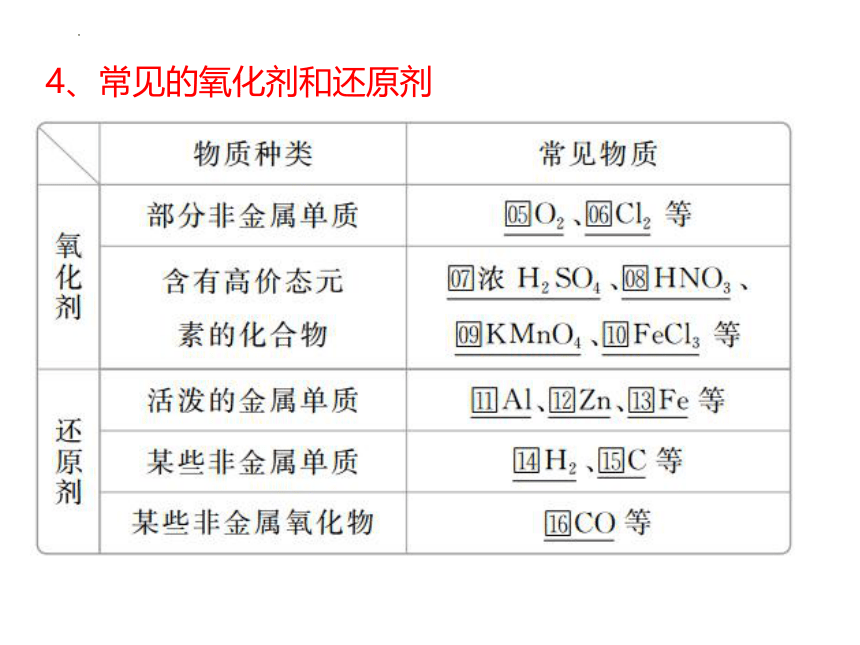
4、常见的氧化剂和还原剂
5.氧化还原反应的存在
(1)有利于人类生活和生产的方面,如:金属的冶炼、电镀、燃料的燃烧等。
(2)不利于人类生活和生产的方面,如:易燃物的自燃、食物的腐败、钢铁的锈蚀等。
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少。
1.根据化学方程式判断:
氧化剂+还原剂=还原产物+氧化产物
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
物质的氧化性或还原性强弱的比较
结论:
0
+1
+2
0
还原剂
H2 + CuO = Cu + H2O
例如:
氧化产物
还原产物
氧化剂
氧化性:CuO > H2O
还原性: H2 > Cu
2.根据物质活动性顺序进行判断
非金属单质的氧化性越强,对应阴离子的还原性越弱
金属单质的还原性越强,对应阳离子的氧化性越弱
氧化性:F2>Cl2>Br2>I2>S
还原性:F-(1)元素处于高价态具有氧化性,最高价态,则只具有氧化性。例如Fe3+。
3.根据元素的化合价来判断
(2)元素处于低价态具有还原性,最低价态,则只具有还原性。例如Fe。
(3)元素处于中间价态,则既有氧化性又有还原性。
例如Fe2+。
(2)分析下列反应并按要求填空。
①2Fe+3Cl2 2FeCl3
氧化剂是____,还原剂是____;发生氧化反应的是____,发生还原反应的是_____。
②2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是___________________,被还原的元素是__________________。
③2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是______;氧化产物是___,还原产物是___。
Cl2
S
Fe
Fe
Cl2
KMnO4
KMnO4
KMnO4中的氧元素
KMnO4中的锰元素
SO2
H2S
S
1、价态律:
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性
(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。
(如Fe2+、S等)
氧化还原反应中的基本规律
(1).根据氧化还原反应的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2、强弱律:
3、难易律(先后律):
一种氧化剂同时和几种还原剂相遇时,还原性强的先发生反应;
同理,一种还原剂遇多种氧化剂时,氧化性强的先发生反应。
例:已知氧化性Fe3+ >Cu2+ ,则当将铁粉加入到FeCl3和CuCl2的混合溶液时先和什么离子反应,为什么?
4、转化律:
A.氧化还原反应中,元素相邻价态间的转化最容易;(如H2SO4中的S比较容易转化为SO2,不易转化为单质S或H2S)
B.同种元素相邻价态之间不发生氧化还原反应。(SO2与H2SO4不发生反应)
5、守恒律:
对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,即失电子总数与得电子总数相等.
例.R2O8n-离子在一定条件下可以把Mn2+离子氧化为
MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧
化剂与还原剂的物质的量之比为5∶2,则n的值是( )
A.1 B.2 C.3 D.4
B
例 KClO3+6HCl=KCl+3Cl2+3H2O
(1)此反应中转移的电子数目:_____
(2)被氧化的物质与被还原的物质的物质的量之比:
__________
5e-
5:1
6、归中律
(即同一元素的化合价“可归中靠拢、不交叉”)
同种元素不同价态之间发生氧化还原反应遵循以下规律:
高价+低价→中间价
1.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
检测
2.氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O==Ca(OH)2+2H2↑。下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
1.3.2 氧化还原反应
氧化剂:得电子的反应物,所含元素化合价降低,
本身被还原。具有氧化性。
还原剂:失电子的反应物,所含元素化合价升高,
本身被氧化。具有还原性。
氧化产物:发生氧化反应的生成物(被氧化的产物)
还原产物:发生还原反应的生成物(被还原的产物)
1、定义:
氧化剂和还原剂
还原剂
氧化剂
得到电子(具有氧化性)
失去电子(具有还原性)
所含元素的化合价升高
所含元素的化合价降低
具有还原性
具有氧化性
本身被氧化,发生氧化反应,得到氧化产物
本身被还原,发生还原反应,得到还原产物
电子的给予体
电子的接受体
e-
2、相互关系
氧化剂 + 还原剂 == 还原产物 + 氧化产物
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
(氧化性)
(还原性)
强调:1、氧化剂和还原剂可以是同种物质。
2、氧化产物和还原产物也可是同种物质。
3、记忆口诀:
还原剂:化合价升高→物质失电子→被氧化→还原性→氧化产物
氧化剂:化合价降低→物质得电子→被还原→氧化性→还原产物
失e-
升、失、氧、还(剂)
降、得、还、氧(剂)
4、常见的氧化剂和还原剂
5.氧化还原反应的存在
(1)有利于人类生活和生产的方面,如:金属的冶炼、电镀、燃料的燃烧等。
(2)不利于人类生活和生产的方面,如:易燃物的自燃、食物的腐败、钢铁的锈蚀等。
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少。
1.根据化学方程式判断:
氧化剂+还原剂=还原产物+氧化产物
氧化性:
氧化剂>氧化产物
还原性:
还原剂>还原产物
物质的氧化性或还原性强弱的比较
结论:
0
+1
+2
0
还原剂
H2 + CuO = Cu + H2O
例如:
氧化产物
还原产物
氧化剂
氧化性:CuO > H2O
还原性: H2 > Cu
2.根据物质活动性顺序进行判断
非金属单质的氧化性越强,对应阴离子的还原性越弱
金属单质的还原性越强,对应阳离子的氧化性越弱
氧化性:F2>Cl2>Br2>I2>S
还原性:F-
3.根据元素的化合价来判断
(2)元素处于低价态具有还原性,最低价态,则只具有还原性。例如Fe。
(3)元素处于中间价态,则既有氧化性又有还原性。
例如Fe2+。
(2)分析下列反应并按要求填空。
①2Fe+3Cl2 2FeCl3
氧化剂是____,还原剂是____;发生氧化反应的是____,发生还原反应的是_____。
②2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是________,还原剂是________;被氧化的元素是___________________,被还原的元素是__________________。
③2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是______;氧化产物是___,还原产物是___。
Cl2
S
Fe
Fe
Cl2
KMnO4
KMnO4
KMnO4中的氧元素
KMnO4中的锰元素
SO2
H2S
S
1、价态律:
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性
(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。
(如Fe2+、S等)
氧化还原反应中的基本规律
(1).根据氧化还原反应的方向判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
2、强弱律:
3、难易律(先后律):
一种氧化剂同时和几种还原剂相遇时,还原性强的先发生反应;
同理,一种还原剂遇多种氧化剂时,氧化性强的先发生反应。
例:已知氧化性Fe3+ >Cu2+ ,则当将铁粉加入到FeCl3和CuCl2的混合溶液时先和什么离子反应,为什么?
4、转化律:
A.氧化还原反应中,元素相邻价态间的转化最容易;(如H2SO4中的S比较容易转化为SO2,不易转化为单质S或H2S)
B.同种元素相邻价态之间不发生氧化还原反应。(SO2与H2SO4不发生反应)
5、守恒律:
对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,即失电子总数与得电子总数相等.
例.R2O8n-离子在一定条件下可以把Mn2+离子氧化为
MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧
化剂与还原剂的物质的量之比为5∶2,则n的值是( )
A.1 B.2 C.3 D.4
B
例 KClO3+6HCl=KCl+3Cl2+3H2O
(1)此反应中转移的电子数目:_____
(2)被氧化的物质与被还原的物质的物质的量之比:
__________
5e-
5:1
6、归中律
(即同一元素的化合价“可归中靠拢、不交叉”)
同种元素不同价态之间发生氧化还原反应遵循以下规律:
高价+低价→中间价
1.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2 700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
检测
2.氢化钙可作为生氢剂,反应的化学方程式为CaH2+2H2O==Ca(OH)2+2H2↑。下列说法错误的是( )
A.氢化钙既是氧化剂又是还原剂
B.氢气既是氧化产物又是还原产物
C.氢化钙是还原剂,水是氧化剂
D.氧化产物与还原产物的质量比为1∶1
