课时检测2 科学家怎样研究有机物(Word解析版)
文档属性
| 名称 | 课时检测2 科学家怎样研究有机物(Word解析版) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-29 17:16:49 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
中小学教育资源及组卷应用平台
课时检测2 科学家怎样研究有机物
(时间:45分钟 满分:100分)
一、单选题
1.(2022秋·云南玉溪·高二云南省玉溪第一中学校考阶段练习)下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
【答案】D
【解析】A.乙醇与水互溶,不能作萃取剂,应选苯或四氯化碳分离出碘水中的碘,故A错误;
B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,应用蒸馏的方法分离,故B错误;
C.二者的溶解度受温度影响不同,则选择结晶法分离,与溶解度大小无关,故C错误;
D.二者互溶,但沸点不同,则蒸馏可除去丁醇中的乙醚,故D正确;
故选:D。
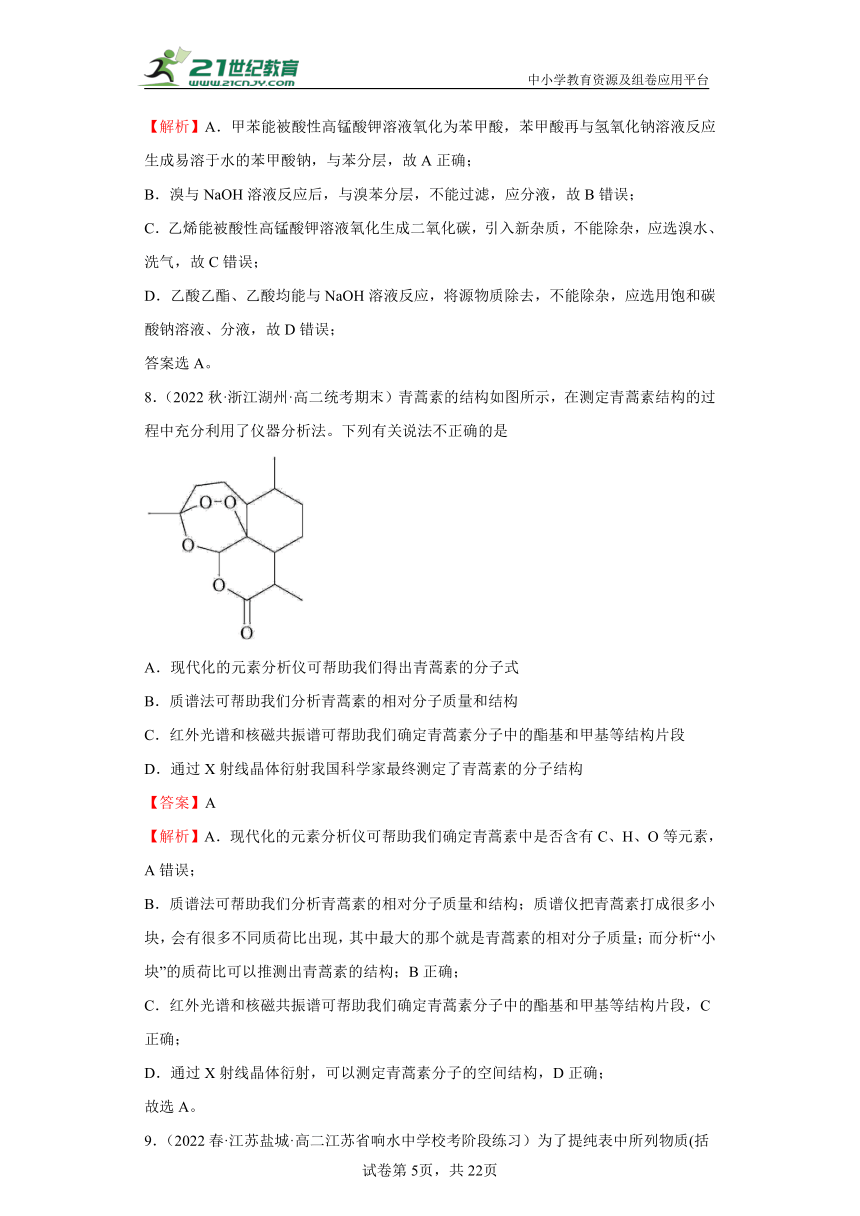
2.(2022秋·北京西城·高二北京十四中校考期中)用下图所示装置及药品进行相应实验,能达到实验目的的是
A.图1分离乙醇和乙酸 B.图2除去乙烷中的乙烯
C.图3除去四氯化碳中的溴单质 D.图4分离甲烷和氯气光照条件下发生反应的产物
【答案】D
【解析】A.乙酸和乙醇互溶,乙酸和乙醇混合后不分层,不能用分液法分离乙醇和乙酸,故不选A;
B.乙烯被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,不能用高锰酸钾溶液除去乙烷中的乙烯,一般用溴水除乙烷中的乙烯,故不选B;
C.溴易溶于四氯化碳,不能用过滤法除去四氯化碳中的溴单质,故不选C;
D.甲烷和氯气在光照条件下发生取代反应,生成沸点不同的氯代甲烷,用蒸馏法分离甲烷和氯气光照条件下发生反应的产物,故选D;
答案选D。
3.(2022秋·辽宁朝阳·高二建平县实验中学校考期中)下列除杂方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用苯萃取碘
B.硝基苯中混有浓硝酸和浓硫酸,加入足量溶液后分液
C.乙炔中混有H2S,将其通入盛有酸性溶液的洗气瓶
D.乙烯中混有乙炔,通氢气在一定条件下反应,使乙炔转化为乙烯
【答案】B
【解析】A.苯与溴苯互溶,不能用苯来萃取,A错误;
B.硝基苯中混有浓硝酸和浓硫酸,加入足量 NaOH 溶液后酸被反应掉,硝基苯与水层分层,可通过分液分离,B正确;
C.乙炔和硫化氢均与酸性高锰酸钾溶液反应,C错误;
D.乙烯和乙炔均能与氢气发生加成反应,D错误;
故选B。
4.(2022秋·河北邢台·高二邢台市南和区第一中学校考阶段练习)由过氧乙酸(CH3COOOH)、正丁酸、乙酸甲酯组成的混合物中,氢元素总的质量分数为7%,则氧元素总的质量分数为
A.17% B.34% C.51% D.68%
【答案】C
【解析】过氧乙酸(CH3COOOH)、正丁酸、乙酸甲酯的分子式分别为C2H4O3、C4H8O2、C3H6O2,则其平均组成为(CH2)nOm,混合物中氢元素总的质量分数为7%,则碳的质量分数为=42%,则氧元素总的质量分数为100%-7%-42%=51%,故选C。
5.(2022秋·浙江丽水·高二统考期末)利用、与合成的反应历程如图所示,下列说法不正确的是
A.合成过程涉及C-C键和C-OH键的形成
B.CO是合成的中间体
C.第3步的反应方程式为:
D.若用替代,则可生成
【答案】D
【分析】根据图示中各步中的反应物和生成物的区别判断化学键的断裂和形成,利用元素原子跟踪法判断元素反应的去向;
【解析】A.根据图示中第3步判断,合成过程中涉及C-C键和C-OH键的形成,故A正确;
B.根据图示中,CO在2步过程的生成物里,在第3步中的反应物中,故B正确;
C.根据图中表示:,故C正确;
D.若用替代生成的水分子是HDO,故D不正确;
故选答案D;
【点睛】此题考查反应历程中的变化,注意图象中的催化剂和中间产物的判断。
6.(2022秋·广东佛山·高二佛山一中校考期中)我国药学家屠呦呦因发现植物黄花蒿茎叶中含抗疟疾的物质——青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。
下列说法正确的是
A.研究青蒿素结构的基本步骤:分离、提纯→确定分子式→确定结构式
B.元素分析仪可以确定青蒿素的分子式为C15H22O5
C.核磁共振氢谱中双氢青蒿素8组峰
D.上述分子的空间结构可用X射线衍射测定
【答案】D
【解析】A.研究有机物一般步骤:分离、提纯→确定实验式→确定分子式→确定结构式,根据元素定量分析确定实验式、再测定相对分子质量确定分子式,最后通过波谱分析确定结构式, A错误;
B.利用元素分析仪可以确定青蒿素中是否含有C、H、O等元素,B错误;
C.双氢青蒿素分子内有14种氢原子,核磁共振氢谱中双氢青蒿素14组峰,C错误;
D.分子的空间结构可用X射线衍射测定,D正确;
答案选D。
7.(2022秋·陕西西安·高二统考期末)提纯下列物质(括号内为少量杂质),所选用的试剂与分离方法均正确的是
选项 混合物 除杂试剂 分离方法
A 苯(甲苯) 酸性KMnO4溶液,NaOH溶液 分液
B 溴苯(溴) NaOH溶液 过滤
C 甲烷(乙烯) 酸性KMnO4溶液 洗气
D 乙酸乙酯(乙酸) 氢氧化钠溶液 蒸馏
A.A B.B C.C D.D
【答案】A
【解析】A.甲苯能被酸性高锰酸钾溶液氧化为苯甲酸,苯甲酸再与氢氧化钠溶液反应生成易溶于水的苯甲酸钠,与苯分层,故A正确;
B.溴与NaOH溶液反应后,与溴苯分层,不能过滤,应分液,故B错误;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气,故C错误;
D.乙酸乙酯、乙酸均能与NaOH溶液反应,将源物质除去,不能除杂,应选用饱和碳酸钠溶液、分液,故D错误;
答案选A。
8.(2022秋·浙江湖州·高二统考期末)青蒿素的结构如图所示,在测定青蒿素结构的过程中充分利用了仪器分析法。下列有关说法不正确的是
A.现代化的元素分析仪可帮助我们得出青蒿素的分子式
B.质谱法可帮助我们分析青蒿素的相对分子质量和结构
C.红外光谱和核磁共振谱可帮助我们确定青蒿素分子中的酯基和甲基等结构片段
D.通过X射线晶体衍射我国科学家最终测定了青蒿素的分子结构
【答案】A
【解析】A.现代化的元素分析仪可帮助我们确定青蒿素中是否含有C、H、O等元素,A错误;
B.质谱法可帮助我们分析青蒿素的相对分子质量和结构;质谱仪把青蒿素打成很多小块,会有很多不同质荷比出现,其中最大的那个就是青蒿素的相对分子质量;而分析“小块”的质荷比可以推测出青蒿素的结构;B正确;
C.红外光谱和核磁共振谱可帮助我们确定青蒿素分子中的酯基和甲基等结构片段,C正确;
D.通过X射线晶体衍射,可以测定青蒿素分子的空间结构,D正确;
故选A。
9.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)为了提纯表中所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
选项 被提纯的物质 除杂试剂 分离方法
A 己烷(己烯) 溴水 分液
B 淀粉溶液() 水 过滤
C 蒸馏
D 饱和溶液 分液
A.A B.B C.C D.D
【答案】C
【解析】A.己烯与溴水发生加成反应,且溴易溶于己烷,引入新杂质,不能除杂,A错误;
B.溶液与胶体均可透过滤纸,不能分离,应用半透膜进行分离,B错误;
C.水与CaO反应后,产物增大与乙醇的沸点差异,然后蒸馏可分离,C正确;
D.二者均与NaOH溶液反应,不能除杂,应用饱和碳酸钠溶液,D错误;
故答案选:C。
10.(2022·高二课时练习)人类对赖以生存的地球环境的保护问题越来越重视,如何减少或取代高污染的化学制品的使用,一直是许多化学家奋斗的目标,生产和应用绿色化工原料是达到该目标的有效手段。碳酸二甲酯(简称DMC)是一种新的化工原料,1992年在欧洲被登记为“非毒性化学品”。下列关于DMC的说法不正确的是
A.DMC的结构简式为
B.DMC在空气中完全燃烧的产物为和
C.DMC易溶于水,不溶于乙醇和丙酮
D.DMC用于生产非毒性化工产品,故被誉为“有发展前途的化工原料”
【答案】C
【解析】A.碳酸二甲酯的结构简式为,A正确;
B.根据其结构简式,在空气中完全燃烧的产物为二氧化碳和水,B正确;
C.该有机物为酯类,不溶于水,易溶于乙醇和丙酮,C错误;
D.根据题中信息,DMC用于生产非毒性化工产品,故被誉为“有发展前途的化工原料”,D正确;
故选C。
11.(2022·高二单元测试)下列有关除杂质(括号中为杂质)的操作中,正确的是
A.苯(乙烯)——加入足量的溴水,过滤
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.乙醇(乙酸);加入足量饱和碳酸钠溶液充分振荡,分液,弃水层
D.乙酸乙酯(乙酸);加入适量乙醇、浓硫酸,加热,蒸馏。收集馏出物
【答案】B
【解析】A.加入溴水,乙烯与溴水反应生成,但能溶于苯,所以不能通过过滤除去,A项错误;
B.溴乙烷不溶于水,乙醇易溶于水,所以多次加水振荡,分液,可以除去乙醇,B项正确;
C.乙醇易溶于水,最后液体不分层,不能通过分液除去,C项错误;
D.酯化反应是可逆反应,不可能进行彻底,D项错误。
答案选B。
12.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)X的相对分子质量为100,将10.0gX在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。该有机物X的分子式为
A.C6H12O B.C5H8O2 C.C7H16 D.CaCO3
【答案】B
【解析】无水CaCl2增重的7.2g是水的质量,10.0gX中氢元素的物质的量为=0.8 mol, KOH浓溶液增重的22.0g是二氧化碳的质量,10.0gX中碳元素的物质的量为=0.5mol,根据质量守恒,氧元素的质量为10.0g-0.8 mol ×1 g/ mol-0.5 mol ×12 g/ mol=3.2 g.则氧元素的物质的量为=0.2 mol,则该分子中碳、氢、氧原子的个数之比为0.5 mol : 0.8 mol: 0.2 mol=5 : 8 : 2,结合X的相对分子质量可知,有机物X的分子式为C5H8O2;
故选B。
13.(2022秋·江西宜春·高二统考期末)某物质的分子式为,取该物质在足量的中充分燃烧后,将产物全部通入过量的中,若固体的质量增加了,且,则该物质是
A. B. C. D.
【答案】A
【分析】有机物在氧气中完全燃烧的化学方程式为:,产物为CO2和H2O通入过量的Na2O2发生的化学方程式为:①和②,由方程式①可知增重的质量为CO,由方程式②可知增重的质量为H2,则增重的质量=与CO2相同物质量的CO的质量+与H2O相同物质的量的H2。
【解析】据上述分析可知,当有机物满足时,既满足有机物中x=z,Na2O2固体的质量增加了,则m=n;若x>z,则m<n;若x<z,则m>n;则符合条件的为A选项;
答案选A。
14.(2022秋·福建福州·高二校考阶段练习)现代分析仪器对有机物M的分子结构进行测定,相关结果如下:
有关M的说法不正确的是
A.根据图1,M的相对分子质量应为74
B.根据图1、图2,推测M的分子式是C4H10O
C.根据图1、图2、图3信息,可确定M是2-甲基-2-丙醇
D.根据图1、图2、图3信息,M分子内有三种化学环境不同的H,个数比为6︰3︰1
【答案】C
【解析】A.质谱图中过最后一条线对应的质荷比为该分子的相对分子质量,图中看出为74,A正确;
B.图1知相对分子质量为74,图2知含醚键,该物质为醚,通式为CnH2n+2O,故n=4,分子式为C4H10O,B正确;
C.由图3知该分子中含三种不同化学环境的氢原子,而2-甲基-2-丙醇中只有2种不同化学环境的氢原子,C错误;
D.M分子内有三种化学环境不同的H,结构简式为CH3CH(OCH3)CH3,氢原子个数比为6:3:1,D正确;
故选C。
15.(2022秋·山东泰安·高二统考期中)将6.8g的X完全燃烧生成3.6g的H2O和8.96L(标准状况)的CO2。X的核磁共振氢谱有4个峰且面积之比为3:2:2:1.X分子中只含一个苯环且苯环上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱如图。关于X的下列叙述错误的是
A.X的相对分子质量为136
B.X的分子式为C8H8O2
C.X分子中所有的原子可能在同一个平面上
D.符合题中X分子结构的有机物的结构简式可能为
【答案】C
【分析】由质谱图数据可知,X的相对分子质量为136,有机物X的物质的量为n(X)==0.05mol,完全燃烧后生成水的物质的量为n(H2O)==0.2mol,氢原子的物质的量为n(H)=0.2mol×2=0.4mol,CO2的物质的量为n(CO2)==0.4mol,碳原子的物质的量为n(C)=0.4mol,则1个有机物A分子中含有8个碳原子、8个氢原子,O原子个数为:=2,所以该有机物的分子式为C8H8O2;不饱和度为=5,X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,峰面积之比为1:2:2:3,则四种氢原子个数之比=1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物X的结构简式为,据此分析作答。
【解析】A.由上述分析可知,化合物X的相对分子质量为136,A项正确;
B.由上述分析可知,X的分子式为C8H8O2,B项正确;
C.化合物X的结构简式为,分子中甲基上的原子一定不共平面,C项错误;
D.由上述分析可知,化合物X的结构简式为,D项正确;
答案选C。
16.(2022春·宁夏石嘴山·高二石嘴山市第三中学校考期中)环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法错误的是
A.(C4H9)4NBr是反应的催化剂 B.反应过程存在极性键的断裂和形成
C.反应过程中有4种中间体 D.总反应属于加成反应
【答案】C
【解析】A.由图中转化关系可知,是反应的催化剂,A项正确;
B.反应过程中存在碳溴键的断裂和氮溴键的形成,B项正确;
C.反应过程中有3种中间体,C项错误;
D.总反应是环氧乙烷衍生物与发生加成反应生成环状碳酸酯,D项正确。
故选C。
17.(2022·高二课时练习)已知青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于有机溶剂,如丙酮、氯仿,可溶于乙醇、乙醚等,在水中几乎不溶,熔点为156~157℃,热稳定性差。乙醚的沸点为35℃。如图是从黄花青蒿中提取青蒿素的工艺流程,下列有关实验操作的说法正确的是
A.研碎时应该将黄花青蒿置于烧杯中
B.操作Ⅰ是萃取,所用的玻璃仪器有烧杯、分液漏斗
C.操作Ⅱ是蒸馏,所用的玻璃仪器主要有蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶、牛角管
D.操作Ⅲ是用酒精灯加热,然后加水溶解、过滤
【答案】C
【分析】根据题给流程可知,对黄花青蒿进行干燥、研碎,可以增大黄花青蒿与乙醚的接触面积,提高青蒿素的浸取率;用乙醚对固体粉末进行浸取后,过滤,可得提取液和残渣;提取液经过蒸馏后可得青蒿素的粗品;向粗品中加入乙醇,浓缩、结晶、过滤可得精品,据此解答。
【解析】A.研碎时应该将黄花青蒿置于研钵中进行,选项A错误;
B.由上述分析可知,操作Ⅰ是将固体和液体分开,是过滤,选项B错误;
C.操作Ⅱ是将提取液中的乙醚分离出去,得到粗产品,蒸馏用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶、牛角管,选项C正确;
D.操作Ⅲ是重结晶,具体为溶解、加热浓缩、冷却结晶、过滤,酒精灯加热温度较高,青蒿素热稳定性差,由粗品得精品时不能用酒精灯加热,选项D错误。
答案选C。
二、多选题
18.(2022秋·河北秦皇岛·高二秦皇岛一中校考阶段练习)现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.李比希元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.的核磁共振氢谱中有四组峰,峰面积之比为1∶2∶2∶3
C.通过红外光谱分析可以区分乙醇和乙酸乙酯
D.质谱法是快速、精确测定相对分子质量的重要方法
【答案】CD
【解析】A.李比希元素分析仪可以测出试样常见的组成元素及含量,不能测定其分子的空间结构,A错误;
B.题中物质中不同化学环境的氢原子共5种,核磁共振氢谱中有五组峰,峰面积之比为1:2:2:1:3,B错误;
C.通过红外光谱分析可以测定分子的空间结构,故可以区分乙醇和乙酸乙酯,C正确;
D.质谱仪可以测定相对分子质量,质谱法是快速、精确测定相对分子质量的重要方法,D正确;
故选CD。
19.(2022秋·山东聊城·高二校考阶段练习)标准状况下无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀的质量为;若用足量碱石灰吸收燃烧产物,测得其增重。下列说法正确的是
A.该气体若是单一气体,则可能为或
B.该气体可能由等物质的量的和组成
C.不能确定该气体是否含氧元素
D.该气体不可能由等物质的量的和组成
【答案】BC
【解析】设燃烧产物中的质量为。则:
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 14.0g
解得,而碱石灰既能吸收水,又能吸收二氧化碳,因此,碱石灰增重的质量是二氧化碳和水的总质量,即,,无色可燃气体的物质的量(气体),,则;,则,即气体中含有原子和原子,所以该气体中含有原子、原子,可能含有氧元素。若该气体为单一气体,则其分子式是(在标准状况下不是气体),若该气体为等物质的量的两种气体的混合物,则在混合气体中,应含有原子原子,这两种气体可能是和或和或和等,故选BC。
20.(2022秋·山东聊城·高二校考阶段练习)化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,正确的是
A.分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与 4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物有两种
D.与A属于同类化合物的同分异构体有5种
【答案】AD
【分析】有机物A的分子式为分子式C8H8O2,不饱和度为5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为,据此解答。
【解析】A.A含有酯基,属于酯类化合物,在一定条件下能发生水解反应,A正确;
B.1molA在一定条件下只有苯环可与3mol H2发生加成反应,B错误;
C.符合题中A分子结构特征的有机物只有1种,C错误;
D.属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,D正确;
故选AD。
第II卷(非选择题)
请点击修改第II卷的文字说明
三、填空题
21.(2022秋·湖北宜昌·高二校联考期中)某化学小组为测定有机物G的组成和结构,设计如图实验装置:
回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是___。
(2)装置B和装置D中浓硫酸的作用分别是___和___。
(3)装置E和装置F中碱石灰的作用分别是___和___。
(4)若准确称取4.4g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加3.6g,U形管E质量增加8.8g。又知有机物G的质谱图如图所示。
该有机物的分子式为___。
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1。综上所述,G的结构简式为___。
【答案】 排出装置中的空气 干燥O2 吸收有机物燃烧生成的水蒸气 吸收有机物燃烧生成的CO2 吸收空气中的H2O和CO2 C4H8O2
【分析】实验开始时先制氧气,把装置中空气排出来,防止二氧化碳干扰,B干燥氧气,加热C,样品燃烧生成二氧化碳和水,CuO的作用是确保有机物充分氧化,最终生成CO2和H2O,D用于吸收生成物中的水,E用于吸收生成物中的二氧化碳,F防止空气中的二氧化碳和水进入E装置,根据称量的质量进行有关的计算。
【解析】(1) 实验开始时先制氧气,把装置中空气排出来,防止二氧化碳干扰,答案为排出装置中的空气;
(2) B中浓硫酸用于干燥氧气,防止干扰生成的水,D用于吸收生成物中的水,答案为干燥O2 吸收有机物燃烧生成的水蒸气;
(3) E用于吸收生成物中的二氧化碳,F防止空气中的二氧化碳和水进入E装置,答案为吸收有机物燃烧生成的CO2 吸收空气中的H2O和CO2;
(4)装置D的质量增加3.6g,样品中的H的物质的量为3.6g÷18g/mol×2=0.4mol,质量为0.4g,U形管E质量增加8.8g,样品中C的物质的量为8.8g÷44g/mol=0.2mol,质量为2.4g,所以样品中O的质量为4.4g-0.4g-2.4g=1.6g,O的物质的量为1.6g÷16g/mol=0.1mol,样品中C:H:O=0.2mol: 0.4mol:0.1mol=2:4:1,由图可知,该物质的相对分子质量为88,因此该物质的分子式为C4H8O2。
(5)有机物G的分子式为C4H8O2,其中有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1,符合条件的结构简式为。
22.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图1所示,仪器a的名称是_______,图中虚线框内应选用图中的_______(填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为_______。
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为_______,分子式为_______。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
M中官能团的名称为_______,M的结构简式为_______。
【答案】(1) 蒸馏烧瓶 仪器y
(2) 88
(3) 羟基、羰基
【解析】(1)
根据装置图,仪器a的名称为蒸馏烧瓶;蒸馏时使用仪器直形冷凝管,球形冷凝管一般用于冷凝回流装置中,选仪器y。
(2)
①M中碳的质量分数为54.5%,氢的质量分数为9.1%,所以该有机物中还一定含有氧元素,氧元素的质量分数为,分子内各元素原子的个数比,所以实验式为;
②同温同压,密度比等于相对分子量之比。M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为,设分子式为,则,n=2,则分子式为。
(3)
根据核磁共振氢谱图中有4组峰,说明分子中含有4种不同化学环境的氢原子,且个数比为1∶3∶1∶3,结合红外光谱图所示含有C-H、H-O、C=O等化学键,其结构简式为,所含官能团为羟基、羰基。
23.(2022秋·广东东莞·高二东莞市东华高级中学校考阶段练习)Ⅰ.通过蒸馏的方法可以分离和提纯互溶的液态有机物,原理如图所示。
(1)写出下列仪器的名称:①_______,②_______。
(2)化合物A(结构简式为)的含氧官能团为_______和_______(填官能团名称)。
(3)与具有相同官能团的一种同分异构体的结构简式为_______。
Ⅱ.有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。已知:完全燃烧某有机物A,生成和。有机物A的仪器分析如下:
①有机物A的质谱
②有机物A的红外光谱
③有机物A的核磁共振氢谱图上有2个吸收蜂,峰面积之比是。
回答下列问题:
(4)A的化学式为_______;A的结构简式是_______。
【答案】(1) 直形冷凝管 蒸馏烧瓶
(2) 羟基 醛基
(3)CH2=CHCH2COOH或CH3CH=CHCOOH
(4) C3H6O2 CH3COOCH3
【解析】(1)
由装置图可知:仪器①为直形冷凝管,②为蒸馏烧瓶。
(2)
化合物A的含氧官能团为羟基和醛基。
(3)
与含有相同官能团的同分异构体的结构简式为:CH2=CHCH2COOH、CH3CH=CHCOOH。
(4)
13.2gCO2中含有C的物质的量为n(C)=n(CO2)==0.3mol,含有H的物质的量为n(H)=2n(H2O)=2×=0.6mol,即0.1mol有机物A含有0.3molC、0.6molH,分子式可设为C3H6Ox,根据有机物A的质谱可知,有机物A的相对分子质量为74,则12×3+6+16x=74,解得x=2,所以有机物A的分子式为C3H6O2,有机物A可能为酸或酯类,根据红外光谱可知,有机物A中含有C=O键、C-O-C键和CH3基团,核磁共振氢谱图上有2个吸收蜂,峰面积之比是1:1,说明该有机物分子中有2种化学环境不同的H原子,所以有机物A为乙酸甲酯,分子式为C3H6O2,结构简式为CH3COOCH3。
24.(2022秋·甘肃定西·高二甘肃省临洮中学校考阶段练习)三聚氰胺最早被李比希于1834年合成。它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分了中,氮元素的含量高达,氢元素的质量分数为,其余为碳元素。它的相对分子质量大于100,但小于150。回答下列问题:
(1)分子式中原子个数比_______。
(2)三聚氰胺分子中碳原子数为_______。
(3)三聚氰胺的分子式为_______。
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为_______。
【答案】(1)1∶2∶2
(2)3
(3)C3H6N6
(4)
【分析】三聚氰胺分子中,含有C、H、N三种元素,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,则含有碳元素为28.57%,已知相对分子质量大于100,但小于150,则N(C)<=3.5,N(C)>=2.4,取整,即碳原子数目为3,分子量=3×12÷28.57%=126,N(N)==6,N(H)==6。
(1)
经分析,三聚氰胺分子中原子个数比3∶6∶6=1∶2∶2。
(2)
经分析,三聚氰胺分子中碳原子个数为3。
(3)
经分析,三聚氰胺分子中原子个数比3∶6∶6,则三聚氰胺的分子式为C3H6N6。
(4)
若红外光谱表征有1个由碳氮两种元素组成的六元杂环,则3个碳原子与3个氮元素形成六元环,核磁共振氢谱显示只有1个吸收峰,且共有6个氢原子,则六元环中含有碳氮双键,且N、C交替出现,剩余的N原子与2个氢原子形成氨基,结构简式为。
25.(2022·全国·高二专题练习)化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式
______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,
E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.
【答案】 H2O2 2H2O22H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰 吸收CO2 造成测得有机物中含氢量增大 CH2O 测出有机物的相对分子质量
【解析】(1)实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O22H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O;
(3)有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠;
(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论;
(5)D管中无水氯化钙原来吸收水蒸气,质量增加0.72 g,则生成的水是0.72g,水物质的量是0.72g÷18g/mol=0.04mol,其中氢元素的质量是0.08g;E管质量增加1.76g,即CO2是1.76g,物质的量是1.76g÷44g/mol=0.04mol,其中碳元素的质量是0.48g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20g-0.08g-0.48g=0.64g,则氧原子的物质的量是0.04mol,所以原有机物中C、H、O的原子个数之比是0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
(6)最简式要确定分子式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测出有机物的相对分子质量。
试卷第4页,共22页
试卷第1页,共22页
中小学教育资源及组卷应用平台
课时检测2 科学家怎样研究有机物
(时间:45分钟 满分:100分)
一、单选题
1.(2022秋·云南玉溪·高二云南省玉溪第一中学校考阶段练习)下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很小
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
【答案】D
【解析】A.乙醇与水互溶,不能作萃取剂,应选苯或四氯化碳分离出碘水中的碘,故A错误;
B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,应用蒸馏的方法分离,故B错误;
C.二者的溶解度受温度影响不同,则选择结晶法分离,与溶解度大小无关,故C错误;
D.二者互溶,但沸点不同,则蒸馏可除去丁醇中的乙醚,故D正确;
故选:D。
2.(2022秋·北京西城·高二北京十四中校考期中)用下图所示装置及药品进行相应实验,能达到实验目的的是
A.图1分离乙醇和乙酸 B.图2除去乙烷中的乙烯
C.图3除去四氯化碳中的溴单质 D.图4分离甲烷和氯气光照条件下发生反应的产物
【答案】D
【解析】A.乙酸和乙醇互溶,乙酸和乙醇混合后不分层,不能用分液法分离乙醇和乙酸,故不选A;
B.乙烯被酸性高锰酸钾溶液氧化为二氧化碳,引入新的杂质,不能用高锰酸钾溶液除去乙烷中的乙烯,一般用溴水除乙烷中的乙烯,故不选B;
C.溴易溶于四氯化碳,不能用过滤法除去四氯化碳中的溴单质,故不选C;
D.甲烷和氯气在光照条件下发生取代反应,生成沸点不同的氯代甲烷,用蒸馏法分离甲烷和氯气光照条件下发生反应的产物,故选D;
答案选D。
3.(2022秋·辽宁朝阳·高二建平县实验中学校考期中)下列除杂方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用苯萃取碘
B.硝基苯中混有浓硝酸和浓硫酸,加入足量溶液后分液
C.乙炔中混有H2S,将其通入盛有酸性溶液的洗气瓶
D.乙烯中混有乙炔,通氢气在一定条件下反应,使乙炔转化为乙烯
【答案】B
【解析】A.苯与溴苯互溶,不能用苯来萃取,A错误;
B.硝基苯中混有浓硝酸和浓硫酸,加入足量 NaOH 溶液后酸被反应掉,硝基苯与水层分层,可通过分液分离,B正确;
C.乙炔和硫化氢均与酸性高锰酸钾溶液反应,C错误;
D.乙烯和乙炔均能与氢气发生加成反应,D错误;
故选B。
4.(2022秋·河北邢台·高二邢台市南和区第一中学校考阶段练习)由过氧乙酸(CH3COOOH)、正丁酸、乙酸甲酯组成的混合物中,氢元素总的质量分数为7%,则氧元素总的质量分数为
A.17% B.34% C.51% D.68%
【答案】C
【解析】过氧乙酸(CH3COOOH)、正丁酸、乙酸甲酯的分子式分别为C2H4O3、C4H8O2、C3H6O2,则其平均组成为(CH2)nOm,混合物中氢元素总的质量分数为7%,则碳的质量分数为=42%,则氧元素总的质量分数为100%-7%-42%=51%,故选C。
5.(2022秋·浙江丽水·高二统考期末)利用、与合成的反应历程如图所示,下列说法不正确的是
A.合成过程涉及C-C键和C-OH键的形成
B.CO是合成的中间体
C.第3步的反应方程式为:
D.若用替代,则可生成
【答案】D
【分析】根据图示中各步中的反应物和生成物的区别判断化学键的断裂和形成,利用元素原子跟踪法判断元素反应的去向;
【解析】A.根据图示中第3步判断,合成过程中涉及C-C键和C-OH键的形成,故A正确;
B.根据图示中,CO在2步过程的生成物里,在第3步中的反应物中,故B正确;
C.根据图中表示:,故C正确;
D.若用替代生成的水分子是HDO,故D不正确;
故选答案D;
【点睛】此题考查反应历程中的变化,注意图象中的催化剂和中间产物的判断。
6.(2022秋·广东佛山·高二佛山一中校考期中)我国药学家屠呦呦因发现植物黄花蒿茎叶中含抗疟疾的物质——青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。
下列说法正确的是
A.研究青蒿素结构的基本步骤:分离、提纯→确定分子式→确定结构式
B.元素分析仪可以确定青蒿素的分子式为C15H22O5
C.核磁共振氢谱中双氢青蒿素8组峰
D.上述分子的空间结构可用X射线衍射测定
【答案】D
【解析】A.研究有机物一般步骤:分离、提纯→确定实验式→确定分子式→确定结构式,根据元素定量分析确定实验式、再测定相对分子质量确定分子式,最后通过波谱分析确定结构式, A错误;
B.利用元素分析仪可以确定青蒿素中是否含有C、H、O等元素,B错误;
C.双氢青蒿素分子内有14种氢原子,核磁共振氢谱中双氢青蒿素14组峰,C错误;
D.分子的空间结构可用X射线衍射测定,D正确;
答案选D。
7.(2022秋·陕西西安·高二统考期末)提纯下列物质(括号内为少量杂质),所选用的试剂与分离方法均正确的是
选项 混合物 除杂试剂 分离方法
A 苯(甲苯) 酸性KMnO4溶液,NaOH溶液 分液
B 溴苯(溴) NaOH溶液 过滤
C 甲烷(乙烯) 酸性KMnO4溶液 洗气
D 乙酸乙酯(乙酸) 氢氧化钠溶液 蒸馏
A.A B.B C.C D.D
【答案】A
【解析】A.甲苯能被酸性高锰酸钾溶液氧化为苯甲酸,苯甲酸再与氢氧化钠溶液反应生成易溶于水的苯甲酸钠,与苯分层,故A正确;
B.溴与NaOH溶液反应后,与溴苯分层,不能过滤,应分液,故B错误;
C.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气,故C错误;
D.乙酸乙酯、乙酸均能与NaOH溶液反应,将源物质除去,不能除杂,应选用饱和碳酸钠溶液、分液,故D错误;
答案选A。
8.(2022秋·浙江湖州·高二统考期末)青蒿素的结构如图所示,在测定青蒿素结构的过程中充分利用了仪器分析法。下列有关说法不正确的是
A.现代化的元素分析仪可帮助我们得出青蒿素的分子式
B.质谱法可帮助我们分析青蒿素的相对分子质量和结构
C.红外光谱和核磁共振谱可帮助我们确定青蒿素分子中的酯基和甲基等结构片段
D.通过X射线晶体衍射我国科学家最终测定了青蒿素的分子结构
【答案】A
【解析】A.现代化的元素分析仪可帮助我们确定青蒿素中是否含有C、H、O等元素,A错误;
B.质谱法可帮助我们分析青蒿素的相对分子质量和结构;质谱仪把青蒿素打成很多小块,会有很多不同质荷比出现,其中最大的那个就是青蒿素的相对分子质量;而分析“小块”的质荷比可以推测出青蒿素的结构;B正确;
C.红外光谱和核磁共振谱可帮助我们确定青蒿素分子中的酯基和甲基等结构片段,C正确;
D.通过X射线晶体衍射,可以测定青蒿素分子的空间结构,D正确;
故选A。
9.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)为了提纯表中所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
选项 被提纯的物质 除杂试剂 分离方法
A 己烷(己烯) 溴水 分液
B 淀粉溶液() 水 过滤
C 蒸馏
D 饱和溶液 分液
A.A B.B C.C D.D
【答案】C
【解析】A.己烯与溴水发生加成反应,且溴易溶于己烷,引入新杂质,不能除杂,A错误;
B.溶液与胶体均可透过滤纸,不能分离,应用半透膜进行分离,B错误;
C.水与CaO反应后,产物增大与乙醇的沸点差异,然后蒸馏可分离,C正确;
D.二者均与NaOH溶液反应,不能除杂,应用饱和碳酸钠溶液,D错误;
故答案选:C。
10.(2022·高二课时练习)人类对赖以生存的地球环境的保护问题越来越重视,如何减少或取代高污染的化学制品的使用,一直是许多化学家奋斗的目标,生产和应用绿色化工原料是达到该目标的有效手段。碳酸二甲酯(简称DMC)是一种新的化工原料,1992年在欧洲被登记为“非毒性化学品”。下列关于DMC的说法不正确的是
A.DMC的结构简式为
B.DMC在空气中完全燃烧的产物为和
C.DMC易溶于水,不溶于乙醇和丙酮
D.DMC用于生产非毒性化工产品,故被誉为“有发展前途的化工原料”
【答案】C
【解析】A.碳酸二甲酯的结构简式为,A正确;
B.根据其结构简式,在空气中完全燃烧的产物为二氧化碳和水,B正确;
C.该有机物为酯类,不溶于水,易溶于乙醇和丙酮,C错误;
D.根据题中信息,DMC用于生产非毒性化工产品,故被誉为“有发展前途的化工原料”,D正确;
故选C。
11.(2022·高二单元测试)下列有关除杂质(括号中为杂质)的操作中,正确的是
A.苯(乙烯)——加入足量的溴水,过滤
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.乙醇(乙酸);加入足量饱和碳酸钠溶液充分振荡,分液,弃水层
D.乙酸乙酯(乙酸);加入适量乙醇、浓硫酸,加热,蒸馏。收集馏出物
【答案】B
【解析】A.加入溴水,乙烯与溴水反应生成,但能溶于苯,所以不能通过过滤除去,A项错误;
B.溴乙烷不溶于水,乙醇易溶于水,所以多次加水振荡,分液,可以除去乙醇,B项正确;
C.乙醇易溶于水,最后液体不分层,不能通过分液除去,C项错误;
D.酯化反应是可逆反应,不可能进行彻底,D项错误。
答案选B。
12.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)X的相对分子质量为100,将10.0gX在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。该有机物X的分子式为
A.C6H12O B.C5H8O2 C.C7H16 D.CaCO3
【答案】B
【解析】无水CaCl2增重的7.2g是水的质量,10.0gX中氢元素的物质的量为=0.8 mol, KOH浓溶液增重的22.0g是二氧化碳的质量,10.0gX中碳元素的物质的量为=0.5mol,根据质量守恒,氧元素的质量为10.0g-0.8 mol ×1 g/ mol-0.5 mol ×12 g/ mol=3.2 g.则氧元素的物质的量为=0.2 mol,则该分子中碳、氢、氧原子的个数之比为0.5 mol : 0.8 mol: 0.2 mol=5 : 8 : 2,结合X的相对分子质量可知,有机物X的分子式为C5H8O2;
故选B。
13.(2022秋·江西宜春·高二统考期末)某物质的分子式为,取该物质在足量的中充分燃烧后,将产物全部通入过量的中,若固体的质量增加了,且,则该物质是
A. B. C. D.
【答案】A
【分析】有机物在氧气中完全燃烧的化学方程式为:,产物为CO2和H2O通入过量的Na2O2发生的化学方程式为:①和②,由方程式①可知增重的质量为CO,由方程式②可知增重的质量为H2,则增重的质量=与CO2相同物质量的CO的质量+与H2O相同物质的量的H2。
【解析】据上述分析可知,当有机物满足时,既满足有机物中x=z,Na2O2固体的质量增加了,则m=n;若x>z,则m<n;若x<z,则m>n;则符合条件的为A选项;
答案选A。
14.(2022秋·福建福州·高二校考阶段练习)现代分析仪器对有机物M的分子结构进行测定,相关结果如下:
有关M的说法不正确的是
A.根据图1,M的相对分子质量应为74
B.根据图1、图2,推测M的分子式是C4H10O
C.根据图1、图2、图3信息,可确定M是2-甲基-2-丙醇
D.根据图1、图2、图3信息,M分子内有三种化学环境不同的H,个数比为6︰3︰1
【答案】C
【解析】A.质谱图中过最后一条线对应的质荷比为该分子的相对分子质量,图中看出为74,A正确;
B.图1知相对分子质量为74,图2知含醚键,该物质为醚,通式为CnH2n+2O,故n=4,分子式为C4H10O,B正确;
C.由图3知该分子中含三种不同化学环境的氢原子,而2-甲基-2-丙醇中只有2种不同化学环境的氢原子,C错误;
D.M分子内有三种化学环境不同的H,结构简式为CH3CH(OCH3)CH3,氢原子个数比为6:3:1,D正确;
故选C。
15.(2022秋·山东泰安·高二统考期中)将6.8g的X完全燃烧生成3.6g的H2O和8.96L(标准状况)的CO2。X的核磁共振氢谱有4个峰且面积之比为3:2:2:1.X分子中只含一个苯环且苯环上只有一个取代基,其质谱图、核磁共振氢谱与红外光谱如图。关于X的下列叙述错误的是
A.X的相对分子质量为136
B.X的分子式为C8H8O2
C.X分子中所有的原子可能在同一个平面上
D.符合题中X分子结构的有机物的结构简式可能为
【答案】C
【分析】由质谱图数据可知,X的相对分子质量为136,有机物X的物质的量为n(X)==0.05mol,完全燃烧后生成水的物质的量为n(H2O)==0.2mol,氢原子的物质的量为n(H)=0.2mol×2=0.4mol,CO2的物质的量为n(CO2)==0.4mol,碳原子的物质的量为n(C)=0.4mol,则1个有机物A分子中含有8个碳原子、8个氢原子,O原子个数为:=2,所以该有机物的分子式为C8H8O2;不饱和度为=5,X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,峰面积之比为1:2:2:3,则四种氢原子个数之比=1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物X的结构简式为,据此分析作答。
【解析】A.由上述分析可知,化合物X的相对分子质量为136,A项正确;
B.由上述分析可知,X的分子式为C8H8O2,B项正确;
C.化合物X的结构简式为,分子中甲基上的原子一定不共平面,C项错误;
D.由上述分析可知,化合物X的结构简式为,D项正确;
答案选C。
16.(2022春·宁夏石嘴山·高二石嘴山市第三中学校考期中)环状碳酸酯广泛用于极性非质子溶剂、电池的电解质等,离子液体研究团队近期报道了一种环氧乙烷衍生物与二氧化碳催化合成环状碳酸酯的反应历程如图所示。已知:R表示烃基。下列说法错误的是
A.(C4H9)4NBr是反应的催化剂 B.反应过程存在极性键的断裂和形成
C.反应过程中有4种中间体 D.总反应属于加成反应
【答案】C
【解析】A.由图中转化关系可知,是反应的催化剂,A项正确;
B.反应过程中存在碳溴键的断裂和氮溴键的形成,B项正确;
C.反应过程中有3种中间体,C项错误;
D.总反应是环氧乙烷衍生物与发生加成反应生成环状碳酸酯,D项正确。
故选C。
17.(2022·高二课时练习)已知青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于有机溶剂,如丙酮、氯仿,可溶于乙醇、乙醚等,在水中几乎不溶,熔点为156~157℃,热稳定性差。乙醚的沸点为35℃。如图是从黄花青蒿中提取青蒿素的工艺流程,下列有关实验操作的说法正确的是
A.研碎时应该将黄花青蒿置于烧杯中
B.操作Ⅰ是萃取,所用的玻璃仪器有烧杯、分液漏斗
C.操作Ⅱ是蒸馏,所用的玻璃仪器主要有蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶、牛角管
D.操作Ⅲ是用酒精灯加热,然后加水溶解、过滤
【答案】C
【分析】根据题给流程可知,对黄花青蒿进行干燥、研碎,可以增大黄花青蒿与乙醚的接触面积,提高青蒿素的浸取率;用乙醚对固体粉末进行浸取后,过滤,可得提取液和残渣;提取液经过蒸馏后可得青蒿素的粗品;向粗品中加入乙醇,浓缩、结晶、过滤可得精品,据此解答。
【解析】A.研碎时应该将黄花青蒿置于研钵中进行,选项A错误;
B.由上述分析可知,操作Ⅰ是将固体和液体分开,是过滤,选项B错误;
C.操作Ⅱ是将提取液中的乙醚分离出去,得到粗产品,蒸馏用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶、牛角管,选项C正确;
D.操作Ⅲ是重结晶,具体为溶解、加热浓缩、冷却结晶、过滤,酒精灯加热温度较高,青蒿素热稳定性差,由粗品得精品时不能用酒精灯加热,选项D错误。
答案选C。
二、多选题
18.(2022秋·河北秦皇岛·高二秦皇岛一中校考阶段练习)现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.李比希元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.的核磁共振氢谱中有四组峰,峰面积之比为1∶2∶2∶3
C.通过红外光谱分析可以区分乙醇和乙酸乙酯
D.质谱法是快速、精确测定相对分子质量的重要方法
【答案】CD
【解析】A.李比希元素分析仪可以测出试样常见的组成元素及含量,不能测定其分子的空间结构,A错误;
B.题中物质中不同化学环境的氢原子共5种,核磁共振氢谱中有五组峰,峰面积之比为1:2:2:1:3,B错误;
C.通过红外光谱分析可以测定分子的空间结构,故可以区分乙醇和乙酸乙酯,C正确;
D.质谱仪可以测定相对分子质量,质谱法是快速、精确测定相对分子质量的重要方法,D正确;
故选CD。
19.(2022秋·山东聊城·高二校考阶段练习)标准状况下无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀的质量为;若用足量碱石灰吸收燃烧产物,测得其增重。下列说法正确的是
A.该气体若是单一气体,则可能为或
B.该气体可能由等物质的量的和组成
C.不能确定该气体是否含氧元素
D.该气体不可能由等物质的量的和组成
【答案】BC
【解析】设燃烧产物中的质量为。则:
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 14.0g
解得,而碱石灰既能吸收水,又能吸收二氧化碳,因此,碱石灰增重的质量是二氧化碳和水的总质量,即,,无色可燃气体的物质的量(气体),,则;,则,即气体中含有原子和原子,所以该气体中含有原子、原子,可能含有氧元素。若该气体为单一气体,则其分子式是(在标准状况下不是气体),若该气体为等物质的量的两种气体的混合物,则在混合气体中,应含有原子原子,这两种气体可能是和或和或和等,故选BC。
20.(2022秋·山东聊城·高二校考阶段练习)化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,正确的是
A.分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与 4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物有两种
D.与A属于同类化合物的同分异构体有5种
【答案】AD
【分析】有机物A的分子式为分子式C8H8O2,不饱和度为5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为,据此解答。
【解析】A.A含有酯基,属于酯类化合物,在一定条件下能发生水解反应,A正确;
B.1molA在一定条件下只有苯环可与3mol H2发生加成反应,B错误;
C.符合题中A分子结构特征的有机物只有1种,C错误;
D.属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,D正确;
故选AD。
第II卷(非选择题)
请点击修改第II卷的文字说明
三、填空题
21.(2022秋·湖北宜昌·高二校联考期中)某化学小组为测定有机物G的组成和结构,设计如图实验装置:
回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是___。
(2)装置B和装置D中浓硫酸的作用分别是___和___。
(3)装置E和装置F中碱石灰的作用分别是___和___。
(4)若准确称取4.4g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加3.6g,U形管E质量增加8.8g。又知有机物G的质谱图如图所示。
该有机物的分子式为___。
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1。综上所述,G的结构简式为___。
【答案】 排出装置中的空气 干燥O2 吸收有机物燃烧生成的水蒸气 吸收有机物燃烧生成的CO2 吸收空气中的H2O和CO2 C4H8O2
【分析】实验开始时先制氧气,把装置中空气排出来,防止二氧化碳干扰,B干燥氧气,加热C,样品燃烧生成二氧化碳和水,CuO的作用是确保有机物充分氧化,最终生成CO2和H2O,D用于吸收生成物中的水,E用于吸收生成物中的二氧化碳,F防止空气中的二氧化碳和水进入E装置,根据称量的质量进行有关的计算。
【解析】(1) 实验开始时先制氧气,把装置中空气排出来,防止二氧化碳干扰,答案为排出装置中的空气;
(2) B中浓硫酸用于干燥氧气,防止干扰生成的水,D用于吸收生成物中的水,答案为干燥O2 吸收有机物燃烧生成的水蒸气;
(3) E用于吸收生成物中的二氧化碳,F防止空气中的二氧化碳和水进入E装置,答案为吸收有机物燃烧生成的CO2 吸收空气中的H2O和CO2;
(4)装置D的质量增加3.6g,样品中的H的物质的量为3.6g÷18g/mol×2=0.4mol,质量为0.4g,U形管E质量增加8.8g,样品中C的物质的量为8.8g÷44g/mol=0.2mol,质量为2.4g,所以样品中O的质量为4.4g-0.4g-2.4g=1.6g,O的物质的量为1.6g÷16g/mol=0.1mol,样品中C:H:O=0.2mol: 0.4mol:0.1mol=2:4:1,由图可知,该物质的相对分子质量为88,因此该物质的分子式为C4H8O2。
(5)有机物G的分子式为C4H8O2,其中有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6:1:1,符合条件的结构简式为。
22.(2022春·江苏盐城·高二江苏省响水中学校考阶段练习)有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图1所示,仪器a的名称是_______,图中虚线框内应选用图中的_______(填“仪器x”或“仪器y”)。
步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为_______。
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为_______,分子式为_______。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。
M中官能团的名称为_______,M的结构简式为_______。
【答案】(1) 蒸馏烧瓶 仪器y
(2) 88
(3) 羟基、羰基
【解析】(1)
根据装置图,仪器a的名称为蒸馏烧瓶;蒸馏时使用仪器直形冷凝管,球形冷凝管一般用于冷凝回流装置中,选仪器y。
(2)
①M中碳的质量分数为54.5%,氢的质量分数为9.1%,所以该有机物中还一定含有氧元素,氧元素的质量分数为,分子内各元素原子的个数比,所以实验式为;
②同温同压,密度比等于相对分子量之比。M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为,设分子式为,则,n=2,则分子式为。
(3)
根据核磁共振氢谱图中有4组峰,说明分子中含有4种不同化学环境的氢原子,且个数比为1∶3∶1∶3,结合红外光谱图所示含有C-H、H-O、C=O等化学键,其结构简式为,所含官能团为羟基、羰基。
23.(2022秋·广东东莞·高二东莞市东华高级中学校考阶段练习)Ⅰ.通过蒸馏的方法可以分离和提纯互溶的液态有机物,原理如图所示。
(1)写出下列仪器的名称:①_______,②_______。
(2)化合物A(结构简式为)的含氧官能团为_______和_______(填官能团名称)。
(3)与具有相同官能团的一种同分异构体的结构简式为_______。
Ⅱ.有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。已知:完全燃烧某有机物A,生成和。有机物A的仪器分析如下:
①有机物A的质谱
②有机物A的红外光谱
③有机物A的核磁共振氢谱图上有2个吸收蜂,峰面积之比是。
回答下列问题:
(4)A的化学式为_______;A的结构简式是_______。
【答案】(1) 直形冷凝管 蒸馏烧瓶
(2) 羟基 醛基
(3)CH2=CHCH2COOH或CH3CH=CHCOOH
(4) C3H6O2 CH3COOCH3
【解析】(1)
由装置图可知:仪器①为直形冷凝管,②为蒸馏烧瓶。
(2)
化合物A的含氧官能团为羟基和醛基。
(3)
与含有相同官能团的同分异构体的结构简式为:CH2=CHCH2COOH、CH3CH=CHCOOH。
(4)
13.2gCO2中含有C的物质的量为n(C)=n(CO2)==0.3mol,含有H的物质的量为n(H)=2n(H2O)=2×=0.6mol,即0.1mol有机物A含有0.3molC、0.6molH,分子式可设为C3H6Ox,根据有机物A的质谱可知,有机物A的相对分子质量为74,则12×3+6+16x=74,解得x=2,所以有机物A的分子式为C3H6O2,有机物A可能为酸或酯类,根据红外光谱可知,有机物A中含有C=O键、C-O-C键和CH3基团,核磁共振氢谱图上有2个吸收蜂,峰面积之比是1:1,说明该有机物分子中有2种化学环境不同的H原子,所以有机物A为乙酸甲酯,分子式为C3H6O2,结构简式为CH3COOCH3。
24.(2022秋·甘肃定西·高二甘肃省临洮中学校考阶段练习)三聚氰胺最早被李比希于1834年合成。它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分了中,氮元素的含量高达,氢元素的质量分数为,其余为碳元素。它的相对分子质量大于100,但小于150。回答下列问题:
(1)分子式中原子个数比_______。
(2)三聚氰胺分子中碳原子数为_______。
(3)三聚氰胺的分子式为_______。
(4)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为_______。
【答案】(1)1∶2∶2
(2)3
(3)C3H6N6
(4)
【分析】三聚氰胺分子中,含有C、H、N三种元素,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,则含有碳元素为28.57%,已知相对分子质量大于100,但小于150,则N(C)<=3.5,N(C)>=2.4,取整,即碳原子数目为3,分子量=3×12÷28.57%=126,N(N)==6,N(H)==6。
(1)
经分析,三聚氰胺分子中原子个数比3∶6∶6=1∶2∶2。
(2)
经分析,三聚氰胺分子中碳原子个数为3。
(3)
经分析,三聚氰胺分子中原子个数比3∶6∶6,则三聚氰胺的分子式为C3H6N6。
(4)
若红外光谱表征有1个由碳氮两种元素组成的六元杂环,则3个碳原子与3个氮元素形成六元环,核磁共振氢谱显示只有1个吸收峰,且共有6个氢原子,则六元环中含有碳氮双键,且N、C交替出现,剩余的N原子与2个氢原子形成氨基,结构简式为。
25.(2022·全国·高二专题练习)化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式
______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,
E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.
【答案】 H2O2 2H2O22H2O+O2↑ 使有机物充分氧化生成CO2和H2O 碱石灰 吸收CO2 造成测得有机物中含氢量增大 CH2O 测出有机物的相对分子质量
【解析】(1)实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O22H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O;
(3)有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠;
(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论;
(5)D管中无水氯化钙原来吸收水蒸气,质量增加0.72 g,则生成的水是0.72g,水物质的量是0.72g÷18g/mol=0.04mol,其中氢元素的质量是0.08g;E管质量增加1.76g,即CO2是1.76g,物质的量是1.76g÷44g/mol=0.04mol,其中碳元素的质量是0.48g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20g-0.08g-0.48g=0.64g,则氧原子的物质的量是0.04mol,所以原有机物中C、H、O的原子个数之比是0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O;
(6)最简式要确定分子式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测出有机物的相对分子质量。
试卷第4页,共22页
试卷第1页,共22页
