化学人教版(2019)必修第一册4.3.2化学键(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2化学键(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 515.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 11:13:08 | ||
图片预览






文档简介
(共18张PPT)
4.3.2 化学键
原子之间通过共用电子对所形成的强烈相互作用,叫共价键
1、共价键定义:
成键微粒:
成键本质:
原子
共用电子对
2、共价键的成键特点
成键条件:
一般由非金属元素形成
3、共价化合物:
不同原子之间以共用电子对形成分子的化合物。
共价键
4、共价键的存在
(1) 共价化合物:
(2) 多原子非金属单质
(3) 含根的离子化合物 :
含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4....
HCl、 CO2 、NH3....
只含有共价键的化合物
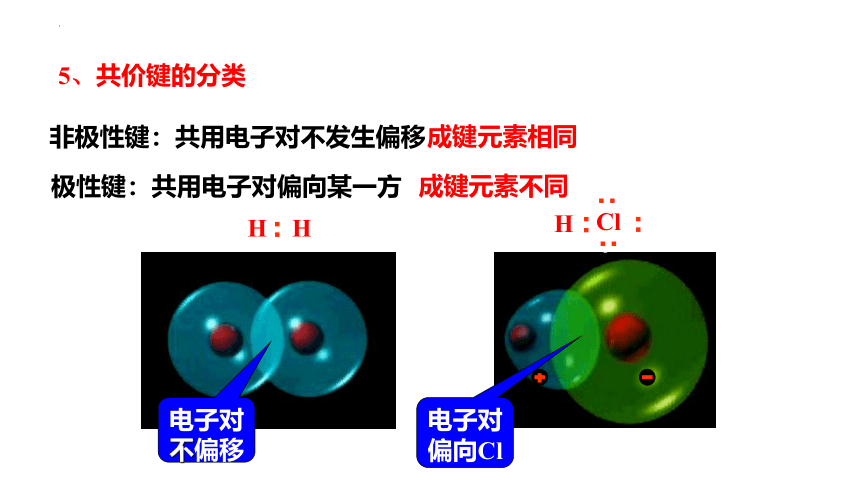
5、共价键的分类
非极性键:共用电子对不发生偏移
电子对不偏移
极性键:共用电子对偏向某一方
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
成键元素相同
成键元素不同
指出下列物质中的共价键类型
O2
CH4
CO2
H2O2
Na2O2
NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
【课堂练习】
用电子式表示共价化合物的形成过程(以HCl为例说明)
电子式
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
分子间作用力
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与相对分子质量的关系
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小 意义
化学键
分子间力
原子间或阴阳离子间
分子之间
作用力大
作用力小
影响化学性质和
物理性质
影响物理性质
(熔沸点等)
分子之间无化学键
为什么HF、H2O和NH3的沸点会反常呢?
思考交流:
一些氢化物的沸点
1、形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
2、氢键能量:比化学键弱很多但比分子间作用力稍强
氢键
3、特征:具有方向性。
键型 离子键 共价键
非极性键 极性键
概念 带相反电荷离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
特点 阴、阳离子间的相互作用 共用电子对不发生偏移 共用电子对偏向吸引电子能力强的原子
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种非金属元素原子 不同种非金属元素的原子
存在 离子化合物 非金属单质,如O2;某些化合物,如Na2O2 共价化合物,如SO2;某些离子化合物,如NaOH
离子化合物 共价化合物
化学键 离子键或离子键与共价键 共价键
概念 由离子键构成的化合物叫离子化合物 以共用电子对形成分子的化合物叫共价化合物
达到稳定结构的途径 通过电子得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
构成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
相互作用 化学键 分子间作用力 氢键
存在范围 相邻原子或离子之间 分子之间 某些含强极性键氢化物分子之间(如HF、H2O、NH3等)
作用力比较 强 很弱 比化学键弱,比分子间作用力强
影响范围 物质的物理性质及化学性质 物质的物理性质 物质的物理性质
化学键、分子间作用力和氢键的比较
1.下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性共价键和非极性共价键的是:( C )
A、K B、Ca C、O D、Ne
2.下列说法正确的是( B )
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、共价化合物中可以有离子键
THANKS
4.3.2 化学键
原子之间通过共用电子对所形成的强烈相互作用,叫共价键
1、共价键定义:
成键微粒:
成键本质:
原子
共用电子对
2、共价键的成键特点
成键条件:
一般由非金属元素形成
3、共价化合物:
不同原子之间以共用电子对形成分子的化合物。
共价键
4、共价键的存在
(1) 共价化合物:
(2) 多原子非金属单质
(3) 含根的离子化合物 :
含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4....
HCl、 CO2 、NH3....
只含有共价键的化合物
5、共价键的分类
非极性键:共用电子对不发生偏移
电子对不偏移
极性键:共用电子对偏向某一方
电子对偏向Cl
Cl
··
··
H
··
··
H H
··
成键元素相同
成键元素不同
指出下列物质中的共价键类型
O2
CH4
CO2
H2O2
Na2O2
NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
【课堂练习】
用电子式表示共价化合物的形成过程(以HCl为例说明)
电子式
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
分子间作用力
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与相对分子质量的关系
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小 意义
化学键
分子间力
原子间或阴阳离子间
分子之间
作用力大
作用力小
影响化学性质和
物理性质
影响物理性质
(熔沸点等)
分子之间无化学键
为什么HF、H2O和NH3的沸点会反常呢?
思考交流:
一些氢化物的沸点
1、形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
2、氢键能量:比化学键弱很多但比分子间作用力稍强
氢键
3、特征:具有方向性。
键型 离子键 共价键
非极性键 极性键
概念 带相反电荷离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
特点 阴、阳离子间的相互作用 共用电子对不发生偏移 共用电子对偏向吸引电子能力强的原子
成键粒子 阴、阳离子 原子
成键条件 活泼金属和活泼非金属 同种非金属元素原子 不同种非金属元素的原子
存在 离子化合物 非金属单质,如O2;某些化合物,如Na2O2 共价化合物,如SO2;某些离子化合物,如NaOH
离子化合物 共价化合物
化学键 离子键或离子键与共价键 共价键
概念 由离子键构成的化合物叫离子化合物 以共用电子对形成分子的化合物叫共价化合物
达到稳定结构的途径 通过电子得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
构成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
相互作用 化学键 分子间作用力 氢键
存在范围 相邻原子或离子之间 分子之间 某些含强极性键氢化物分子之间(如HF、H2O、NH3等)
作用力比较 强 很弱 比化学键弱,比分子间作用力强
影响范围 物质的物理性质及化学性质 物质的物理性质 物质的物理性质
化学键、分子间作用力和氢键的比较
1.下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性共价键和非极性共价键的是:( C )
A、K B、Ca C、O D、Ne
2.下列说法正确的是( B )
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物
D、共价化合物中可以有离子键
THANKS
