全方位教学辅导教案第九单元课题3上课教案与同步练习
文档属性
| 名称 | 全方位教学辅导教案第九单元课题3上课教案与同步练习 |  | |
| 格式 | zip | ||
| 文件大小 | 241.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-09 21:58:01 | ||
图片预览




文档简介
全方位教学辅导教案
学科:化学 任课教师:黄贵鑫 授课时间:2014年 月 日 星期: 档案号 :
姓 名 性 别 年 级 初三 第 次课
教 学内 容 第九单元课题3溶液的浓度
重 点难 点 溶质质量分数的简单计算;配制一定溶质质量分数的溶液误差分析
教 学目 标 记住溶质的质量分数的定义,熟练掌握有关溶质质量分数的计算,并会运用计算配制溶液。
教学过程 课前检查与交流 作业完成情况:交流 与 沟通:
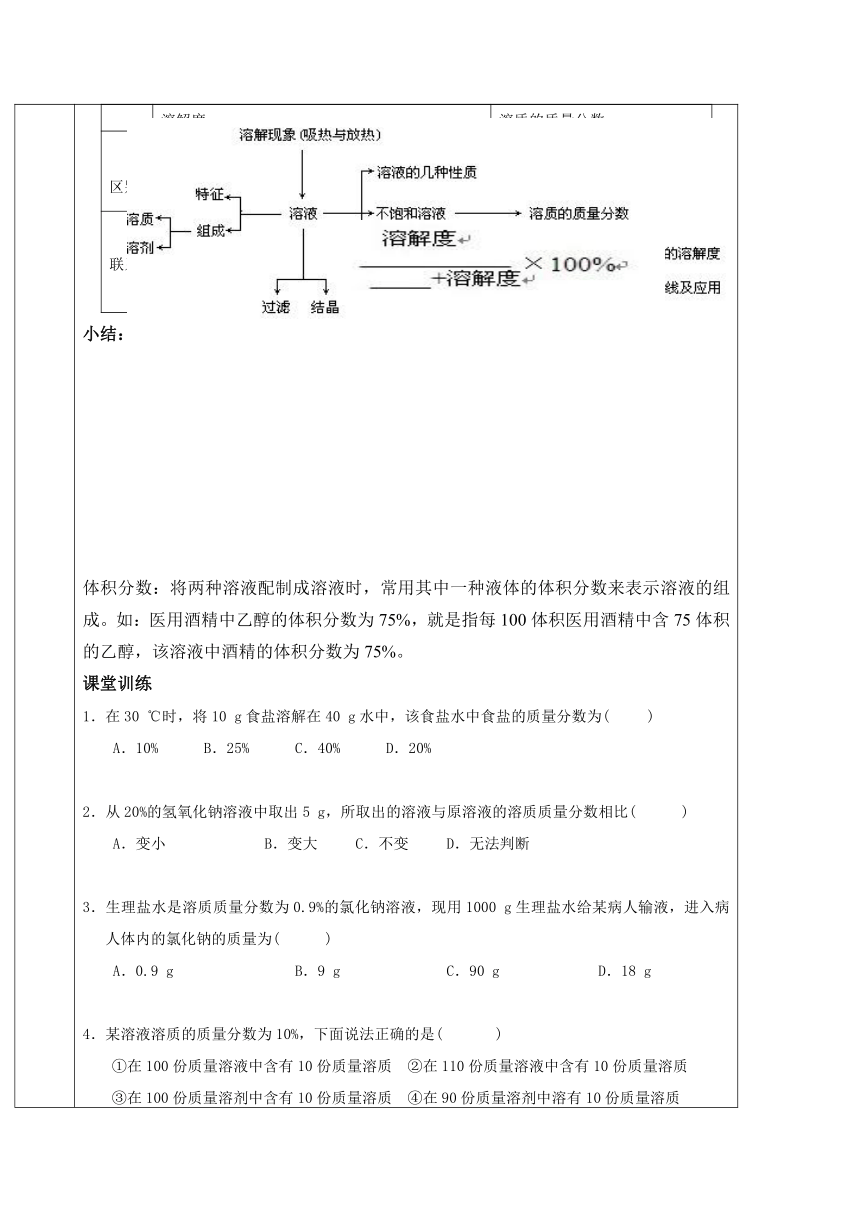
课题3溶质的质量分数课前训练1.如果物质以不溶的固体 颗粒分散在水中,则形成____________;若物质以________分散在水中则形成乳浊液;若物质以____________或____________的形式均匀分散到另一种物质的过程,叫做物质的溶解。物质溶解后形成的__ _____、__ ___的混合物叫做溶液。2.下列叙述中,正确的是( )A.悬浊液、乳浊液、溶液都是混合物B.溶液里溶质只能有一种C.溶质可以是固体、液体、气体,但溶剂只能是液体D.透明、澄清的液体都是溶液3.根据你的经验判断,把少量的下列物质分别放入水中,充分搅拌后完全消失的是( )A.面粉 B.白糖 C.植物油 D.粉笔灰4. 硫酸铜溶液的特征是( )A.均一、稳定、无色 B.蓝色、均一、稳定、不透明C.均一、稳定、蓝色、透明 D.浑浊、均一、不透明、不稳定5.下列因素不可能影响固体物质溶解性的是( )A.溶剂的量 B.温度 C.溶质的性质 D.溶剂的性质6.饱和溶液是指( )A.浓度较大的溶液 B.还能继续溶解某种溶质的溶液C.不能再溶解其他溶质的溶液 D.一定温度下,一定量溶剂中不能再溶解某种溶质的溶液7.40 ℃时,200 g硝酸钾饱和溶液,蒸发掉20 g水后,再冷却到40 ℃,则蒸发前后保持不变的是( )①溶液的质量 ②溶液中溶质在溶液中的质量分数 ③溶剂的质量 ④溶质的质量 ⑤硝酸钾的溶解度A.①② B.②③ C.②⑤ D.②④8.下列说法是否正确?正确的,在( )中打“√”,错误的,在( )中打“×”。(1)100 g水溶解了30 g某物质,则该物质的溶解度为30 g( )(2)任何物质的溶解度随温度升高都增大( )(3)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液( )(4)饱和溶液析出晶体后,其溶质在整个溶液中的质量分数一定减小( )(5)温度相同的条件下,同一种物质的饱和溶液比不饱和溶液溶质的质量分数要大一些( )9.若要从饱和的氯化钠溶液中获得较多的晶体,下列方法中,你认为最合理的是( )A.升高溶液的温度 B.蒸发溶剂C.降低溶液的温度 D.从溶液中倒掉一部分水10、如下图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )A.浓硫酸 B.氢氧化钠固体 C.蔗糖固体 D.氧化钙固体1l.动物摄取食物养料必须通过消化的主要原因是( )A.使食物充分发生化学反应B.食物分解后便于吸收C.食物被消化后变成溶液才便于充分吸收D.食物搅拌均匀后便于吸收12. 在一定的温度下,将下列物质足量混合并充分搅拌,其中肯定不能形成饱和溶液的是( )A.氯化钠和水 B.硫酸钡和水 C.氢氧化钙 D.酒精和水课题三 溶液的浓度一、溶质的质量分数1、含义和公式 含义:溶液中溶质质量和溶液质量之比。公式: 溶质质量分数= × 100%注意:溶质质量分数的计算必须在溶质的溶解度范围内才有意义溶液质量=溶质质量+溶剂质量=溶液体积×溶液密度2、在饱和溶液中: 溶质质量分数C%= × 100%(C < S)对于饱和溶液:恒温蒸发部分水,会有固体析出,所得溶液仍为该温度下的饱和溶液,相同溶质、相同温度下的饱和溶液,溶质的质量分数相等。即饱和溶液的溶质质量分数与温度有关。只要温度不变,质量分数就不变。3、有关溶液稀释的计算:依据:稀释前后溶液中溶质的总质量不变稀释的方法:加入溶剂:计算公式A·a%=B·b% 或A a%=(A+m水) b%(A表示稀释前溶液的质量,a%表示稀释前溶液中溶质的质量分数)(B表示稀释后溶液的质量,b%表示稀释后溶液中溶质的质量分数)加入低浓度的溶液:计算公式A·a%+B·b%=(A+B)·c%(A表示稀释前溶液的质量,a%表示稀释前溶液中溶质的质量分数)(B表示所加入溶液的质量,b%表示所加入的溶液中溶质的质量分数)(c%表示混合后所得溶液中溶质的质量分数)4、有关溶液浓缩的计算:依据:浓缩前后溶液中溶质的总质量不变(实质:蒸发溶剂)了解计算公式:B·b%=(B—m水)·a% (B表示浓缩前溶液的质量,b%表示浓缩前溶质的质量分数)(m水表示浓缩过程中失去水的质量,a%表示浓缩后溶液的质量分数)5、对于反应后所得溶液质量的求法:(1)溶液组成法:溶液质量=溶质质量+溶剂质量 (2)质量守恒法:溶液质量=m反应—m沉淀—m气体(此法较简单常用)(m反应表示反应前物质的总质量,m沉淀表示生成沉淀的质量,m气体表示生成气体的质量)6、配制一定溶质质量分数的溶液(1)用固体配制:①步骤: 、 、 、 ②仪器: 、药匙、量筒、胶头滴管、 、 用托盘天平称量氯化钠时应注意:①称量前先调节天平的平衡②调平衡后,在左右托盘上各放一张同样大小的白纸③遵循“左物右码”的原则读取量筒内液体的体积时,视线应与量筒内液体的凹液面最低处保持水平 或相切注意:若称量易潮解、有腐蚀性的药品时,必须放到玻璃器皿中称量,否则会把托盘腐蚀,造成称量的误差。如:称量氢氧化钠固体,应放在表面皿或小烧杯中。(2)导致溶质的质量分数偏小的原因:I.称量时,称量物和砝码放反了,且使用了游码II.量取水时,仰视读数III.所用的烧杯中含有水等(3)导致溶质的质量分数偏大的原因:I.量取水时俯视读数II.向烧杯中倾倒量取的水时,洒在外面等(4)用浓溶液稀释(稀释前后,溶质的质量不变)①步骤:计算、量取、混匀 ②仪器:量筒、胶头滴管、烧杯、玻璃棒7、溶解度和溶质质量分数的关系: 溶解度溶质的质量分数区别受温度影响不受温度影响指 , 溶剂中最多溶解溶质的质量指溶液中所含 质量分数单位g无单位联系饱和溶液中溶质质量分数= 小结:体积分数:将两种溶液配制成溶液时,常用其中一种液体的体积分数来表示溶液的组成。如:医用酒精中乙醇的体积分数为75%,就是指每100体积医用酒精中含75体积的乙醇,该溶液中酒精的体积分数为75%。课堂训练1.在30 ℃时,将10 g食盐溶解在40 g水中,该食盐水中食盐的质量分数为( )A.10% B.25% C.40% D.20%2.从20%的氢氧化钠溶液中取出5 g,所取出的溶液与原溶液的溶质质量分数相比( )A.变小 B.变大 C.不变 D.无法判断3.生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000 g生理盐水给某病人输液,进入病人体内的氯化钠的质量为( )A.0.9 g B.9 g C.90 g D.18 g4.某溶液溶质的质量分数为10%,下面说法正确的是( )①在100份质量溶液中含有10份质量溶质 ②在110份质量溶液中含有10份质量溶质 ③在100份质量溶剂中含有10份质量溶质 ④在90份质量溶剂中溶有10份质量溶质A.①② B.③④ C.②③ D.①④5.在一定温度下,往某饱和溶液中加入原溶质,此时溶液的溶质质量分数( )A.不变 B.减小 C.增大 D.无法判断6.当溶液被水稀释时,如温度不变,则下列诸量保持不变的是( )A.溶液的质量 B.溶剂的质量 C.溶质的溶解度 D.溶液中溶质的质量分数7.欲使100g 5%的硝酸钠溶液浓度增大到20%,需再加入硝酸钠固体( )A.18.75 g B.19.75 g C.20 g D.25 g8.20 ℃时,将40 g氯化钠放入100 g水中,所配置的溶液溶质质量分数是(20 ℃时NaCl的溶解度为36.0 g)( )A.40% B.28.57% C.36% D.26.47%9、现有一杯25℃的饱和NaNO3溶液,欲改变其溶质质量分数,下列方法可行的是( )A、恒温蒸发部分水 B、升温到90℃ C、加入一定体积的水D、加入一定质量硝酸钠10、配制90g10%的硝酸钾溶液后,再向其中加入10g磷酸钾并搅拌至完全溶解,则所制得溶液中硝酸钾的质量分数是( )A、10% B、19% C、9% D、无法计算11、要配制一定溶质质量分数的食盐溶液,下列操作不影响所配溶液的溶质质量分数的是( )A、游码没有回到零位就开始称量 B、所用烧杯含有少量水C、只在称量食盐的托盘上垫了干净的纸 D、溶解时先把量筒里的水倒入烧杯,后把食盐加入水中12、某种酒精的水溶液中,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为( )A、23% B、46% C、55% D、72%13、下列各项中,前者一定大于后者的是( )A、20℃时KNO3的溶解度,80℃时KNO3的溶解度B、30℃时NaCl不饱和溶液的溶质质量分数,30℃时NaCl饱和溶液的溶质质量分数C、10g镁与足量盐酸反应生成H2的质量,10g铝与足量盐酸反应生成H2的质量D、NaOH溶于水后溶液的温度,NH4NO3溶于水后溶液的温度二、非选择题1.配制溶质质量分数为12%的食盐溶液50 g,一般可用________称取________g食盐,再用________量取________毫升水,倒入已盛有食盐的________中,并用________搅拌即可.2.向50 g溶质质量分数为10%的氢氧化钠溶液里加入10 g氢氧化钠或蒸发掉10 g水,所得溶液的溶质质量分数为________或________.3.100 g 10%的硝酸钾溶液稀释成5%的硝酸钾溶液,需加水________g.4.在某温度下,把某物质Wg完全溶解在水中,制成V毫升饱和溶液,该饱和溶液的密度为d g·cm-3,那么,该溶液的溶质质量分数是________.5.实验室要配制360 g 10%的盐酸,需要36%的浓盐酸________g.6、制作叶脉书签需要100mL质量分数10%的氢氧化钠溶液(密度为1.1g/cm3)(1)配制时需要氢氧化钠固体的质量是_________g,水的质量是__________g(2)若用20%的氢氧化钠溶液和水配制,需要20%氢氧化钠溶液的质量是__________g7、70℃时将36g硝酸钾溶于204g水中,该溶液中溶质的质量分数为__________,将此溶液平均分为三等份。(1)取第一等份,将温度升高到95℃,此时溶质的质量分数_______15%(填“>”、“<”或“=”)(2)取第二等份,欲使溶质的质量分数比原来增加一倍,需加入硝酸钾固体_________g(3)取第三等份,使其溶质的质量分数变为原来的一半,需加入水的质量为_________g
签字 教研组长: 教学主任: 学生: 教务老师: 家长:
老师课后评价 下节课的计划:
学生的状况、接受情况和配合程度:
给家长的建议:
九年级化学第九单元检测题
(试卷总分:70分 考试时间:60分钟)
可能用到的相对原子质量:Ar(H)=1 Ar(O)=16 Ar(S)=32 Ar(Fe)=56
一、本题包括15小题,每题2分,共30分。每小题只有一个选项符合题意。
1.有些游泳池中的水呈蓝色,是因为加入了一种能杀菌消毒的物质。这种物质可能是 ( )
A.硫酸亚铁 B.食盐 C.硫酸铜 D.硫酸铁
2.从100克15%的NaOH溶液中取出20克,将剩余溶液与原溶液进行比较,没有发生改变的是( )
A.溶质的质量分数 B.溶剂的质量 C.溶液的质量 D.溶质的质量
3.下列四个家庭小实验,不能制得溶液的是( )
编号 A B C D
实验内容
4.影响固体物质在溶剂中溶解度大小的因素有( )
①固体溶质的性质 ②温度 ③压强 ④溶质的质量 ⑤溶剂的质量 ⑥溶剂的性质
A.②④⑥ B.①③⑤ C.①④⑤ D.①②⑥
5.配制溶液的过程中,不一定用到的仪器是( )
A.烧杯 B.胶头滴管 C.玻璃棒 D.托盘天平
6.一定质量分数的氯化钠溶液逐渐加水稀释,下列图像符合溶液中溶质质量变化规律的是( )
7.20℃时,某物质在10g水中最多可溶解1.5g,则该物质属于( )
A.易溶 B.可溶 C.微溶 D.难溶
8. 各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣 D.用醋洗去水壶的水垢
9.打开啤酒瓶盖时,你会发现啤酒会自动喷出,喝了啤酒后又常常会打嗝,这说明气体溶解性与外界的压强和温度有关,下列关于气体溶解度说法不正确的是( )
A.压强减少,气体溶解度增大 B.压强减小,气体溶解度减小
C.温度升高,气体溶解度减小 D.温度降低,气体溶解度增大
10.要使如图所示的小气球鼓起来,实验时使用的固体和液体不可能是( )
A.氢氧化钠和水 B. 硝酸铵和水
C. 锌粒和稀硫酸 D. 碳酸钙和稀盐酸
11.如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
12.甲、乙两种固体纯净物的溶解度曲线如图A所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B)。下列说法正确的是( )
A.乙溶液中溶质的质量分数增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲物质的溶解度增大
D.试管里剩余的乙固体增多
13.某温度时,有W克硝酸钾的不饱和溶液,在温度和溶剂质量不变的条件下,向其中逐渐加入硝酸钾固体直至不能溶解,有部分固体剩余。下列图像能正确表示此过程中溶液中溶质的质量分数,溶解度与时间的变化关系的是( )
14.下列有关溶液(固体溶质)的叙述,正确的是( )
A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小
B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大
C.任何物质的饱和溶液,当温度降低时一定会析出溶质
D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小
15.下列条件中的氢氧化钙溶液,质量分数最大的是( )
A.30℃的不饱和溶液 B.30℃的饱和溶液 C.90℃的不饱和溶液 D.90℃的饱和溶液
二、非选择题(第22题3分,第23题5分,其余每空1分,共40分。)
19.填表:写出下列溶液中溶质或溶剂的化学式。
溶质 I2
溶剂 H2O H2O H2O H2O
溶液 澄清石灰水 稀盐酸 碘酒 氯化钠溶液 稀硫酸
20.右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗 (填写
“能” 或“不能”)。在a、b、c三种物质中哪种物质可能是气体? 。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是
(填写物质序号)。
(4)要使得c物质的不饱和溶液转化为饱和溶液的方法有: 、 、 。
(5)若a溶液中混有少量的b物质,提纯a物质的方法是 。
(6)将t2℃时等质量的a、b、c三种物质饱和溶液的温度降低到t1℃时,有较多晶体析出的物质是 ,有较少晶体析出的物质是 ,没有晶体析出的物质是 。
(7)t1℃时a、c两种物质的饱和溶液中含有溶质的质量相等吗? (填写“相等”、“不相等” 或“不相等”,下同),溶质质量分数相等吗? 。
(8)在t2℃时,将等质量的a、b、c三种物质分别加到100g水中,充分搅拌后,只得到一种饱和溶液,该饱和溶液的溶质是 。
(9)在t2℃时,用质量相同的a、b、c三种物质分别配制饱和溶液,所得饱和溶液中,质量最大的是 。
(10)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
A.c>a=b B.a=b>c C.a>b>c D.b>a>c
21.下图是某同学配制100g溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上述图示的序号表示配制溶液的操作顺序___________________。
(2)指出图中的一处错误操作_________________________________________。
上述错误改正后,请继续完成以下题目:
(3)②操作中应称氯化钠的质量是______________g,称量时若指针偏右,应进行的操作是____________________________。
(4)配制时应选择_______(填“10mL”或“50mL”或“100mL”)的量筒量取_______mL水。
(5)③操作的作用是____________________________。
(6)请在所配制溶液的试剂瓶(见右图)标签上标明相应信息。
(7)如果配制的NaCl溶液中NaCl的质量分数小于10%,则可能造成误差的原因有(至少举出三点):
①___________________________;②____________________________;③___________________________;
若NaCl的质量分数大于10%,则可能造成误差的原因有____________________________ (答出一点即可)。
22.实验室欲配制质量分数为20%的稀硫酸(克/厘米3)500毫升,需质量分数为98%的浓硫酸( 克/厘米3)和水各多少毫升?
23.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,实验数据如下表:
甲 乙 丙
烧杯+稀硫酸 200g 150g 150g
加入的铁样品 9g 9g 14g
充分反应后,烧杯+剩余物 208.7g 158.7g 163.7g
请你认真分析数据,回答下列问题:
位同学所取的稀硫酸与铁样品恰好完全反应;
计算样品中铁的质量分数;
计算恰恰好完全反应后所得溶液中溶质的质量分数。(烧杯的质量为25.4g;计算结果精确到1%)
第九单元课题3溶质的质量分数
课前练习:
1.细小 悬浊液 小液滴 乳浊液 分子 离子 溶质 溶剂 溶液
2.—6 ABCAD 7.C
8. (1)× (2)× (3)× (4)× (5)√
9—12 BCCB
6、(1)计算、称量、量取、溶解(2)托盘天平、烧杯、玻璃棒
7、一定温度下、100g 溶质 100
巩固练习、1.D 2.C 3.B 4.D 5.A 6.C 7.A 8.D 9、C 10、C 11、D、 12、B 13、D
二、1.托盘天平 6.0 量筒 44 烧杯 玻璃棒
2.25% 12.5%
3.100
4.×100%
5.100
6、(1)11;99 (2)55
7、15% (1)= (2) 17.1 (3)80
九年级化学第九单元检测题 答案
1—5 CABDD 6—10 BABAB 11—15 DADBB
19.Ca(OH)2 HCl C2H5OH NaCl H2SO4
20、(1)t1℃时,a、c的溶解度相等,均为20g
(2)不能 c (3)c、b、a (4)增加溶质、蒸发溶剂、升高温度 (5) 降温结晶
(6) a、b、c (7)相等 相等(8)c(9)a(10)D
21、(1)④②①⑤③ (2)称量物和砝码放反了 (3)10 继续在左盘上添加氯化钠,直至天平平衡了 (4)100mL 90mL (5)搅拌,加快溶解
NaCl溶液
溶质质量分数:10%
(6)
(7).称量时,称量物和砝码放反了,且使用了游码 量取水时,仰视读数 所用的烧杯中含有水
量取水时俯视读数
22.设需质量分数为98%的浓硫酸体积为V
500mL ×1.14g/cm3 × 20%=V × 1.84g/cm3 × 98% 得 V=63.2mL
需要溶质的质量分数为98%的浓硫酸 63.2 mL
需加水的质量=500mL ×1.14g/cm3 -63.2mL ×1.84g/cm3 =453.7g
需加水的体积为453.7 mL
23. (1)乙 (2)设样品中铁的质量为x,生成的FeSO4质量为y 生成氢气的质量150g + 9g-158.7g==0.3g
Fe+H2SO4==FeSO4 + H2↑
56 152 2
x y 0.3g x=8.4g y==22.8g
样品中铁的质量分数为:(8.4g/9g)×100%==93%
溶液中溶质的质量分数:
22.8g/[158.7-25.4g-(9g-8.4g)]×100%==17%
答:(1)乙同学所取用的稀硫酸与铁样品恰好完全反应。
(2)样品中铁的质量分数是93%
(3)恰好完全反应后所得溶液中溶质的质量分数是17%
注:9g-8.4g为样品中杂质的质量,不参与反应,因此必须减去
溶质的质量
溶液的质量
S
100+S
0 t1 t2 温度/℃
溶解度/g
M
N
甲
乙
25
甲
乙
冰水
图A 图B
学科:化学 任课教师:黄贵鑫 授课时间:2014年 月 日 星期: 档案号 :
姓 名 性 别 年 级 初三 第 次课
教 学内 容 第九单元课题3溶液的浓度
重 点难 点 溶质质量分数的简单计算;配制一定溶质质量分数的溶液误差分析
教 学目 标 记住溶质的质量分数的定义,熟练掌握有关溶质质量分数的计算,并会运用计算配制溶液。
教学过程 课前检查与交流 作业完成情况:交流 与 沟通:
课题3溶质的质量分数课前训练1.如果物质以不溶的固体 颗粒分散在水中,则形成____________;若物质以________分散在水中则形成乳浊液;若物质以____________或____________的形式均匀分散到另一种物质的过程,叫做物质的溶解。物质溶解后形成的__ _____、__ ___的混合物叫做溶液。2.下列叙述中,正确的是( )A.悬浊液、乳浊液、溶液都是混合物B.溶液里溶质只能有一种C.溶质可以是固体、液体、气体,但溶剂只能是液体D.透明、澄清的液体都是溶液3.根据你的经验判断,把少量的下列物质分别放入水中,充分搅拌后完全消失的是( )A.面粉 B.白糖 C.植物油 D.粉笔灰4. 硫酸铜溶液的特征是( )A.均一、稳定、无色 B.蓝色、均一、稳定、不透明C.均一、稳定、蓝色、透明 D.浑浊、均一、不透明、不稳定5.下列因素不可能影响固体物质溶解性的是( )A.溶剂的量 B.温度 C.溶质的性质 D.溶剂的性质6.饱和溶液是指( )A.浓度较大的溶液 B.还能继续溶解某种溶质的溶液C.不能再溶解其他溶质的溶液 D.一定温度下,一定量溶剂中不能再溶解某种溶质的溶液7.40 ℃时,200 g硝酸钾饱和溶液,蒸发掉20 g水后,再冷却到40 ℃,则蒸发前后保持不变的是( )①溶液的质量 ②溶液中溶质在溶液中的质量分数 ③溶剂的质量 ④溶质的质量 ⑤硝酸钾的溶解度A.①② B.②③ C.②⑤ D.②④8.下列说法是否正确?正确的,在( )中打“√”,错误的,在( )中打“×”。(1)100 g水溶解了30 g某物质,则该物质的溶解度为30 g( )(2)任何物质的溶解度随温度升高都增大( )(3)饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液( )(4)饱和溶液析出晶体后,其溶质在整个溶液中的质量分数一定减小( )(5)温度相同的条件下,同一种物质的饱和溶液比不饱和溶液溶质的质量分数要大一些( )9.若要从饱和的氯化钠溶液中获得较多的晶体,下列方法中,你认为最合理的是( )A.升高溶液的温度 B.蒸发溶剂C.降低溶液的温度 D.从溶液中倒掉一部分水10、如下图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )A.浓硫酸 B.氢氧化钠固体 C.蔗糖固体 D.氧化钙固体1l.动物摄取食物养料必须通过消化的主要原因是( )A.使食物充分发生化学反应B.食物分解后便于吸收C.食物被消化后变成溶液才便于充分吸收D.食物搅拌均匀后便于吸收12. 在一定的温度下,将下列物质足量混合并充分搅拌,其中肯定不能形成饱和溶液的是( )A.氯化钠和水 B.硫酸钡和水 C.氢氧化钙 D.酒精和水课题三 溶液的浓度一、溶质的质量分数1、含义和公式 含义:溶液中溶质质量和溶液质量之比。公式: 溶质质量分数= × 100%注意:溶质质量分数的计算必须在溶质的溶解度范围内才有意义溶液质量=溶质质量+溶剂质量=溶液体积×溶液密度2、在饱和溶液中: 溶质质量分数C%= × 100%(C < S)对于饱和溶液:恒温蒸发部分水,会有固体析出,所得溶液仍为该温度下的饱和溶液,相同溶质、相同温度下的饱和溶液,溶质的质量分数相等。即饱和溶液的溶质质量分数与温度有关。只要温度不变,质量分数就不变。3、有关溶液稀释的计算:依据:稀释前后溶液中溶质的总质量不变稀释的方法:加入溶剂:计算公式A·a%=B·b% 或A a%=(A+m水) b%(A表示稀释前溶液的质量,a%表示稀释前溶液中溶质的质量分数)(B表示稀释后溶液的质量,b%表示稀释后溶液中溶质的质量分数)加入低浓度的溶液:计算公式A·a%+B·b%=(A+B)·c%(A表示稀释前溶液的质量,a%表示稀释前溶液中溶质的质量分数)(B表示所加入溶液的质量,b%表示所加入的溶液中溶质的质量分数)(c%表示混合后所得溶液中溶质的质量分数)4、有关溶液浓缩的计算:依据:浓缩前后溶液中溶质的总质量不变(实质:蒸发溶剂)了解计算公式:B·b%=(B—m水)·a% (B表示浓缩前溶液的质量,b%表示浓缩前溶质的质量分数)(m水表示浓缩过程中失去水的质量,a%表示浓缩后溶液的质量分数)5、对于反应后所得溶液质量的求法:(1)溶液组成法:溶液质量=溶质质量+溶剂质量 (2)质量守恒法:溶液质量=m反应—m沉淀—m气体(此法较简单常用)(m反应表示反应前物质的总质量,m沉淀表示生成沉淀的质量,m气体表示生成气体的质量)6、配制一定溶质质量分数的溶液(1)用固体配制:①步骤: 、 、 、 ②仪器: 、药匙、量筒、胶头滴管、 、 用托盘天平称量氯化钠时应注意:①称量前先调节天平的平衡②调平衡后,在左右托盘上各放一张同样大小的白纸③遵循“左物右码”的原则读取量筒内液体的体积时,视线应与量筒内液体的凹液面最低处保持水平 或相切注意:若称量易潮解、有腐蚀性的药品时,必须放到玻璃器皿中称量,否则会把托盘腐蚀,造成称量的误差。如:称量氢氧化钠固体,应放在表面皿或小烧杯中。(2)导致溶质的质量分数偏小的原因:I.称量时,称量物和砝码放反了,且使用了游码II.量取水时,仰视读数III.所用的烧杯中含有水等(3)导致溶质的质量分数偏大的原因:I.量取水时俯视读数II.向烧杯中倾倒量取的水时,洒在外面等(4)用浓溶液稀释(稀释前后,溶质的质量不变)①步骤:计算、量取、混匀 ②仪器:量筒、胶头滴管、烧杯、玻璃棒7、溶解度和溶质质量分数的关系: 溶解度溶质的质量分数区别受温度影响不受温度影响指 , 溶剂中最多溶解溶质的质量指溶液中所含 质量分数单位g无单位联系饱和溶液中溶质质量分数= 小结:体积分数:将两种溶液配制成溶液时,常用其中一种液体的体积分数来表示溶液的组成。如:医用酒精中乙醇的体积分数为75%,就是指每100体积医用酒精中含75体积的乙醇,该溶液中酒精的体积分数为75%。课堂训练1.在30 ℃时,将10 g食盐溶解在40 g水中,该食盐水中食盐的质量分数为( )A.10% B.25% C.40% D.20%2.从20%的氢氧化钠溶液中取出5 g,所取出的溶液与原溶液的溶质质量分数相比( )A.变小 B.变大 C.不变 D.无法判断3.生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000 g生理盐水给某病人输液,进入病人体内的氯化钠的质量为( )A.0.9 g B.9 g C.90 g D.18 g4.某溶液溶质的质量分数为10%,下面说法正确的是( )①在100份质量溶液中含有10份质量溶质 ②在110份质量溶液中含有10份质量溶质 ③在100份质量溶剂中含有10份质量溶质 ④在90份质量溶剂中溶有10份质量溶质A.①② B.③④ C.②③ D.①④5.在一定温度下,往某饱和溶液中加入原溶质,此时溶液的溶质质量分数( )A.不变 B.减小 C.增大 D.无法判断6.当溶液被水稀释时,如温度不变,则下列诸量保持不变的是( )A.溶液的质量 B.溶剂的质量 C.溶质的溶解度 D.溶液中溶质的质量分数7.欲使100g 5%的硝酸钠溶液浓度增大到20%,需再加入硝酸钠固体( )A.18.75 g B.19.75 g C.20 g D.25 g8.20 ℃时,将40 g氯化钠放入100 g水中,所配置的溶液溶质质量分数是(20 ℃时NaCl的溶解度为36.0 g)( )A.40% B.28.57% C.36% D.26.47%9、现有一杯25℃的饱和NaNO3溶液,欲改变其溶质质量分数,下列方法可行的是( )A、恒温蒸发部分水 B、升温到90℃ C、加入一定体积的水D、加入一定质量硝酸钠10、配制90g10%的硝酸钾溶液后,再向其中加入10g磷酸钾并搅拌至完全溶解,则所制得溶液中硝酸钾的质量分数是( )A、10% B、19% C、9% D、无法计算11、要配制一定溶质质量分数的食盐溶液,下列操作不影响所配溶液的溶质质量分数的是( )A、游码没有回到零位就开始称量 B、所用烧杯含有少量水C、只在称量食盐的托盘上垫了干净的纸 D、溶解时先把量筒里的水倒入烧杯,后把食盐加入水中12、某种酒精的水溶液中,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为( )A、23% B、46% C、55% D、72%13、下列各项中,前者一定大于后者的是( )A、20℃时KNO3的溶解度,80℃时KNO3的溶解度B、30℃时NaCl不饱和溶液的溶质质量分数,30℃时NaCl饱和溶液的溶质质量分数C、10g镁与足量盐酸反应生成H2的质量,10g铝与足量盐酸反应生成H2的质量D、NaOH溶于水后溶液的温度,NH4NO3溶于水后溶液的温度二、非选择题1.配制溶质质量分数为12%的食盐溶液50 g,一般可用________称取________g食盐,再用________量取________毫升水,倒入已盛有食盐的________中,并用________搅拌即可.2.向50 g溶质质量分数为10%的氢氧化钠溶液里加入10 g氢氧化钠或蒸发掉10 g水,所得溶液的溶质质量分数为________或________.3.100 g 10%的硝酸钾溶液稀释成5%的硝酸钾溶液,需加水________g.4.在某温度下,把某物质Wg完全溶解在水中,制成V毫升饱和溶液,该饱和溶液的密度为d g·cm-3,那么,该溶液的溶质质量分数是________.5.实验室要配制360 g 10%的盐酸,需要36%的浓盐酸________g.6、制作叶脉书签需要100mL质量分数10%的氢氧化钠溶液(密度为1.1g/cm3)(1)配制时需要氢氧化钠固体的质量是_________g,水的质量是__________g(2)若用20%的氢氧化钠溶液和水配制,需要20%氢氧化钠溶液的质量是__________g7、70℃时将36g硝酸钾溶于204g水中,该溶液中溶质的质量分数为__________,将此溶液平均分为三等份。(1)取第一等份,将温度升高到95℃,此时溶质的质量分数_______15%(填“>”、“<”或“=”)(2)取第二等份,欲使溶质的质量分数比原来增加一倍,需加入硝酸钾固体_________g(3)取第三等份,使其溶质的质量分数变为原来的一半,需加入水的质量为_________g
签字 教研组长: 教学主任: 学生: 教务老师: 家长:
老师课后评价 下节课的计划:
学生的状况、接受情况和配合程度:
给家长的建议:
九年级化学第九单元检测题
(试卷总分:70分 考试时间:60分钟)
可能用到的相对原子质量:Ar(H)=1 Ar(O)=16 Ar(S)=32 Ar(Fe)=56
一、本题包括15小题,每题2分,共30分。每小题只有一个选项符合题意。
1.有些游泳池中的水呈蓝色,是因为加入了一种能杀菌消毒的物质。这种物质可能是 ( )
A.硫酸亚铁 B.食盐 C.硫酸铜 D.硫酸铁
2.从100克15%的NaOH溶液中取出20克,将剩余溶液与原溶液进行比较,没有发生改变的是( )
A.溶质的质量分数 B.溶剂的质量 C.溶液的质量 D.溶质的质量
3.下列四个家庭小实验,不能制得溶液的是( )
编号 A B C D
实验内容
4.影响固体物质在溶剂中溶解度大小的因素有( )
①固体溶质的性质 ②温度 ③压强 ④溶质的质量 ⑤溶剂的质量 ⑥溶剂的性质
A.②④⑥ B.①③⑤ C.①④⑤ D.①②⑥
5.配制溶液的过程中,不一定用到的仪器是( )
A.烧杯 B.胶头滴管 C.玻璃棒 D.托盘天平
6.一定质量分数的氯化钠溶液逐渐加水稀释,下列图像符合溶液中溶质质量变化规律的是( )
7.20℃时,某物质在10g水中最多可溶解1.5g,则该物质属于( )
A.易溶 B.可溶 C.微溶 D.难溶
8. 各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用水洗去盘子中的水果渣 D.用醋洗去水壶的水垢
9.打开啤酒瓶盖时,你会发现啤酒会自动喷出,喝了啤酒后又常常会打嗝,这说明气体溶解性与外界的压强和温度有关,下列关于气体溶解度说法不正确的是( )
A.压强减少,气体溶解度增大 B.压强减小,气体溶解度减小
C.温度升高,气体溶解度减小 D.温度降低,气体溶解度增大
10.要使如图所示的小气球鼓起来,实验时使用的固体和液体不可能是( )
A.氢氧化钠和水 B. 硝酸铵和水
C. 锌粒和稀硫酸 D. 碳酸钙和稀盐酸
11.如图为甲、乙两种固体物质在水中的溶解度曲线。下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
12.甲、乙两种固体纯净物的溶解度曲线如图A所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里(图B)。下列说法正确的是( )
A.乙溶液中溶质的质量分数增大
B.装甲溶液的试管中剩余的固体减少
C.试管里甲物质的溶解度增大
D.试管里剩余的乙固体增多
13.某温度时,有W克硝酸钾的不饱和溶液,在温度和溶剂质量不变的条件下,向其中逐渐加入硝酸钾固体直至不能溶解,有部分固体剩余。下列图像能正确表示此过程中溶液中溶质的质量分数,溶解度与时间的变化关系的是( )
14.下列有关溶液(固体溶质)的叙述,正确的是( )
A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小
B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大
C.任何物质的饱和溶液,当温度降低时一定会析出溶质
D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小
15.下列条件中的氢氧化钙溶液,质量分数最大的是( )
A.30℃的不饱和溶液 B.30℃的饱和溶液 C.90℃的不饱和溶液 D.90℃的饱和溶液
二、非选择题(第22题3分,第23题5分,其余每空1分,共40分。)
19.填表:写出下列溶液中溶质或溶剂的化学式。
溶质 I2
溶剂 H2O H2O H2O H2O
溶液 澄清石灰水 稀盐酸 碘酒 氯化钠溶液 稀硫酸
20.右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
(1)P点的含义是 。
(2)t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗 (填写
“能” 或“不能”)。在a、b、c三种物质中哪种物质可能是气体? 。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是
(填写物质序号)。
(4)要使得c物质的不饱和溶液转化为饱和溶液的方法有: 、 、 。
(5)若a溶液中混有少量的b物质,提纯a物质的方法是 。
(6)将t2℃时等质量的a、b、c三种物质饱和溶液的温度降低到t1℃时,有较多晶体析出的物质是 ,有较少晶体析出的物质是 ,没有晶体析出的物质是 。
(7)t1℃时a、c两种物质的饱和溶液中含有溶质的质量相等吗? (填写“相等”、“不相等” 或“不相等”,下同),溶质质量分数相等吗? 。
(8)在t2℃时,将等质量的a、b、c三种物质分别加到100g水中,充分搅拌后,只得到一种饱和溶液,该饱和溶液的溶质是 。
(9)在t2℃时,用质量相同的a、b、c三种物质分别配制饱和溶液,所得饱和溶液中,质量最大的是 。
(10)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。
A.c>a=b B.a=b>c C.a>b>c D.b>a>c
21.下图是某同学配制100g溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上述图示的序号表示配制溶液的操作顺序___________________。
(2)指出图中的一处错误操作_________________________________________。
上述错误改正后,请继续完成以下题目:
(3)②操作中应称氯化钠的质量是______________g,称量时若指针偏右,应进行的操作是____________________________。
(4)配制时应选择_______(填“10mL”或“50mL”或“100mL”)的量筒量取_______mL水。
(5)③操作的作用是____________________________。
(6)请在所配制溶液的试剂瓶(见右图)标签上标明相应信息。
(7)如果配制的NaCl溶液中NaCl的质量分数小于10%,则可能造成误差的原因有(至少举出三点):
①___________________________;②____________________________;③___________________________;
若NaCl的质量分数大于10%,则可能造成误差的原因有____________________________ (答出一点即可)。
22.实验室欲配制质量分数为20%的稀硫酸(克/厘米3)500毫升,需质量分数为98%的浓硫酸( 克/厘米3)和水各多少毫升?
23.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,实验数据如下表:
甲 乙 丙
烧杯+稀硫酸 200g 150g 150g
加入的铁样品 9g 9g 14g
充分反应后,烧杯+剩余物 208.7g 158.7g 163.7g
请你认真分析数据,回答下列问题:
位同学所取的稀硫酸与铁样品恰好完全反应;
计算样品中铁的质量分数;
计算恰恰好完全反应后所得溶液中溶质的质量分数。(烧杯的质量为25.4g;计算结果精确到1%)
第九单元课题3溶质的质量分数
课前练习:
1.细小 悬浊液 小液滴 乳浊液 分子 离子 溶质 溶剂 溶液
2.—6 ABCAD 7.C
8. (1)× (2)× (3)× (4)× (5)√
9—12 BCCB
6、(1)计算、称量、量取、溶解(2)托盘天平、烧杯、玻璃棒
7、一定温度下、100g 溶质 100
巩固练习、1.D 2.C 3.B 4.D 5.A 6.C 7.A 8.D 9、C 10、C 11、D、 12、B 13、D
二、1.托盘天平 6.0 量筒 44 烧杯 玻璃棒
2.25% 12.5%
3.100
4.×100%
5.100
6、(1)11;99 (2)55
7、15% (1)= (2) 17.1 (3)80
九年级化学第九单元检测题 答案
1—5 CABDD 6—10 BABAB 11—15 DADBB
19.Ca(OH)2 HCl C2H5OH NaCl H2SO4
20、(1)t1℃时,a、c的溶解度相等,均为20g
(2)不能 c (3)c、b、a (4)增加溶质、蒸发溶剂、升高温度 (5) 降温结晶
(6) a、b、c (7)相等 相等(8)c(9)a(10)D
21、(1)④②①⑤③ (2)称量物和砝码放反了 (3)10 继续在左盘上添加氯化钠,直至天平平衡了 (4)100mL 90mL (5)搅拌,加快溶解
NaCl溶液
溶质质量分数:10%
(6)
(7).称量时,称量物和砝码放反了,且使用了游码 量取水时,仰视读数 所用的烧杯中含有水
量取水时俯视读数
22.设需质量分数为98%的浓硫酸体积为V
500mL ×1.14g/cm3 × 20%=V × 1.84g/cm3 × 98% 得 V=63.2mL
需要溶质的质量分数为98%的浓硫酸 63.2 mL
需加水的质量=500mL ×1.14g/cm3 -63.2mL ×1.84g/cm3 =453.7g
需加水的体积为453.7 mL
23. (1)乙 (2)设样品中铁的质量为x,生成的FeSO4质量为y 生成氢气的质量150g + 9g-158.7g==0.3g
Fe+H2SO4==FeSO4 + H2↑
56 152 2
x y 0.3g x=8.4g y==22.8g
样品中铁的质量分数为:(8.4g/9g)×100%==93%
溶液中溶质的质量分数:
22.8g/[158.7-25.4g-(9g-8.4g)]×100%==17%
答:(1)乙同学所取用的稀硫酸与铁样品恰好完全反应。
(2)样品中铁的质量分数是93%
(3)恰好完全反应后所得溶液中溶质的质量分数是17%
注:9g-8.4g为样品中杂质的质量,不参与反应,因此必须减去
溶质的质量
溶液的质量
S
100+S
0 t1 t2 温度/℃
溶解度/g
M
N
甲
乙
25
甲
乙
冰水
图A 图B
同课章节目录
