化学人教版(2019)必修第二册5.1硫及其化合物(共66张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1硫及其化合物(共66张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 19:40:24 | ||
图片预览










文档简介
(共66张PPT)
第一节 硫及其化合物
第五章 化工生产中的重要非金属元素
高中人教版新教材(2019)化学必修第二册
教学目标
目 录
1
3
2
教学导入
教学过程
4
课堂小结
5
课堂实践
课后作业
6
(1)掌握硫的存在及物理、化学性质。掌握二氧化硫的物理、化学性质。
(2)认识可逆反应,熟悉常见的漂白原理及其代表物质。
(3)了解浓硫酸的三大特性,能运用氧化还原反应知识理解浓硫酸的氧化性,了解硫酸根离子的检验
(4)根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态硫元素的相互转化。
01教学目标
教学导入
02
在印度尼西亚东部有一座著名的活火山——卡瓦伊真火山,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫黄,这些硫磺被称为“恶魔的黄金”。当地很多青壮年男子冒险去火山口采硫黄矿谋生。
自然界中的硫单质
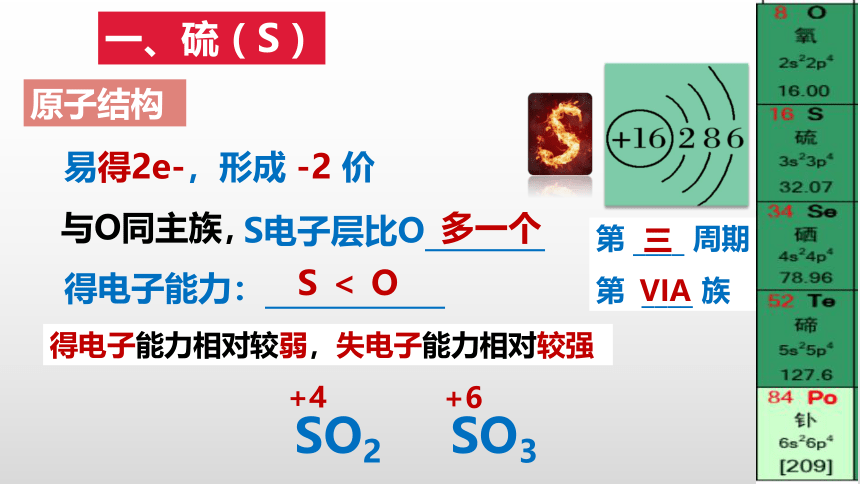
一、硫 ( S )
原子结构
第 ____ 周期
第 ____ 族
VIA
三
易得2e-,形成 -2 价
与O同主族,
S电子层比O________
得电子能力:____________
S < O
多一个
得电子能力相对较弱,失电子能力相对较强
SO2
SO3
+4
+6
一、硫 ( S )
1、存在形式
游离态
地壳岩层
火山喷口附近
化合态
硫铁矿、黄铜矿
石膏
CaSO4·2H2O
2、物理性质
_______晶体,俗称______,质脆,易研成粉末。
_______溶于水,____溶于酒精,______溶于CS2。
可以用CS2来清洗沾有硫的试管。
黄色
硫黄
不
微
易
3、化学性质
硫元素化合价主要有 :-2、0、+4、+6
价态观:
S
2)氧化性:
1)还原性:
S + O2 = SO2
点燃
现象:硫空气中燃烧时发出淡蓝色的火焰,在纯氧中燃烧发出蓝紫色的火焰。
Fe + S =
2Cu + S =
+2
+1
▲
Cu2S
FeS
▲
Hg + S = HgS
(除去有毒Hg的方法)
H2S
SO2
SO3
H2SO4
3)既表现氧化性又表现还原性
与热的浓强碱溶液反应:
S+6NaOH==Na2SO3+2Na2S+3H2O
1、单质硫的氧化性较弱,与变价金属反应时,一般只生成低价金属硫化物(如FeS、Cu2S)
2、置换反应:Na2S+Cl2=2NaCl+S(氧化性Cl2> S 还原性S2- > Cl-)
3、非金属性强弱的比较方法
(1)最高价氧化物对应的水化物的酸性强弱: HClO4>H2SO4
(2)与氢化合的难易程度:Cl2比S易与氢气反应
(3)气态氢化物的稳定性:HCl比H2S稳定
【思考】比较单质硫和氯气氧化性强弱方法?
硫的用途
硫主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
制造黑火药(一硫二硝三木炭):
2KNO3+S+3C===K2S+N2↑+3CO2↑
B
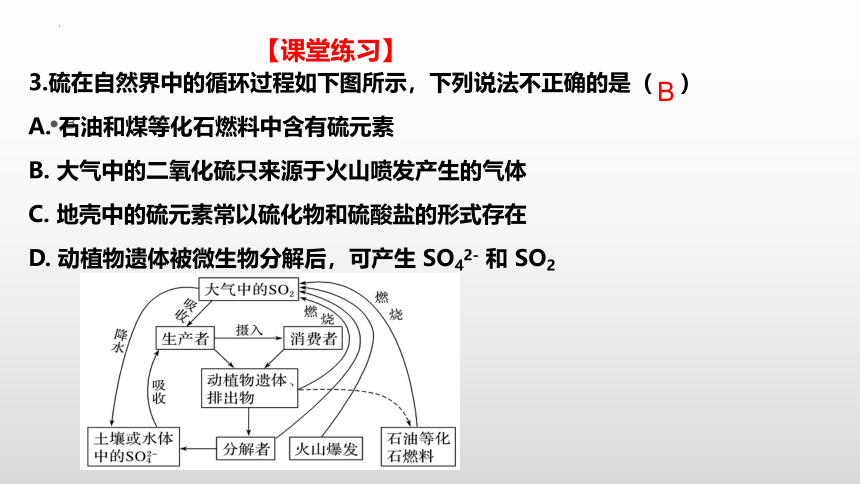
3.硫在自然界中的循环过程如下图所示,下列说法不正确的是( )
A. 石油和煤等化石燃料中含有硫元素
B. 大气中的二氧化硫只来源于火山喷发产生的气体
C. 地壳中的硫元素常以硫化物和硫酸盐的形式存在
D. 动植物遗体被微生物分解后,可产生 SO42- 和 SO2
【课堂练习】
B
SO2
二、二氧化硫(SO2)
1.物理性质
【现象】
【结论】
____色、___________气味的有毒气体,密度比空气的大,容易液化,
_____溶于水
污染环境:形成酸雨
无
有刺激性
易
试管内水位上升,pH试纸变红
SO2易溶于水,水溶液呈酸性
通常1体积水可溶解40体积的SO2。
【实验5-1】
酸性氧化物
SO2的这一性质和哪一种气体相似
从性质上分析,SO2属于哪个类别物质?可能有哪些性质?
+ 碱反应 → 盐 + 水
+ 水反应 → 酸 (部分酸性氧化物)
+ 碱性氧化物 → 盐
【思考】
SO2
CO2
2.化学性质
SO2 + H2O H2SO3
可逆反应!
(亚硫酸)
酸性:H2SO3>CH3COOH>碳酸
1)SO2是酸性氧化物
①酸性氧化物+水→酸
可逆符号
可逆反应:在同一条件下,既能向 方向进行,同时又能向 方向进行的反应,叫做可逆反应。
正反应
逆反应
下列反应不属于可逆反应的是( )
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
电解
点燃
【练习】
B
2NaOH+SO2=Na2SO3 +H2O
Ca(OH)2+SO2=CaSO3 ↓ +H2O
(澄清石灰水变浑浊)
SO2少量:
SO2过量:
NaOH+SO2=NaHSO3
(亚硫酸氢钠)
SO2+ 碱 :
②酸性氧化物+碱→盐+水
③与碱性氧化物反应:
CaSO3+O2=CaSO4
SO2+CaO=CaSO3
——石灰法脱硫
实验室制取SO2,可选择碱液吸收尾气,防止空气污染。
处于中间价态,________________________
标出SO2中S元素的化合价,
推断它应具有怎样的化学性质?
既具有氧化性,又具还原性
氧化性
如:H2S
如:O2、Cl2、Br2、KMnO4、HNO3 等
【思考】
价态观:
SO2
+4
S
H2S
还原性
SO3
+还原剂
+氧化剂
2H2S + SO2 = 3S ↓ + 2H2O
2SO2 + O2 2SO3
催化剂
▲
得4e-
SO2+Cl2+2H2O= H2SO4+2HCl
3)还原性:
(KMnO4 溶液褪色)
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
(氯水褪色)
2.化学性质
2)氧化性:
4)漂白性:
加热后溶液变回红色
生成的无色物质不稳定
(易分解)
品红溶液褪色
检验SO2:品红溶液
可逆!
有些色素 无色物质
加热
SO2
【现象】
【结论】
SO2有漂白作用
1-2滴品红溶液
【实验5-2】
拓展延伸
SO2不能漂白酸碱指示剂,如:SO2使紫色的石蕊试液只变红、不褪色。
SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性而不是漂白性。
SO2的漂白性的理解
漂白原理:SO2与有色物质结合生成了不稳定的无色物质,加热(或见光、长久放置)后,不稳定的无色物质又会发生分解,恢复到原来的颜色。
品红溶液——SO2的漂白性
酸性高锰酸钾溶液——SO2的还原性
新旧草帽
新旧报纸/书本
思考:草帽、纸张为什么会泛黄?
活性炭
【思考】:除了SO2,还有哪些物质具有漂白性?
它们的漂白原理相同吗?
HClO、O3 、 Na2O2、
H2O2 、 Ca(ClO)2
—— 氧化性漂白
SO2
—— 吸附漂白
—— 化合漂白
暂时!
永久!
(物理)
二氧化硫的主要用途
2.漂白纸浆、毛、丝、草帽等
1.
此外,二氧化硫还可以用于杀菌消毒,还是一种食品添加剂。
二氧化硫的危害—酸雨
拓展延伸一
检验SO2和CO2同时存在的方法
品红溶液 酸性KMnO4溶液 品红溶液 澄清石灰水
检验SO2
除掉SO2
检验SO2是否除尽
检验CO2
A中品红溶液褪色,说明混合气体中有SO2
C中品红溶液不褪色,且D中出现浑浊,说明混合气体中有CO2
拓展延伸二
实验室制取SO2的常用原理
三、三氧化硫
2. 化学性质
=H2SO4
= CaSO4+H2O
无色固体,熔点(16.8℃)、沸点(44.8℃ )
1. 物理性质
1) 与水反应:
3) 与碱反应:
SO3+ H2O
SO3 + Ca(OH)2
2) 与碱性氧化物反应:
SO3+ CaO
= CaSO4
酸性氧化物
【课堂练习】
1.指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使酸性高锰酸钾溶液褪色
(5)SO2使紫色石蕊试液变红色
(6)SO2使品红溶液褪色
2SO2 + O2 2 SO3
催化剂
△
还原性
氧化性
还原性
漂白性
还原性
水溶液呈酸性
2.下列说法正确的是( )
A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色,是因为SO2具有漂白性
B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.SO2使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色
D
【课堂练习】
3.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
B
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
【课堂练习】
4.下列关于二氧化硫性质的说法正确的是 ( )
A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性
B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说明二氧化硫具有漂白性
C.二氧化硫既可被氧化也可被还原
D.紫色石蕊试液中通入二氧化硫,溶液先变红后退色
C
【课堂练习】
5.将SO2分别通入下列五种溶液中:
回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____,证明SO2具有____性。
(2)试管②中的实验现象:溶液____,证明SO2具有____性。
(3)试管③中的实验现象:溶液____,证明SO2能中和NaOH,写出该反应的离子方程式:____________________________________________。(4)试管④中能产生____沉淀,该沉淀是______。
(5)试管⑤中能产生白色沉淀,该沉淀是______。
褪色
还原
褪色
漂白
褪色
白色
BaSO3
BaSO4
四、硫 酸
1.用途
化肥
农药
炸药
铅蓄电池
重要的化工原料
①纯净的硫酸是无色、黏稠、难挥发的油状液体
②沸点高:纯硫酸难挥发,沸点338℃。 (高沸点酸)
③密度大:质量分数为98.3%的硫酸的密度为1.84g/cm3
④易溶于水,能以任意比与水混溶,稀释时放出大量的热
2.物理性质
3.工业制硫酸
硫磺
/黄铁矿
SO2
SO3
H2SO4
空气
400~500℃
催化剂 V2O5
98.3%
浓硫酸吸收
燃烧
①制备SO2: _________________________________ 或S+O2===SO2;
②制备SO3:___________________________;
③吸收SO3:___________________________。
4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O===H2SO4
高温
点燃
△
催化剂
===
4.化学性质
稀硫酸的性质----酸的通性
在水里易电离出H+,具有酸性。
H2SO4 = 2H+ + SO42-
【思考与讨论】
硫酸具有酸的哪些共同的性质,
请举例写出相关反应的离子方程式。
酸的通性
① 使指示剂变色:
② + 金属 (H前) :
③ + 碱 反应 :
④ + 碱性氧化物反应:
⑤ + 某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
含CO32-、HCO3-、SO32-、HSO3-
→ 盐 + 氢气
(硝酸除外)
【思考】
酸入水中,杯壁下流,
慢慢倒,不断搅。
浓硫酸应如何稀释?
5.浓硫酸
浓硫酸主要以分子形式存在,所以具有和稀硫酸不同的化学性质。
特征性质
1) 吸水性
蓝色
白色
吸收物质中的水分子,或环境中含有的水分
CuSO4 5H2O
CuSO4
用来干燥中性气体和酸性气体,如 H2、O2、Cl2、CO2、SO2、NO2、NO、HCl等。
不能干燥NH3、H2S、HBr、HI等还原性气体
【用途】
作干燥剂
吸水性属于什么变化?
2) 脱水性
物质本身不含有水分子,而是把物质中的H、O原子按2:1的比例脱去
蔗糖变黑,体积膨胀,形成海绵状炭,有刺激性气体产生
【现象】
浓硫酸
(含C、H、O等)
有机物
将H、O按H2O组成比脱去
脱水(炭化)
【思考与讨论】
实验室制取氢气时,往往用稀硫酸和金属反应,而不用浓硫酸,这是为什么?
常温下,Fe、Al等少数金属遇浓硫酸发生钝化,生成一层致密的金属氧化膜,使反应不能继续进行,因此生活中可以用铁槽车或铝槽车运输浓硫酸。
加热时,浓硫酸可以与除金、铂之外的金属发生氧化还原反应。
3) 强氧化性
① 与金属反应
Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
△
作用: 吸收SO2
品红褪色,
石蕊溶液变红;
倾斜的试管中溶液稀释后呈蓝色
【现象】
浓硫酸
C
2H2SO4 (浓) + C = CO2↑+ 2H2O + 2SO2 ↑
△
② 与某些非金属反应
检验H2O:变蓝
检验SO2
除去SO2
证明SO2已除尽
检验CO2
【课前思考】
如何检验硫酸根离子?
五、硫酸根离子的检验
1.硫酸根离子的检验
【实验5-4】 在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验 操作
实验 操作
实验 现象 先______________,加入盐酸后_____ 先_____________,加入盐酸后___ 先_____________,加入盐酸后______
实验 结论 与Ba2+生反应成不溶于盐酸的_________,离子方程式_________ 与Ba2+反应生成白色沉淀BaCO3,可溶于盐酸
生成白色沉淀
沉淀不溶解
白色沉淀
SO42- +Ba2+=BaSO4↓
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且产生气泡
CO32-
【小结】
(1)检验方法:
被检液 取清液 有无白色沉淀(判断有无 )
先加稀盐酸的目的是排除: CO32- 、SO32- 、Ag+干扰
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
【思考】检验溶液中是否含有SO42-时,可以用稀硫酸或稀硝酸酸化吗
不可以用稀硫酸或稀硝酸酸化,因为若用稀硫酸酸化会引入SO42-,若用稀硝酸酸化,硝酸具有强氧化性,会将SO32-氧化成SO42-,无法排除SO32的干扰。
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
【思考交流】
粗盐
主要成分
杂质
NaCl
难溶性杂质
可溶性杂质
Na2SO4
MaCl2
CaCl2
泥沙
过滤法
化学沉淀法
——粗盐的提纯
经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性
杂质:CaCl2、MgCl2、硫酸盐等。
按下表顺序除去它们,应加入什么试剂?写出离子方程式。
杂质 加入试剂 离子方程式
硫酸盐
MgCl2
CaCl2
NaOH
Mg2+ +2OH-=Mg(OH)2 ↓
Na2CO3
Ca2+ +CO32- = CaCO3↓
过量的
过量的
过量的
BaCl2
Ba2+ + SO42- = BaSO4↓
【思考与讨论】
1)加入除杂试剂后,有没有引入其他离子?用什么方法可以除去?
杂质 加入试剂 引入的离子 除去方法
硫酸盐
MgCl2
CaCl2
NaOH
Na2CO3
过量的
过量的
过量的
BaCl2
2)设计除杂方案时,除了考虑所加试剂种类,还要考虑哪些问题?
粗盐主要成分:NaCl
CO3 2-
OH -
Ba 2+
Na2CO3
HCl
HCl
沉淀法、气化法、水化法
自然界中有丰富的含硫元素物质,如下图
资料卡片
六、不同价态含硫物质的转化
单质硫的存在
火山喷口附近、地壳的岩层内
化合态的硫
黄铜矿 CuFeS2
黄铁矿 FeS2
石膏CaSO4·2H2O
芒硝Na2SO4·10H2O
蓝矾CuSO4·5H2O
物质类别
氢化物
氧化物
酸
盐
Na2SO4 10H2O
CuFeS2
Na2SO3
S
化合价
0
+4
+6
-2
单质
CaSO4 2H2O
将上面出现的含硫物质,填入下列“价—类”二维图中
—
—
—
SO2
H2SO4
SO3
H2SO3
—
—
H2S
写出上述转化的化学方程式:
①__________________________
②____________________
③____________________
④_______________
SO3+H2O===H2SO4
硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
氧化性
还原性
还原性
氧化性
实现不同价态硫元素间的相互转化依据是什么?
-2
o
+4
+6
S S S S
O2 、 Cl2(氯水)、 H2O2、 HNO3、KMnO4、 溴水等
氧化剂:
化合价升高,选用
化合价降低,选用
_氧化剂
_还原剂_
思维建模
还原剂:
H2 、Na、 Fe、Cu、 H2S(S2-)等
硫及其化合物之间的转化规律
(1)邻位价态原则 当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,如
(2)相邻价态的粒子不发生氧化还原反应:
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(3)归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2H2S+SO2===3S+2H2O,
2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
04 课堂小结
3.三氧化硫
1.硫
2.二氧化硫
4.硫酸
5.硫酸根离子的检验
6.不同价态含硫物质的转化
05 课后作业
必做题:
课本P10第1、2、3、4题
选做题:
课本P10第5、6、7题
第一节 硫及其化合物
第五章 化工生产中的重要非金属元素
高中人教版新教材(2019)化学必修第二册
教学目标
目 录
1
3
2
教学导入
教学过程
4
课堂小结
5
课堂实践
课后作业
6
(1)掌握硫的存在及物理、化学性质。掌握二氧化硫的物理、化学性质。
(2)认识可逆反应,熟悉常见的漂白原理及其代表物质。
(3)了解浓硫酸的三大特性,能运用氧化还原反应知识理解浓硫酸的氧化性,了解硫酸根离子的检验
(4)根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态硫元素的相互转化。
01教学目标
教学导入
02
在印度尼西亚东部有一座著名的活火山——卡瓦伊真火山,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫黄,这些硫磺被称为“恶魔的黄金”。当地很多青壮年男子冒险去火山口采硫黄矿谋生。
自然界中的硫单质
一、硫 ( S )
原子结构
第 ____ 周期
第 ____ 族
VIA
三
易得2e-,形成 -2 价
与O同主族,
S电子层比O________
得电子能力:____________
S < O
多一个
得电子能力相对较弱,失电子能力相对较强
SO2
SO3
+4
+6
一、硫 ( S )
1、存在形式
游离态
地壳岩层
火山喷口附近
化合态
硫铁矿、黄铜矿
石膏
CaSO4·2H2O
2、物理性质
_______晶体,俗称______,质脆,易研成粉末。
_______溶于水,____溶于酒精,______溶于CS2。
可以用CS2来清洗沾有硫的试管。
黄色
硫黄
不
微
易
3、化学性质
硫元素化合价主要有 :-2、0、+4、+6
价态观:
S
2)氧化性:
1)还原性:
S + O2 = SO2
点燃
现象:硫空气中燃烧时发出淡蓝色的火焰,在纯氧中燃烧发出蓝紫色的火焰。
Fe + S =
2Cu + S =
+2
+1
▲
Cu2S
FeS
▲
Hg + S = HgS
(除去有毒Hg的方法)
H2S
SO2
SO3
H2SO4
3)既表现氧化性又表现还原性
与热的浓强碱溶液反应:
S+6NaOH==Na2SO3+2Na2S+3H2O
1、单质硫的氧化性较弱,与变价金属反应时,一般只生成低价金属硫化物(如FeS、Cu2S)
2、置换反应:Na2S+Cl2=2NaCl+S(氧化性Cl2> S 还原性S2- > Cl-)
3、非金属性强弱的比较方法
(1)最高价氧化物对应的水化物的酸性强弱: HClO4>H2SO4
(2)与氢化合的难易程度:Cl2比S易与氢气反应
(3)气态氢化物的稳定性:HCl比H2S稳定
【思考】比较单质硫和氯气氧化性强弱方法?
硫的用途
硫主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
制造黑火药(一硫二硝三木炭):
2KNO3+S+3C===K2S+N2↑+3CO2↑
B
3.硫在自然界中的循环过程如下图所示,下列说法不正确的是( )
A. 石油和煤等化石燃料中含有硫元素
B. 大气中的二氧化硫只来源于火山喷发产生的气体
C. 地壳中的硫元素常以硫化物和硫酸盐的形式存在
D. 动植物遗体被微生物分解后,可产生 SO42- 和 SO2
【课堂练习】
B
SO2
二、二氧化硫(SO2)
1.物理性质
【现象】
【结论】
____色、___________气味的有毒气体,密度比空气的大,容易液化,
_____溶于水
污染环境:形成酸雨
无
有刺激性
易
试管内水位上升,pH试纸变红
SO2易溶于水,水溶液呈酸性
通常1体积水可溶解40体积的SO2。
【实验5-1】
酸性氧化物
SO2的这一性质和哪一种气体相似
从性质上分析,SO2属于哪个类别物质?可能有哪些性质?
+ 碱反应 → 盐 + 水
+ 水反应 → 酸 (部分酸性氧化物)
+ 碱性氧化物 → 盐
【思考】
SO2
CO2
2.化学性质
SO2 + H2O H2SO3
可逆反应!
(亚硫酸)
酸性:H2SO3>CH3COOH>碳酸
1)SO2是酸性氧化物
①酸性氧化物+水→酸
可逆符号
可逆反应:在同一条件下,既能向 方向进行,同时又能向 方向进行的反应,叫做可逆反应。
正反应
逆反应
下列反应不属于可逆反应的是( )
A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
电解
点燃
【练习】
B
2NaOH+SO2=Na2SO3 +H2O
Ca(OH)2+SO2=CaSO3 ↓ +H2O
(澄清石灰水变浑浊)
SO2少量:
SO2过量:
NaOH+SO2=NaHSO3
(亚硫酸氢钠)
SO2+ 碱 :
②酸性氧化物+碱→盐+水
③与碱性氧化物反应:
CaSO3+O2=CaSO4
SO2+CaO=CaSO3
——石灰法脱硫
实验室制取SO2,可选择碱液吸收尾气,防止空气污染。
处于中间价态,________________________
标出SO2中S元素的化合价,
推断它应具有怎样的化学性质?
既具有氧化性,又具还原性
氧化性
如:H2S
如:O2、Cl2、Br2、KMnO4、HNO3 等
【思考】
价态观:
SO2
+4
S
H2S
还原性
SO3
+还原剂
+氧化剂
2H2S + SO2 = 3S ↓ + 2H2O
2SO2 + O2 2SO3
催化剂
▲
得4e-
SO2+Cl2+2H2O= H2SO4+2HCl
3)还原性:
(KMnO4 溶液褪色)
5SO2+2KMnO4+2H2O =K2SO4 +2MnSO4+2H2SO4
(氯水褪色)
2.化学性质
2)氧化性:
4)漂白性:
加热后溶液变回红色
生成的无色物质不稳定
(易分解)
品红溶液褪色
检验SO2:品红溶液
可逆!
有些色素 无色物质
加热
SO2
【现象】
【结论】
SO2有漂白作用
1-2滴品红溶液
【实验5-2】
拓展延伸
SO2不能漂白酸碱指示剂,如:SO2使紫色的石蕊试液只变红、不褪色。
SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性而不是漂白性。
SO2的漂白性的理解
漂白原理:SO2与有色物质结合生成了不稳定的无色物质,加热(或见光、长久放置)后,不稳定的无色物质又会发生分解,恢复到原来的颜色。
品红溶液——SO2的漂白性
酸性高锰酸钾溶液——SO2的还原性
新旧草帽
新旧报纸/书本
思考:草帽、纸张为什么会泛黄?
活性炭
【思考】:除了SO2,还有哪些物质具有漂白性?
它们的漂白原理相同吗?
HClO、O3 、 Na2O2、
H2O2 、 Ca(ClO)2
—— 氧化性漂白
SO2
—— 吸附漂白
—— 化合漂白
暂时!
永久!
(物理)
二氧化硫的主要用途
2.漂白纸浆、毛、丝、草帽等
1.
此外,二氧化硫还可以用于杀菌消毒,还是一种食品添加剂。
二氧化硫的危害—酸雨
拓展延伸一
检验SO2和CO2同时存在的方法
品红溶液 酸性KMnO4溶液 品红溶液 澄清石灰水
检验SO2
除掉SO2
检验SO2是否除尽
检验CO2
A中品红溶液褪色,说明混合气体中有SO2
C中品红溶液不褪色,且D中出现浑浊,说明混合气体中有CO2
拓展延伸二
实验室制取SO2的常用原理
三、三氧化硫
2. 化学性质
=H2SO4
= CaSO4+H2O
无色固体,熔点(16.8℃)、沸点(44.8℃ )
1. 物理性质
1) 与水反应:
3) 与碱反应:
SO3+ H2O
SO3 + Ca(OH)2
2) 与碱性氧化物反应:
SO3+ CaO
= CaSO4
酸性氧化物
【课堂练习】
1.指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使酸性高锰酸钾溶液褪色
(5)SO2使紫色石蕊试液变红色
(6)SO2使品红溶液褪色
2SO2 + O2 2 SO3
催化剂
△
还原性
氧化性
还原性
漂白性
还原性
水溶液呈酸性
2.下列说法正确的是( )
A.SO2能使品红溶液、溴水和酸性KMnO4溶液褪色,是因为SO2具有漂白性
B.SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白效果
C.活性炭使有色物质褪色是利用了碳单质的还原性,使有色物质发生了还原反应
D.SO2使品红溶液褪色后,将褪色后的溶液加热,溶液重新变为红色
D
【课堂练习】
3.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
B
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
【课堂练习】
4.下列关于二氧化硫性质的说法正确的是 ( )
A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性
B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说明二氧化硫具有漂白性
C.二氧化硫既可被氧化也可被还原
D.紫色石蕊试液中通入二氧化硫,溶液先变红后退色
C
【课堂练习】
5.将SO2分别通入下列五种溶液中:
回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____,证明SO2具有____性。
(2)试管②中的实验现象:溶液____,证明SO2具有____性。
(3)试管③中的实验现象:溶液____,证明SO2能中和NaOH,写出该反应的离子方程式:____________________________________________。(4)试管④中能产生____沉淀,该沉淀是______。
(5)试管⑤中能产生白色沉淀,该沉淀是______。
褪色
还原
褪色
漂白
褪色
白色
BaSO3
BaSO4
四、硫 酸
1.用途
化肥
农药
炸药
铅蓄电池
重要的化工原料
①纯净的硫酸是无色、黏稠、难挥发的油状液体
②沸点高:纯硫酸难挥发,沸点338℃。 (高沸点酸)
③密度大:质量分数为98.3%的硫酸的密度为1.84g/cm3
④易溶于水,能以任意比与水混溶,稀释时放出大量的热
2.物理性质
3.工业制硫酸
硫磺
/黄铁矿
SO2
SO3
H2SO4
空气
400~500℃
催化剂 V2O5
98.3%
浓硫酸吸收
燃烧
①制备SO2: _________________________________ 或S+O2===SO2;
②制备SO3:___________________________;
③吸收SO3:___________________________。
4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O===H2SO4
高温
点燃
△
催化剂
===
4.化学性质
稀硫酸的性质----酸的通性
在水里易电离出H+,具有酸性。
H2SO4 = 2H+ + SO42-
【思考与讨论】
硫酸具有酸的哪些共同的性质,
请举例写出相关反应的离子方程式。
酸的通性
① 使指示剂变色:
② + 金属 (H前) :
③ + 碱 反应 :
④ + 碱性氧化物反应:
⑤ + 某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
含CO32-、HCO3-、SO32-、HSO3-
→ 盐 + 氢气
(硝酸除外)
【思考】
酸入水中,杯壁下流,
慢慢倒,不断搅。
浓硫酸应如何稀释?
5.浓硫酸
浓硫酸主要以分子形式存在,所以具有和稀硫酸不同的化学性质。
特征性质
1) 吸水性
蓝色
白色
吸收物质中的水分子,或环境中含有的水分
CuSO4 5H2O
CuSO4
用来干燥中性气体和酸性气体,如 H2、O2、Cl2、CO2、SO2、NO2、NO、HCl等。
不能干燥NH3、H2S、HBr、HI等还原性气体
【用途】
作干燥剂
吸水性属于什么变化?
2) 脱水性
物质本身不含有水分子,而是把物质中的H、O原子按2:1的比例脱去
蔗糖变黑,体积膨胀,形成海绵状炭,有刺激性气体产生
【现象】
浓硫酸
(含C、H、O等)
有机物
将H、O按H2O组成比脱去
脱水(炭化)
【思考与讨论】
实验室制取氢气时,往往用稀硫酸和金属反应,而不用浓硫酸,这是为什么?
常温下,Fe、Al等少数金属遇浓硫酸发生钝化,生成一层致密的金属氧化膜,使反应不能继续进行,因此生活中可以用铁槽车或铝槽车运输浓硫酸。
加热时,浓硫酸可以与除金、铂之外的金属发生氧化还原反应。
3) 强氧化性
① 与金属反应
Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
△
作用: 吸收SO2
品红褪色,
石蕊溶液变红;
倾斜的试管中溶液稀释后呈蓝色
【现象】
浓硫酸
C
2H2SO4 (浓) + C = CO2↑+ 2H2O + 2SO2 ↑
△
② 与某些非金属反应
检验H2O:变蓝
检验SO2
除去SO2
证明SO2已除尽
检验CO2
【课前思考】
如何检验硫酸根离子?
五、硫酸根离子的检验
1.硫酸根离子的检验
【实验5-4】 在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验 操作
实验 操作
实验 现象 先______________,加入盐酸后_____ 先_____________,加入盐酸后___ 先_____________,加入盐酸后______
实验 结论 与Ba2+生反应成不溶于盐酸的_________,离子方程式_________ 与Ba2+反应生成白色沉淀BaCO3,可溶于盐酸
生成白色沉淀
沉淀不溶解
白色沉淀
SO42- +Ba2+=BaSO4↓
生成白色沉淀
沉淀不溶解
生成白色沉淀
沉淀溶解,且产生气泡
CO32-
【小结】
(1)检验方法:
被检液 取清液 有无白色沉淀(判断有无 )
先加稀盐酸的目的是排除: CO32- 、SO32- 、Ag+干扰
总结:
离子的检验步骤:取×××溶液少量于试管中,加入×××,有(或无)×××现象,则证明有(或无)某离子
【思考】检验溶液中是否含有SO42-时,可以用稀硫酸或稀硝酸酸化吗
不可以用稀硫酸或稀硝酸酸化,因为若用稀硫酸酸化会引入SO42-,若用稀硝酸酸化,硝酸具有强氧化性,会将SO32-氧化成SO42-,无法排除SO32的干扰。
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
【思考交流】
粗盐
主要成分
杂质
NaCl
难溶性杂质
可溶性杂质
Na2SO4
MaCl2
CaCl2
泥沙
过滤法
化学沉淀法
——粗盐的提纯
经溶解、过滤、蒸发操作得到的粗盐中含有一些可溶性
杂质:CaCl2、MgCl2、硫酸盐等。
按下表顺序除去它们,应加入什么试剂?写出离子方程式。
杂质 加入试剂 离子方程式
硫酸盐
MgCl2
CaCl2
NaOH
Mg2+ +2OH-=Mg(OH)2 ↓
Na2CO3
Ca2+ +CO32- = CaCO3↓
过量的
过量的
过量的
BaCl2
Ba2+ + SO42- = BaSO4↓
【思考与讨论】
1)加入除杂试剂后,有没有引入其他离子?用什么方法可以除去?
杂质 加入试剂 引入的离子 除去方法
硫酸盐
MgCl2
CaCl2
NaOH
Na2CO3
过量的
过量的
过量的
BaCl2
2)设计除杂方案时,除了考虑所加试剂种类,还要考虑哪些问题?
粗盐主要成分:NaCl
CO3 2-
OH -
Ba 2+
Na2CO3
HCl
HCl
沉淀法、气化法、水化法
自然界中有丰富的含硫元素物质,如下图
资料卡片
六、不同价态含硫物质的转化
单质硫的存在
火山喷口附近、地壳的岩层内
化合态的硫
黄铜矿 CuFeS2
黄铁矿 FeS2
石膏CaSO4·2H2O
芒硝Na2SO4·10H2O
蓝矾CuSO4·5H2O
物质类别
氢化物
氧化物
酸
盐
Na2SO4 10H2O
CuFeS2
Na2SO3
S
化合价
0
+4
+6
-2
单质
CaSO4 2H2O
将上面出现的含硫物质,填入下列“价—类”二维图中
—
—
—
SO2
H2SO4
SO3
H2SO3
—
—
H2S
写出上述转化的化学方程式:
①__________________________
②____________________
③____________________
④_______________
SO3+H2O===H2SO4
硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
氧化性
还原性
还原性
氧化性
实现不同价态硫元素间的相互转化依据是什么?
-2
o
+4
+6
S S S S
O2 、 Cl2(氯水)、 H2O2、 HNO3、KMnO4、 溴水等
氧化剂:
化合价升高,选用
化合价降低,选用
_氧化剂
_还原剂_
思维建模
还原剂:
H2 、Na、 Fe、Cu、 H2S(S2-)等
硫及其化合物之间的转化规律
(1)邻位价态原则 当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,如
(2)相邻价态的粒子不发生氧化还原反应:
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(3)归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2H2S+SO2===3S+2H2O,
2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
04 课堂小结
3.三氧化硫
1.硫
2.二氧化硫
4.硫酸
5.硫酸根离子的检验
6.不同价态含硫物质的转化
05 课后作业
必做题:
课本P10第1、2、3、4题
选做题:
课本P10第5、6、7题
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
