山东省济南市高新区2022-2023学年九年级上学期期末化学试题(B卷)(含答案)
文档属性
| 名称 | 山东省济南市高新区2022-2023学年九年级上学期期末化学试题(B卷)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-30 23:01:00 | ||
图片预览




文档简介
2022 至 2023 学年度第一学期高新区期末学业水平测试
九年级化学试题(先做卷二)
本试题共 8 页,分选择题部分和非选择题部分,选择题部分 40 分,非选择题部分60 分,全卷满分 100 分,考试用时 60 分钟。
答题前,请考生务必将自己的姓名、座号、准考证号写在答题卡的规定位置,并同时将考点、姓名、准考证号、座号写在试题的规定位置。
答题时,选择题部分每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。非选择题部分,用 0.5 毫米黑色签字笔在答题卡上题号所提示的答题区域作答。直接在试题上作答无效。
本考试不允许使用计算器。考试结束后,将本试题和答题卡一并交回。
可能用到的相对原子质量:H 1 He 4 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 I 127 Ba 137
选择题部分 共 40 分
一、单项选择题(本大题共 10 小题,每小题 2 分,共 20 分。每小题给出的四个选项中,
只有一个选项最符合题目的要求)
1.世界万物是在不断变化的。下列过程中,不涉及化学变化的是
A.冶炼金属 B.雕刻玉石
C.钢铁生锈 D.酸碱中和
2.下列有关生活、生产常识的说法中,正确的是
A.室内养花可以防止煤气中毒 B.铵态氮肥可与碱性物质混用
C.食品包装袋中充入氨气可延长保质期 D.大量摄入可溶性钡盐会导致中毒
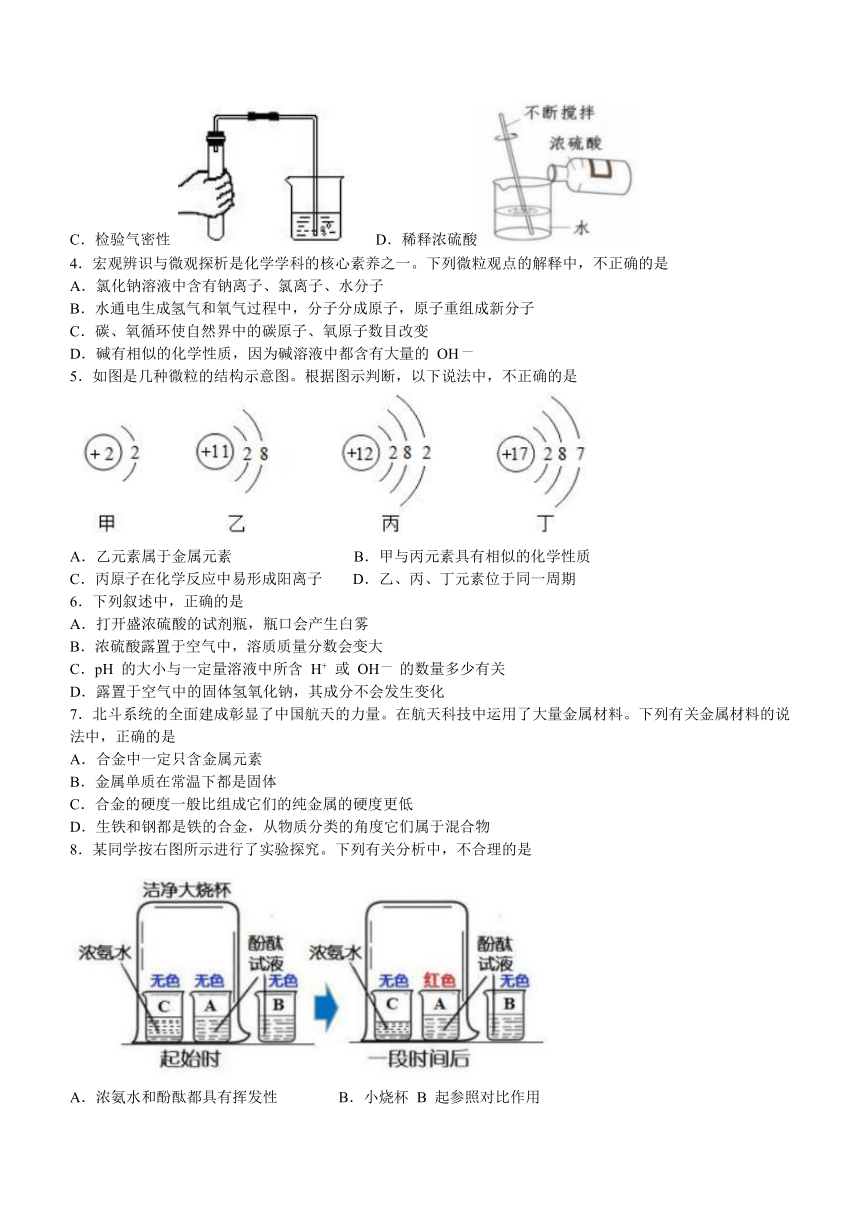
3.化学实验技能是学习化学和实验探究的基础保证。下列实验操作中,不正确的是
A.量取 9.5ml 液体 B.过滤黄泥水
C.检验气密性 D.稀释浓硫酸
4.宏观辨识与微观探析是化学学科的核心素养之一。下列微粒观点的解释中,不正确的是
A.氯化钠溶液中含有钠离子、氯离子、水分子
B.水通电生成氢气和氧气过程中,分子分成原子,原子重组成新分子
C.碳、氧循环使自然界中的碳原子、氧原子数目改变
D.碱有相似的化学性质,因为碱溶液中都含有大量的 OH —
5.如图是几种微粒的结构示意图。根据图示判断,以下说法中,不正确的是
A.乙元素属于金属元素 B.甲与丙元素具有相似的化学性质
C.丙原子在化学反应中易形成阳离子 D.乙、丙、丁元素位于同一周期
6.下列叙述中,正确的是
A.打开盛浓硫酸的试剂瓶,瓶口会产生白雾
B.浓硫酸露置于空气中,溶质质量分数会变大
C.pH 的大小与一定量溶液中所含 H+ 或 OH — 的数量多少有关
D.露置于空气中的固体氢氧化钠,其成分不会发生变化
7.北斗系统的全面建成彰显了中国航天的力量。在航天科技中运用了大量金属材料。下列有关金属材料的说法中,正确的是
A.合金中一定只含金属元素
B.金属单质在常温下都是固体
C.合金的硬度一般比组成它们的纯金属的硬度更低
D.生铁和钢都是铁的合金,从物质分类的角度它们属于混合物
8.某同学按右图所示进行了实验探究。下列有关分析中,不合理的是
A.浓氨水和酚酞都具有挥发性 B.小烧杯 B 起参照对比作用
C.氨气的水溶液显碱性 D. 该实验能证明分子在不断地运动
9.推理是化学学习中常用的思维方法。下列推理中,正确的是
A.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.镁能与稀盐酸反应产生气体,则能与稀盐酸反应产生气体的一定是金属
C.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
D.化学反应需要一定的条件,则控制反应条件可以促进或抑制化学反应
10.将白色硫酸铜粉末状晶体(CuSO4)加入到盛有 100 mL 60℃热水的烧杯中,直至不能继续溶解为止,得到一定温度下的蓝色溶液 M,即刻将一小块蓝色硫酸铜晶体(CuSO4·5H2O)N 悬垂于烧杯中的硫酸铜溶液 M 中(如右图所示),自然冷却至室温,观察现象(已知:硫酸铜的溶解度随温度的降低而
减小)。下列有关该实验的描述中,不合理的是
A.一定温度下,蓝色溶液 M 是硫酸铜的饱和溶液
B.随着温度的降低,硫酸铜溶液的质量不断增大
C.随着温度的降低,溶液中的溶质硫酸铜逐渐减少
D.在降温过程中,小块硫酸铜晶体 N 逐渐变大
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有错选的得 0 分)
11.下图是某化学反应的微观模拟示意图(甲、乙、丙、丁分别代表图中对应的四种物质),下列有关该反应的说法中,正确的是
A.x 的数值为 4 B.反应前后氧元素的化合价不变
C.物质甲和丙都属于化合物 D.参加反应的丙和丁的分子个数比为 1∶2
12.下列有关粗盐提纯过程的叙述中,正确的是
A.海水“晒盐”后剩余的母液(苦卤)一定是食盐的饱和溶液。
B.粗盐提纯过程中既有化学方法,又有物理方法
C.蒸发结晶食盐时,待水分全部蒸发,才能停止加热。
D.除去食盐水中可溶性杂质的化学原理为:使杂质离子以沉淀或气体的形式从食盐水中分离出来
13.为除去下列物质中混有的少量杂质,所采用的相应除杂质方案中,正确的是
选项 物质 杂质 除杂质方案
A N2 O2 将气体通过足量灼热的铜粉
B NaNO3溶液 Na2SO4 加入过量的Ba(NO3)2溶液,过滤
C FeCl2溶液 HCI 加入过量铁粉,过滤
D NaCl固体 CaCO3 加入足量水溶解,过滤,蒸发结晶,干燥
14.某化学小组的同学将单质铁和单质银的混合物 a g 加入到一定量的 Cu(NO3)2溶液中,充反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,在滤渣中加入稀盐酸,有气泡出。下列有关说法中,不合理是
A.滤液一定是无色溶液 B.滤液中一定含有 Ag+、Fe 2+
C.滤渣的质量一定大于 a g D.滤渣中一定含有单质银、单质铜和单质铁
15.取 26g 某单质铜和单质锌的混合物样品放于烧杯中,向其中加入一定量的硫酸铜溶液,搅拌,恰好完全反应,静置。一定温度下,在烧杯中得到不饱和溶液和 25.9g 固体。下列有关说法中,正确的是
A.反应后烧杯中溶液的质量比加入的硫酸铜溶液的质量大 0.1g
B.反应后烧杯底部所得固体呈红色
C.反应前后锌元素的化合价保持不变
D.该混合物样品中单质铜的质量分数为 75%
非选择题部分 共 60 分
三、非选择题(本大题共 5 小题,共 60 分)
16.(10 分)(1)按要求从氧化钙、氢氧化镁、氯化钠、盐酸中选取合适的物质,将其化
学式填写在下列横线上。
① 一种易挥发的酸 ② 生石灰的主要成分
③ 一种难溶性的碱 ④ 生理盐水的溶质
(2)习近平总书记在一次调研中用“文明其精神,野蛮其体魄”来激励同学们强身健体。少年强则国强,青少年的体质状况不仅关乎个人成长和家庭幸福,也关乎国家未来和民族希望。
①提高自身免疫力的最好方法就是运动。当身体运动时,身体可以产生多巴胺,让人心情舒畅,缓解紧张焦虑,提高身体免疫力。多巴胺的化学式为:C8H11NO2。在多巴胺中,氮元素和氧元素的质量比为_________(填最简整数比),它的一个分子中共有_________个原子。
②运动中若发生肌肉拉伤、关节挫伤,可以用复方氯乙烷气雾剂,它可以产生快速镇痛效果。氯乙烷的化学式式 C2H5Cl。氯乙烷由 种元素组成。所含元素质量分数最小的元素是 (填元素符号)。
③运动后有时会出现全身酸痛的现象,这是运动时骨骼肌收缩产生乳酸(化学式 C3H6O3)聚集所致,是正常反应。运动过后做舒缓拉伸的动作,乳酸与吸入氧气反应,生成二氧化碳和水,酸痛感消失,该反应化学方程式为 。
17.(12 分)(1)2022 年是中国航天的“超级大年”。神舟飞天、夸父追日、墨子传信、天宫入轨……一个个重大航天项目在无垠的宇宙书写着中国式的独特浪漫,更长远的探索计划蓄势待发。
①中国空间站中有电解水制氧系统,该系统利用循环水制取氧气,从而使氧气可重复供人呼吸,而生成的氢气可以与收集到的 CO2在特殊反应器内转化为水和甲烷(CH4)。写出电解水的化学方程式: 。甲烷(CH4)是一种洁净能源,原因是
②“嫦娥五号”探测器返回舱带回月球样品。月壤中含有丰富的稀有气体氦。一个氦原子的原子核内含有 2 个质子。试从原子结构的角度说明,稀有气体氦化学性质稳定的原因是 。
(2)我国是世界上率先开始大规模冶炼金属的国家之一,并且在相当长的历史时期内,冶金技术水平始终保持在世界前列。
①将孔雀石〔主要成分是 Cu2(OH)2CO3〕和木炭一起加热就可得到红色的金属铜。孔雀石受 热易 分解 ,得 到氧化 铜、 二氧 化碳 和水; 请你 写出 上述 反应的 化学 方程式 。
②铁制品容易锈蚀,请用化学方程式表示用盐酸除去铁锈(铁锈的主要成分是 Fe2O3)的原 理 。
(3)海洋是人类的巨大资源宝库,从海水中可以得到重要化工原料 NaCl 和 KCl。NaCl和 KCl 的溶解度曲线如图一所示,试回答下列问题:
①在 t2℃时,将 40gKCl 固体加入到 50g 水中,用玻璃棒充分搅拌后,所得溶液中溶质与溶剂的质量之比为 (填最简整数比)。
②在 t1℃时,各取一定量 NaCl 和 KCl 固体分别加水至完全溶解,分别配制成饱和溶液,然后升温至 t2℃,此时所得 NaCl 溶液的溶质质量分数 KCl 溶液的溶质质量分数(填“小于”“等于”“大于”之一)。
③甲、乙两试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,并都有少量固体存在,如图二所示,氢氧化钙的溶解度曲线如图三所示。若向试管外盛有水的烧杯中加入氢氧化钠固体,请分析推断可能产生的现象并分析原因
18.(12 分)下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列化学实验。
试回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置,连接仪器。(提示:盐酸中发出的少量 HCl 气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
②上述制二氧化碳的化学方程式为 。
③用仪器 F 收集二氧化碳气体时,检验二氧化碳己收集满的方法是:将燃着的木条放在集气瓶
(填“瓶口“瓶内”之一),若木条火焰 ,则证明二氧化碳已收集满。
④将二氧化碳通入水中,用 pH 试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法 。
(2)以过氧化氢溶液为原料(二氧化锰作催化剂)在实验室中制取氧气,并对某种塑料试样的组成进行分析探究实验(资料显示该塑料只含 C、H 两种元素),所选仪器按 “A→B1→E→B2→C→B3”的顺序连接(B1、B2、B3 为浓硫酸洗气瓶),检查装置气密性,然后进行实验。使 W g 该塑料试样碎屑在充足氧气中充分燃烧,观察现象,收集有关实验数据。(假设发生的化学反应都充分反应)
①该装置中,洗气瓶 B1 的作用是 。
②随着反应的进行,仪器 C 内的溶液 pH 将 (填“增大”“减小”“不变”之一)
③W g 该塑料试样充分燃烧后,测得仪器 B2 质量增加 a g,则该塑料试样中含氢元素的质量为
(结果用代数式表示)。
④W g 该塑料试样充分燃烧后,测得仪器 C 质量增加 b g,则该塑料试样中碳元素的质量分数为 (结果用代数式表示)。
19.(13 分)Ⅰ.实验室现有一瓶用石灰石和稀盐酸制取二氧化碳后的剩余废液,某小组同学想探究该废液中是否有残留的稀盐酸存在。
(1)甲同学向剩余废液中加入碳酸钠粉末,若观察 到的现象,则证明该废液中一定存在稀盐酸。
(2)乙同学从下列四种试剂中选取了一种试剂,也成功验证了废液中是否有残留的稀盐酸。则他所选的试剂不可能是 (填选项序号之一)。
A.紫色石蕊试液 B.硝酸银溶液 C.氧化铜 D.镁条
(3)若要除去废液中的稀盐酸,在不使用酸碱指示剂的情况下,可选用下列试剂中的 (填选项序号之一)。
A.生石灰 B.石灰水 C.石灰石粉末 D.NaOH 溶液
Ⅱ.现欲探究一固体混合物 A 的成分,已知其中可能含有 Na2CO3、NH4Cl、Ba(NO3)2、CuO 四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体 E 的化学式为 。
(2)常温下,气体 B 的水溶液的 pH 7(填“大于”、“小于”、“等于”之一)
(3)蓝色沉淀 F 的化学式为 。
(4)写出实验过程①中生成沉淀 D 的一个化学方程式: 。
(5)滤液 F 中肯定大量存在的酸根离子为 。(写离子符号)。
(6)在混合物 A 中,共有 种物质。写出其中一种一定存在的理由
20.(13 分)Ⅰ.在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示:
(1)在①-④四个过程中,发生了分解反应的是 (填序号).
(2)上图步骤④中,发生反应的化学方程式为
(3)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上
(填选项序号之一)。
A.硼酸溶液 B.3%~5%的碳酸氢钠溶液
C.生理盐水 D.75%的医用酒精
(4)检验烧碱溶液中含有少量 Na2CO3的具体方法是 。
Ⅱ.长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸溶液可以清除水垢。某同学通过实验测定水垢中碳酸钙的含量:将过量的稀盐酸加入到 200 g 水垢中,将产生的 CO2气体通入盛有足量的 NaOH 溶液的烧杯中,同时测量 3 分钟内 NaOH溶液增加的质量,结果如下表所示: .
时间/s(秒) 0 30 60 90 120 150 180
增加的质量/g 0 30 50 60 66 66 66
(1)从表中可以看出,200 g 水垢与盐酸反应生成的 CO2最多是 g。
(2)当 CO2气体通入 NaOH 溶液中 30 秒时,烧杯中溶液里存在的酸根阴离子是
(填离子符号)。
(3)计算水垢中碳酸钙的质量分数。
2022 至 2023 学年度第一学期高新区期末学业水平测试
九年级化学试题(先做卷二)
参考答案及评分意见
一、单项选择题(本题包括 10 个小题,每小题 2 分,共 20 分。每小题只有一个选项最符合题意。)
1.B 2.D 3.A 4.C 5.B 6.C 7.D 8.A 9.D 10.B
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有错选的得 0 分)
11.CD 12.ABD 13.ACD 14.AB 15.ABD
三、非选择题(本大题共 5 小题,共 60 分)
16.(共 10 分)
(1)①HCl(1 分) ② CaO(1 分) ③ Mg(OH)2(1 分) ④NaCl(1 分)
(2)① 7:16(1 分) 22(1 分) ② 三/3(1 分) H(1 分)
③ (2 分)
17.(共 12 分)
(1)① (2 分) 燃烧产物是水和二氧化碳,无污染(1 分)
②氦原子既不容易得电子也不容易失去电子(或氦原子电子层的第一层是最外层,且只有 2 个电子,已达到稳定结构)(1 分)
(2)① (2 分) ② (2 分)
(3)① 2∶5(1 分) ② 等于(1 分)
③甲试管中的固体逐渐溶解,乙试管内析出固体。氢氧化钠溶于水,温度升高,硝酸钾的溶解度随温度升高而增大,固体逐渐溶解;氢氧化钙的溶解度随温度升高而减小, 因此会析出固体(2 分)
18.(共 12 分)
(1)① ADBF(1 分) ② (2 分)
③瓶口(1 分) 熄灭(1 分)
④将待测液滴在 pH 试纸上,与标准比色卡对照,读出对应的 pH。(2 分)
(2)①干燥氧气,使定量计算更加准确(1 分) ②减小(1 分) ③ a/9(1 分)
④ (2 分)
19.(共 13 分)
I. (1)有气泡生成(1 分) (2)B(1 分) (3)C(1 分)
II.(1)①NH3(1 分) (2)小于(1 分) (3)Cu(OH)2 (1 分)
(4) (2 分)
(5)NO3 -、Cl -(2 分) (6)4(1 分)
在步骤①中,加入稀硫酸后有气体 B(CO2)生成,可证明在固体混合物 A 中一定有 Na2CO3存在。/在步骤①中,加入稀硫酸后有沉淀 D(BaSO4)生成,可证明在固体混合物 A 中一定有 Ba(NO3)2存在。/在步骤②中,加入 NaOH 溶液后有蓝色沉淀 F(Cu(OH)2)生成,可证明在固体混合物 A 中一定有 CuO 存在。/在步骤②中,加入 NaOH溶液后有气体 E(NH3)生成,可证明在固体混合物 A 中一定有 NH4Cl 存在。(2 分)
20.(共 13 分) Ⅰ. (1)①(1 分) (2) (2 分)
(3)A(1 分) (4)取少量烧碱溶液于试管中,向试管中加入适量稀盐酸(石灰水),
若有气泡(白色沉淀)产生,则证明溶液中含有碳酸钠;反之,则不含有碳酸钠(2 分)
(其他答案合理即可)
II.(1)66(1 分) (2)CO3 2-(1 分)
(3)设水垢中 CaCO3的质量为 x
(2 分)
100 44
x 66g
100/44 = x/66g (1 分)
x = 150g (1 分)
150g/200g×100%=75% (1 分)
答:水垢中 CaCO3的质量分数为 75%。
九年级化学试题(先做卷二)
本试题共 8 页,分选择题部分和非选择题部分,选择题部分 40 分,非选择题部分60 分,全卷满分 100 分,考试用时 60 分钟。
答题前,请考生务必将自己的姓名、座号、准考证号写在答题卡的规定位置,并同时将考点、姓名、准考证号、座号写在试题的规定位置。
答题时,选择题部分每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。非选择题部分,用 0.5 毫米黑色签字笔在答题卡上题号所提示的答题区域作答。直接在试题上作答无效。
本考试不允许使用计算器。考试结束后,将本试题和答题卡一并交回。
可能用到的相对原子质量:H 1 He 4 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 I 127 Ba 137
选择题部分 共 40 分
一、单项选择题(本大题共 10 小题,每小题 2 分,共 20 分。每小题给出的四个选项中,
只有一个选项最符合题目的要求)
1.世界万物是在不断变化的。下列过程中,不涉及化学变化的是
A.冶炼金属 B.雕刻玉石
C.钢铁生锈 D.酸碱中和
2.下列有关生活、生产常识的说法中,正确的是
A.室内养花可以防止煤气中毒 B.铵态氮肥可与碱性物质混用
C.食品包装袋中充入氨气可延长保质期 D.大量摄入可溶性钡盐会导致中毒
3.化学实验技能是学习化学和实验探究的基础保证。下列实验操作中,不正确的是
A.量取 9.5ml 液体 B.过滤黄泥水
C.检验气密性 D.稀释浓硫酸
4.宏观辨识与微观探析是化学学科的核心素养之一。下列微粒观点的解释中,不正确的是
A.氯化钠溶液中含有钠离子、氯离子、水分子
B.水通电生成氢气和氧气过程中,分子分成原子,原子重组成新分子
C.碳、氧循环使自然界中的碳原子、氧原子数目改变
D.碱有相似的化学性质,因为碱溶液中都含有大量的 OH —
5.如图是几种微粒的结构示意图。根据图示判断,以下说法中,不正确的是
A.乙元素属于金属元素 B.甲与丙元素具有相似的化学性质
C.丙原子在化学反应中易形成阳离子 D.乙、丙、丁元素位于同一周期
6.下列叙述中,正确的是
A.打开盛浓硫酸的试剂瓶,瓶口会产生白雾
B.浓硫酸露置于空气中,溶质质量分数会变大
C.pH 的大小与一定量溶液中所含 H+ 或 OH — 的数量多少有关
D.露置于空气中的固体氢氧化钠,其成分不会发生变化
7.北斗系统的全面建成彰显了中国航天的力量。在航天科技中运用了大量金属材料。下列有关金属材料的说法中,正确的是
A.合金中一定只含金属元素
B.金属单质在常温下都是固体
C.合金的硬度一般比组成它们的纯金属的硬度更低
D.生铁和钢都是铁的合金,从物质分类的角度它们属于混合物
8.某同学按右图所示进行了实验探究。下列有关分析中,不合理的是
A.浓氨水和酚酞都具有挥发性 B.小烧杯 B 起参照对比作用
C.氨气的水溶液显碱性 D. 该实验能证明分子在不断地运动
9.推理是化学学习中常用的思维方法。下列推理中,正确的是
A.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.镁能与稀盐酸反应产生气体,则能与稀盐酸反应产生气体的一定是金属
C.溶液中有晶体析出时,溶质质量减小,则溶质质量分数一定减小
D.化学反应需要一定的条件,则控制反应条件可以促进或抑制化学反应
10.将白色硫酸铜粉末状晶体(CuSO4)加入到盛有 100 mL 60℃热水的烧杯中,直至不能继续溶解为止,得到一定温度下的蓝色溶液 M,即刻将一小块蓝色硫酸铜晶体(CuSO4·5H2O)N 悬垂于烧杯中的硫酸铜溶液 M 中(如右图所示),自然冷却至室温,观察现象(已知:硫酸铜的溶解度随温度的降低而
减小)。下列有关该实验的描述中,不合理的是
A.一定温度下,蓝色溶液 M 是硫酸铜的饱和溶液
B.随着温度的降低,硫酸铜溶液的质量不断增大
C.随着温度的降低,溶液中的溶质硫酸铜逐渐减少
D.在降温过程中,小块硫酸铜晶体 N 逐渐变大
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有错选的得 0 分)
11.下图是某化学反应的微观模拟示意图(甲、乙、丙、丁分别代表图中对应的四种物质),下列有关该反应的说法中,正确的是
A.x 的数值为 4 B.反应前后氧元素的化合价不变
C.物质甲和丙都属于化合物 D.参加反应的丙和丁的分子个数比为 1∶2
12.下列有关粗盐提纯过程的叙述中,正确的是
A.海水“晒盐”后剩余的母液(苦卤)一定是食盐的饱和溶液。
B.粗盐提纯过程中既有化学方法,又有物理方法
C.蒸发结晶食盐时,待水分全部蒸发,才能停止加热。
D.除去食盐水中可溶性杂质的化学原理为:使杂质离子以沉淀或气体的形式从食盐水中分离出来
13.为除去下列物质中混有的少量杂质,所采用的相应除杂质方案中,正确的是
选项 物质 杂质 除杂质方案
A N2 O2 将气体通过足量灼热的铜粉
B NaNO3溶液 Na2SO4 加入过量的Ba(NO3)2溶液,过滤
C FeCl2溶液 HCI 加入过量铁粉,过滤
D NaCl固体 CaCO3 加入足量水溶解,过滤,蒸发结晶,干燥
14.某化学小组的同学将单质铁和单质银的混合物 a g 加入到一定量的 Cu(NO3)2溶液中,充反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,在滤渣中加入稀盐酸,有气泡出。下列有关说法中,不合理是
A.滤液一定是无色溶液 B.滤液中一定含有 Ag+、Fe 2+
C.滤渣的质量一定大于 a g D.滤渣中一定含有单质银、单质铜和单质铁
15.取 26g 某单质铜和单质锌的混合物样品放于烧杯中,向其中加入一定量的硫酸铜溶液,搅拌,恰好完全反应,静置。一定温度下,在烧杯中得到不饱和溶液和 25.9g 固体。下列有关说法中,正确的是
A.反应后烧杯中溶液的质量比加入的硫酸铜溶液的质量大 0.1g
B.反应后烧杯底部所得固体呈红色
C.反应前后锌元素的化合价保持不变
D.该混合物样品中单质铜的质量分数为 75%
非选择题部分 共 60 分
三、非选择题(本大题共 5 小题,共 60 分)
16.(10 分)(1)按要求从氧化钙、氢氧化镁、氯化钠、盐酸中选取合适的物质,将其化
学式填写在下列横线上。
① 一种易挥发的酸 ② 生石灰的主要成分
③ 一种难溶性的碱 ④ 生理盐水的溶质
(2)习近平总书记在一次调研中用“文明其精神,野蛮其体魄”来激励同学们强身健体。少年强则国强,青少年的体质状况不仅关乎个人成长和家庭幸福,也关乎国家未来和民族希望。
①提高自身免疫力的最好方法就是运动。当身体运动时,身体可以产生多巴胺,让人心情舒畅,缓解紧张焦虑,提高身体免疫力。多巴胺的化学式为:C8H11NO2。在多巴胺中,氮元素和氧元素的质量比为_________(填最简整数比),它的一个分子中共有_________个原子。
②运动中若发生肌肉拉伤、关节挫伤,可以用复方氯乙烷气雾剂,它可以产生快速镇痛效果。氯乙烷的化学式式 C2H5Cl。氯乙烷由 种元素组成。所含元素质量分数最小的元素是 (填元素符号)。
③运动后有时会出现全身酸痛的现象,这是运动时骨骼肌收缩产生乳酸(化学式 C3H6O3)聚集所致,是正常反应。运动过后做舒缓拉伸的动作,乳酸与吸入氧气反应,生成二氧化碳和水,酸痛感消失,该反应化学方程式为 。
17.(12 分)(1)2022 年是中国航天的“超级大年”。神舟飞天、夸父追日、墨子传信、天宫入轨……一个个重大航天项目在无垠的宇宙书写着中国式的独特浪漫,更长远的探索计划蓄势待发。
①中国空间站中有电解水制氧系统,该系统利用循环水制取氧气,从而使氧气可重复供人呼吸,而生成的氢气可以与收集到的 CO2在特殊反应器内转化为水和甲烷(CH4)。写出电解水的化学方程式: 。甲烷(CH4)是一种洁净能源,原因是
②“嫦娥五号”探测器返回舱带回月球样品。月壤中含有丰富的稀有气体氦。一个氦原子的原子核内含有 2 个质子。试从原子结构的角度说明,稀有气体氦化学性质稳定的原因是 。
(2)我国是世界上率先开始大规模冶炼金属的国家之一,并且在相当长的历史时期内,冶金技术水平始终保持在世界前列。
①将孔雀石〔主要成分是 Cu2(OH)2CO3〕和木炭一起加热就可得到红色的金属铜。孔雀石受 热易 分解 ,得 到氧化 铜、 二氧 化碳 和水; 请你 写出 上述 反应的 化学 方程式 。
②铁制品容易锈蚀,请用化学方程式表示用盐酸除去铁锈(铁锈的主要成分是 Fe2O3)的原 理 。
(3)海洋是人类的巨大资源宝库,从海水中可以得到重要化工原料 NaCl 和 KCl。NaCl和 KCl 的溶解度曲线如图一所示,试回答下列问题:
①在 t2℃时,将 40gKCl 固体加入到 50g 水中,用玻璃棒充分搅拌后,所得溶液中溶质与溶剂的质量之比为 (填最简整数比)。
②在 t1℃时,各取一定量 NaCl 和 KCl 固体分别加水至完全溶解,分别配制成饱和溶液,然后升温至 t2℃,此时所得 NaCl 溶液的溶质质量分数 KCl 溶液的溶质质量分数(填“小于”“等于”“大于”之一)。
③甲、乙两试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,并都有少量固体存在,如图二所示,氢氧化钙的溶解度曲线如图三所示。若向试管外盛有水的烧杯中加入氢氧化钠固体,请分析推断可能产生的现象并分析原因
18.(12 分)下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列化学实验。
试回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置,连接仪器。(提示:盐酸中发出的少量 HCl 气体可用饱和碳酸氢钠溶液吸收)
①所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
②上述制二氧化碳的化学方程式为 。
③用仪器 F 收集二氧化碳气体时,检验二氧化碳己收集满的方法是:将燃着的木条放在集气瓶
(填“瓶口“瓶内”之一),若木条火焰 ,则证明二氧化碳已收集满。
④将二氧化碳通入水中,用 pH 试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法 。
(2)以过氧化氢溶液为原料(二氧化锰作催化剂)在实验室中制取氧气,并对某种塑料试样的组成进行分析探究实验(资料显示该塑料只含 C、H 两种元素),所选仪器按 “A→B1→E→B2→C→B3”的顺序连接(B1、B2、B3 为浓硫酸洗气瓶),检查装置气密性,然后进行实验。使 W g 该塑料试样碎屑在充足氧气中充分燃烧,观察现象,收集有关实验数据。(假设发生的化学反应都充分反应)
①该装置中,洗气瓶 B1 的作用是 。
②随着反应的进行,仪器 C 内的溶液 pH 将 (填“增大”“减小”“不变”之一)
③W g 该塑料试样充分燃烧后,测得仪器 B2 质量增加 a g,则该塑料试样中含氢元素的质量为
(结果用代数式表示)。
④W g 该塑料试样充分燃烧后,测得仪器 C 质量增加 b g,则该塑料试样中碳元素的质量分数为 (结果用代数式表示)。
19.(13 分)Ⅰ.实验室现有一瓶用石灰石和稀盐酸制取二氧化碳后的剩余废液,某小组同学想探究该废液中是否有残留的稀盐酸存在。
(1)甲同学向剩余废液中加入碳酸钠粉末,若观察 到的现象,则证明该废液中一定存在稀盐酸。
(2)乙同学从下列四种试剂中选取了一种试剂,也成功验证了废液中是否有残留的稀盐酸。则他所选的试剂不可能是 (填选项序号之一)。
A.紫色石蕊试液 B.硝酸银溶液 C.氧化铜 D.镁条
(3)若要除去废液中的稀盐酸,在不使用酸碱指示剂的情况下,可选用下列试剂中的 (填选项序号之一)。
A.生石灰 B.石灰水 C.石灰石粉末 D.NaOH 溶液
Ⅱ.现欲探究一固体混合物 A 的成分,已知其中可能含有 Na2CO3、NH4Cl、Ba(NO3)2、CuO 四种物质中的两种或多种。按如图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体 E 的化学式为 。
(2)常温下,气体 B 的水溶液的 pH 7(填“大于”、“小于”、“等于”之一)
(3)蓝色沉淀 F 的化学式为 。
(4)写出实验过程①中生成沉淀 D 的一个化学方程式: 。
(5)滤液 F 中肯定大量存在的酸根离子为 。(写离子符号)。
(6)在混合物 A 中,共有 种物质。写出其中一种一定存在的理由
20.(13 分)Ⅰ.在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示:
(1)在①-④四个过程中,发生了分解反应的是 (填序号).
(2)上图步骤④中,发生反应的化学方程式为
(3)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上
(填选项序号之一)。
A.硼酸溶液 B.3%~5%的碳酸氢钠溶液
C.生理盐水 D.75%的医用酒精
(4)检验烧碱溶液中含有少量 Na2CO3的具体方法是 。
Ⅱ.长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸溶液可以清除水垢。某同学通过实验测定水垢中碳酸钙的含量:将过量的稀盐酸加入到 200 g 水垢中,将产生的 CO2气体通入盛有足量的 NaOH 溶液的烧杯中,同时测量 3 分钟内 NaOH溶液增加的质量,结果如下表所示: .
时间/s(秒) 0 30 60 90 120 150 180
增加的质量/g 0 30 50 60 66 66 66
(1)从表中可以看出,200 g 水垢与盐酸反应生成的 CO2最多是 g。
(2)当 CO2气体通入 NaOH 溶液中 30 秒时,烧杯中溶液里存在的酸根阴离子是
(填离子符号)。
(3)计算水垢中碳酸钙的质量分数。
2022 至 2023 学年度第一学期高新区期末学业水平测试
九年级化学试题(先做卷二)
参考答案及评分意见
一、单项选择题(本题包括 10 个小题,每小题 2 分,共 20 分。每小题只有一个选项最符合题意。)
1.B 2.D 3.A 4.C 5.B 6.C 7.D 8.A 9.D 10.B
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有错选的得 0 分)
11.CD 12.ABD 13.ACD 14.AB 15.ABD
三、非选择题(本大题共 5 小题,共 60 分)
16.(共 10 分)
(1)①HCl(1 分) ② CaO(1 分) ③ Mg(OH)2(1 分) ④NaCl(1 分)
(2)① 7:16(1 分) 22(1 分) ② 三/3(1 分) H(1 分)
③ (2 分)
17.(共 12 分)
(1)① (2 分) 燃烧产物是水和二氧化碳,无污染(1 分)
②氦原子既不容易得电子也不容易失去电子(或氦原子电子层的第一层是最外层,且只有 2 个电子,已达到稳定结构)(1 分)
(2)① (2 分) ② (2 分)
(3)① 2∶5(1 分) ② 等于(1 分)
③甲试管中的固体逐渐溶解,乙试管内析出固体。氢氧化钠溶于水,温度升高,硝酸钾的溶解度随温度升高而增大,固体逐渐溶解;氢氧化钙的溶解度随温度升高而减小, 因此会析出固体(2 分)
18.(共 12 分)
(1)① ADBF(1 分) ② (2 分)
③瓶口(1 分) 熄灭(1 分)
④将待测液滴在 pH 试纸上,与标准比色卡对照,读出对应的 pH。(2 分)
(2)①干燥氧气,使定量计算更加准确(1 分) ②减小(1 分) ③ a/9(1 分)
④ (2 分)
19.(共 13 分)
I. (1)有气泡生成(1 分) (2)B(1 分) (3)C(1 分)
II.(1)①NH3(1 分) (2)小于(1 分) (3)Cu(OH)2 (1 分)
(4) (2 分)
(5)NO3 -、Cl -(2 分) (6)4(1 分)
在步骤①中,加入稀硫酸后有气体 B(CO2)生成,可证明在固体混合物 A 中一定有 Na2CO3存在。/在步骤①中,加入稀硫酸后有沉淀 D(BaSO4)生成,可证明在固体混合物 A 中一定有 Ba(NO3)2存在。/在步骤②中,加入 NaOH 溶液后有蓝色沉淀 F(Cu(OH)2)生成,可证明在固体混合物 A 中一定有 CuO 存在。/在步骤②中,加入 NaOH溶液后有气体 E(NH3)生成,可证明在固体混合物 A 中一定有 NH4Cl 存在。(2 分)
20.(共 13 分) Ⅰ. (1)①(1 分) (2) (2 分)
(3)A(1 分) (4)取少量烧碱溶液于试管中,向试管中加入适量稀盐酸(石灰水),
若有气泡(白色沉淀)产生,则证明溶液中含有碳酸钠;反之,则不含有碳酸钠(2 分)
(其他答案合理即可)
II.(1)66(1 分) (2)CO3 2-(1 分)
(3)设水垢中 CaCO3的质量为 x
(2 分)
100 44
x 66g
100/44 = x/66g (1 分)
x = 150g (1 分)
150g/200g×100%=75% (1 分)
答:水垢中 CaCO3的质量分数为 75%。
同课章节目录
