化学人教版(2019)选择性必修2 1.1.1能层与能级(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.1能层与能级(共26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-31 18:53:29 | ||
图片预览






文档简介
(共26张PPT)
能层与能级 基态与激发态
原子光谱
第1课时
01
03
1.通过认识原子结构与核外电子排布理解能层与能级的关系。
2.通过核外电子能量不同分析,理解激态与激发态的含义与关系。
3.能辨识光谱与电子跃迁之间的关系。
核心素养发展目标
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
原子诞生
Democritus
1936
马德隆
原子光谱构造原理
宇宙爆炸理论
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
肆
FOUR
A
解析
例
肆
FOUR
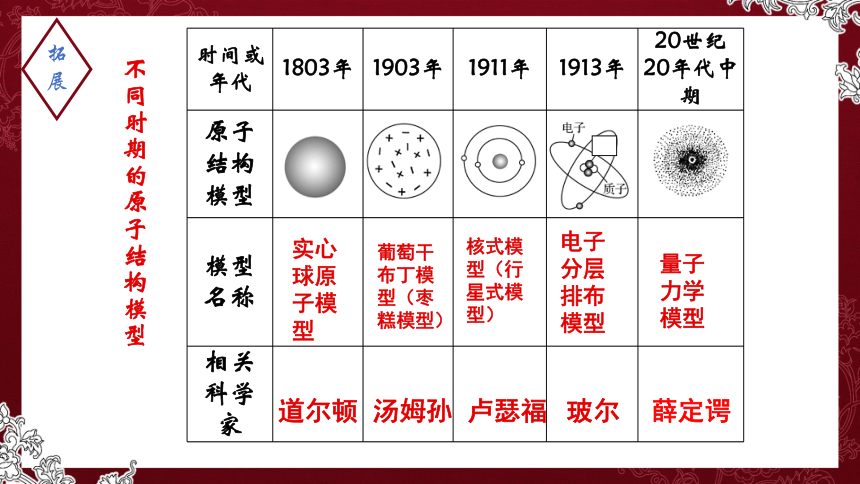
时间或年代 1803年 1903年 1911年 1913年 20世纪20年代中期
原子结构模型
模型 名称
相关科学家
拓展
道尔顿
葡萄干布丁模型(枣糕模型)
汤姆孙
核式模型(行星式模型)
卢瑟福
电子分层排布模型
玻尔
量子力学模型
实心球原子模型
薛定谔
不同时期的原子结构模型
旧知回顾
对原子的认识?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
eg:钠的原子结构示意图
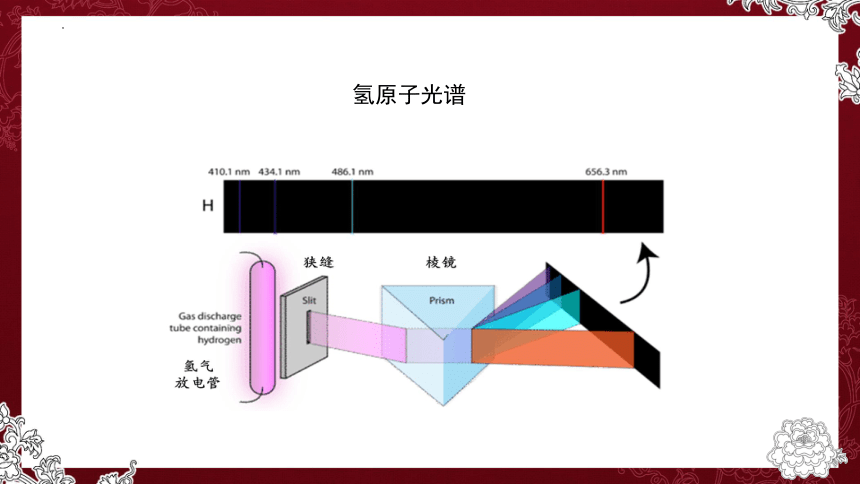
研究核外电子排布的实验依据是什么?
原子光谱
霓虹灯
激光
光谱:按照一定能量次序排列的光带。
可见光光谱:可以被人眼观察的光带。
氢原子光谱
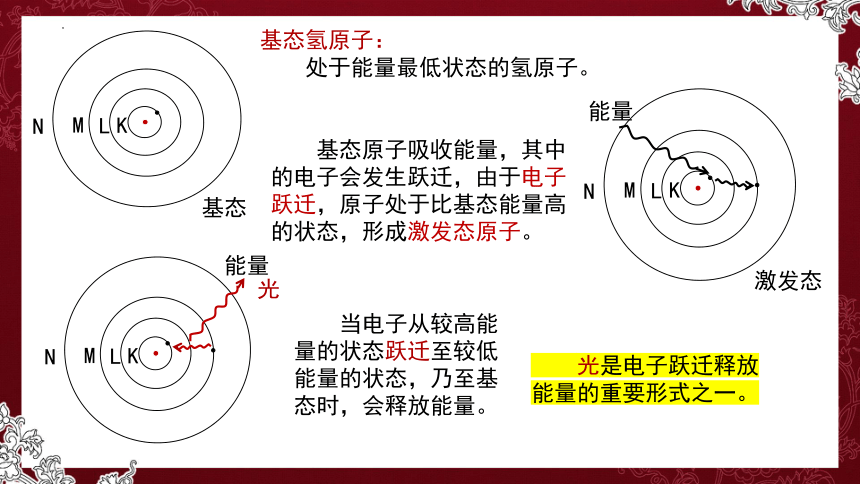
基态
K
L
M
N
基态氢原子:
处于能量最低状态的氢原子。
激发态
K
L
M
N
能量
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
光
肆
FOUR
节日里看到五颜六色的焰火。这些焰火的颜色与原子有什么关系呢?
与原子核外电子跃迁释放能量有关。
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
发射光谱(高跃到低):
暗背景,亮线,线状不连续
吸收光谱(低跃到高):
亮背景,安线,线状不连续
锂、氦、汞
应用:
1.发现新元素
2.检验元素---焰色反应
He 氦
肆
FOUR
训练
1.下列关于同一种原子中的基态和激发态说法中,正确的是
A.基态时的能量比激发态时高
B.激发态时比较稳定
C.由基态转化为激发态过程中吸收能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析 同一原子处于激发态时能量较高,较不稳定,A、B不正确;
电子从能量较低的基态跃迁到能量较高的激发态时,也会产生原子光谱,D不正确。
√
肆
FOUR
2.以下现象与核外电子的跃迁有关的是
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
√
肆
FOUR
解析 ①霓虹灯发出有色光,因为灯管中的稀有气体原子吸收能量,电子发生跃迁,发射出不同颜色的光,正确;
②棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无关,错误;
③激光的产生就是在外部刺激的情况下,很多高能的电子同时释放相位和能级相同能量,这些能量成为颜色一样的光子,有的在激光器内反射,继续与电子碰撞,释放更多的与它相同的光子,有的离开激光器,形成激光,与电子跃迁有关,正确;
④石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃迁无关,错误;
⑤凸透镜聚光是由光的折射形成的,与电子跃迁无关,错误;
⑥燃放的焰火,是因为不同金属离子吸收能量,电子发生跃迁,形成不同的颜色的光,正确;
⑦日光灯通电发光,是因为电子受到激发的时候原子就会释放出可见光子形成的,与电子跃迁有关,正确;
⑧冷却结晶,是由于温度降低,物质的溶解度减小,析出溶质,与电子跃迁无关。
肆
FOUR
3.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式表现出来的现象
√
解析 焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
肆
FOUR
核外电子有什么运动特点和排布规律?
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
所谓能层,就是电子层。
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)肆
FOUR
完成下表:
原子核外电子在能层中的排布规律
一般核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数
2
8
18
32
50
72
98
离原子核越近,能量越低。
原子核外电子在能层中排布的表示方法-原子结构示意图
钠原子光谱实验
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
同一能层中电子的能量是否就相同的呢?
肆
FOUR
任一能层的能级总是从s能级开始,
按s、p、d、f……排序
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:
多电子原子中:E(ns)能层序号+能级代号,1s、2s、2p、3d、4f……
能级
单电子原子中:E(ns) = E(np) = E(nd) = E(nf)
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
完成下表:
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2 5p能级 2×3=6
5d能级 2×5=10 5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
思考
肆
FOUR
A
解析
例
肆
FOUR
训练
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子能量一定高于s能级电子能量
D.在离核最近的区域内运动的电子能量最低
√
解析 最易失去的电子,性质活泼,所以能量最高,A正确;
离核最近的区域内运动的电子能量最低,离核越远区域内运动的电子能量越高,B、D正确;
处于同一能层时,p能级电子能量一定高于s能级电子能量,C错误。
肆
FOUR
2.下列说法中有错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
√
解析 氢原子K层上只有一个电子,A正确;
Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;
原子核外已有M层,则L层为全排满,即8个电子,这样M层就有32个电子,而M层为第三层,最多容纳的电子数为18个,故不可能,C错误;
O2-核电荷数为8,核外最外层电子数也为8,D正确。
肆
FOUR
3.下列有关能层和能级的叙述中正确的是
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
√
解析 A项,M能层有s、p、d共3个能级,最多容纳 18个电子;
B项,3d能级最多容纳10个电子,从N能层开始有f能级,最多容纳14个电子,不存在3f能级;
C项,每个能层都从s能级开始,且s能级最多容纳2个电子;
D项,K能层只有s能级,不含有p能级。
肆
FOUR
4.下列多电子原子不同能级能量高低的比较错误的是
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
√
解析 在多电子原子中,从3d能级开始有“能级交错”现象,实际4s能级的能量小于3d,所以D错误。
FOUR
1.1s、2s、3d分别表示什么意义
2.钠原子第三能层只有3s能级填充电子,是否可以说钠原子第三能层只有3s能级 钠原子有3个能层填充电子,是否可以说钠原子只有3个能层
能层序号写在s、p、d、f等能级符号前,共同表示能级,如同第几层楼的第几级楼梯一样,如3d、4s等,能层就是电子层,能级是电子层中的电子亚层,在含有多个电子的原子里,由于电子的能量是不相同的,因此,它们运动的区域也不同,通常能量低的电子在离核近的区域运动,而能量高的电子在离核远的区域运动,影响各能级能量的最大因素是能层:同一能层中,各能级之间的能量大小关系是s不可以,钠原子第三能层有3s、3p、3d能级,只有3s能级填充电子,3p、3d能级没有电子;不可以,钠原子具有若干能层,但只有K、L、M三个能层填充电子,其他能层没有电子。
课后思考
能层与能级 基态与激发态
原子光谱
第1课时
01
03
1.通过认识原子结构与核外电子排布理解能层与能级的关系。
2.通过核外电子能量不同分析,理解激态与激发态的含义与关系。
3.能辨识光谱与电子跃迁之间的关系。
核心素养发展目标
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
原子诞生
Democritus
1936
马德隆
原子光谱构造原理
宇宙爆炸理论
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
肆
FOUR
A
解析
例
肆
FOUR
时间或年代 1803年 1903年 1911年 1913年 20世纪20年代中期
原子结构模型
模型 名称
相关科学家
拓展
道尔顿
葡萄干布丁模型(枣糕模型)
汤姆孙
核式模型(行星式模型)
卢瑟福
电子分层排布模型
玻尔
量子力学模型
实心球原子模型
薛定谔
不同时期的原子结构模型
旧知回顾
对原子的认识?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
eg:钠的原子结构示意图
研究核外电子排布的实验依据是什么?
原子光谱
霓虹灯
激光
光谱:按照一定能量次序排列的光带。
可见光光谱:可以被人眼观察的光带。
氢原子光谱
基态
K
L
M
N
基态氢原子:
处于能量最低状态的氢原子。
激发态
K
L
M
N
能量
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
能量
K
L
M
N
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
光
肆
FOUR
节日里看到五颜六色的焰火。这些焰火的颜色与原子有什么关系呢?
与原子核外电子跃迁释放能量有关。
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
发射光谱(高跃到低):
暗背景,亮线,线状不连续
吸收光谱(低跃到高):
亮背景,安线,线状不连续
锂、氦、汞
应用:
1.发现新元素
2.检验元素---焰色反应
He 氦
肆
FOUR
训练
1.下列关于同一种原子中的基态和激发态说法中,正确的是
A.基态时的能量比激发态时高
B.激发态时比较稳定
C.由基态转化为激发态过程中吸收能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析 同一原子处于激发态时能量较高,较不稳定,A、B不正确;
电子从能量较低的基态跃迁到能量较高的激发态时,也会产生原子光谱,D不正确。
√
肆
FOUR
2.以下现象与核外电子的跃迁有关的是
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
√
肆
FOUR
解析 ①霓虹灯发出有色光,因为灯管中的稀有气体原子吸收能量,电子发生跃迁,发射出不同颜色的光,正确;
②棱镜分光是由于不同色彩的光在玻璃中的折射率不同引起的,与电子跃迁无关,错误;
③激光的产生就是在外部刺激的情况下,很多高能的电子同时释放相位和能级相同能量,这些能量成为颜色一样的光子,有的在激光器内反射,继续与电子碰撞,释放更多的与它相同的光子,有的离开激光器,形成激光,与电子跃迁有关,正确;
④石油蒸馏是利用石油中各成分的沸点不同加以分离,与电子跃迁无关,错误;
⑤凸透镜聚光是由光的折射形成的,与电子跃迁无关,错误;
⑥燃放的焰火,是因为不同金属离子吸收能量,电子发生跃迁,形成不同的颜色的光,正确;
⑦日光灯通电发光,是因为电子受到激发的时候原子就会释放出可见光子形成的,与电子跃迁有关,正确;
⑧冷却结晶,是由于温度降低,物质的溶解度减小,析出溶质,与电子跃迁无关。
肆
FOUR
3.对焰色试验的描述正确的是
A.焰色试验只是金属单质特有的性质
B.焰色试验是化学变化
C.焰色试验是金属原子从基态跃迁到激发态时,将能量以光的形式表现出来
D.焰色试验是金属原子或离子从较高能量的激发态跃迁到较低能量的激发态或基态时,将能量以光的形式表现出来的现象
√
解析 焰色试验是大多数金属元素的性质,是物理变化,从基态→激发态要吸收能量,从激发态→基态会释放能量。
肆
FOUR
核外电子有什么运动特点和排布规律?
玻尔模型
电子只能在原子核外具有特定能量的“壳层”中运动。
所谓能层,就是电子层。
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)
FOUR
完成下表:
原子核外电子在能层中的排布规律
一般核外电子总是尽量先排布在能量较低的能层,然后依次排布在能量逐渐升高的能层。
原子核外各能层最多容纳2n2个电子。
最外层最多容纳8个电子(K层为最外层最多只能容纳2个电子。)
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多可容纳电子数
2
8
18
32
50
72
98
离原子核越近,能量越低。
原子核外电子在能层中排布的表示方法-原子结构示意图
钠原子光谱实验
钠原子光谱
分析钠原子光谱时发现:
即便是相同的两个能层之间发生电子跃迁,也会出现多条谱线。
对于这个现象,你会提出何种假设?
多电子原子中,同一能层的电子,能量也可能不同。
还可以把一个能层分为不同能级。
同一能层中电子的能量是否就相同的呢?
肆
FOUR
任一能层的能级总是从s能级开始,
按s、p、d、f……排序
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:
多电子原子中:E(ns)
能级
单电子原子中:E(ns) = E(np) = E(nd) = E(nf)
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
完成下表:
第五能层最多可以容纳多少个电子?分别容纳在哪些能级中?各能级最多容纳多少个电子?
各能级最多容纳的电子数为:
5s能级 2×1=2 5p能级 2×3=6
5d能级 2×5=10 5f能级 2×7=14
5g能级 2×9=18
总计50个电子,与前面能层的计算结果相同。
思考
肆
FOUR
A
解析
例
肆
FOUR
训练
1.在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.离核最远的电子能量最高
C.p能级电子能量一定高于s能级电子能量
D.在离核最近的区域内运动的电子能量最低
√
解析 最易失去的电子,性质活泼,所以能量最高,A正确;
离核最近的区域内运动的电子能量最低,离核越远区域内运动的电子能量越高,B、D正确;
处于同一能层时,p能级电子能量一定高于s能级电子能量,C错误。
肆
FOUR
2.下列说法中有错误的是
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
√
解析 氢原子K层上只有一个电子,A正确;
Cl-、K+等离子M层和L层上的电子数均为K层的4倍,B正确;
原子核外已有M层,则L层为全排满,即8个电子,这样M层就有32个电子,而M层为第三层,最多容纳的电子数为18个,故不可能,C错误;
O2-核电荷数为8,核外最外层电子数也为8,D正确。
肆
FOUR
3.下列有关能层和能级的叙述中正确的是
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳5个电子,3f能级最多容纳7个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
√
解析 A项,M能层有s、p、d共3个能级,最多容纳 18个电子;
B项,3d能级最多容纳10个电子,从N能层开始有f能级,最多容纳14个电子,不存在3f能级;
C项,每个能层都从s能级开始,且s能级最多容纳2个电子;
D项,K能层只有s能级,不含有p能级。
肆
FOUR
4.下列多电子原子不同能级能量高低的比较错误的是
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
√
解析 在多电子原子中,从3d能级开始有“能级交错”现象,实际4s能级的能量小于3d,所以D错误。
FOUR
1.1s、2s、3d分别表示什么意义
2.钠原子第三能层只有3s能级填充电子,是否可以说钠原子第三能层只有3s能级 钠原子有3个能层填充电子,是否可以说钠原子只有3个能层
能层序号写在s、p、d、f等能级符号前,共同表示能级,如同第几层楼的第几级楼梯一样,如3d、4s等,能层就是电子层,能级是电子层中的电子亚层,在含有多个电子的原子里,由于电子的能量是不相同的,因此,它们运动的区域也不同,通常能量低的电子在离核近的区域运动,而能量高的电子在离核远的区域运动,影响各能级能量的最大因素是能层:同一能层中,各能级之间的能量大小关系是s
课后思考
