化学人教版(2019)选择性必修1 3.1.1弱电解质的电离平衡(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1.1弱电解质的电离平衡(共29张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 95.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-31 18:58:00 | ||
图片预览








文档简介
(共29张PPT)
第三章
水溶液中的离子反应与平衡
第一课时
弱电解质的电离平衡
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
导电的原因是?
任务一
研究在相同条件下,不同电解质的电离程度是否有区别。
(以HCl和CH3COOH为例进行研究)
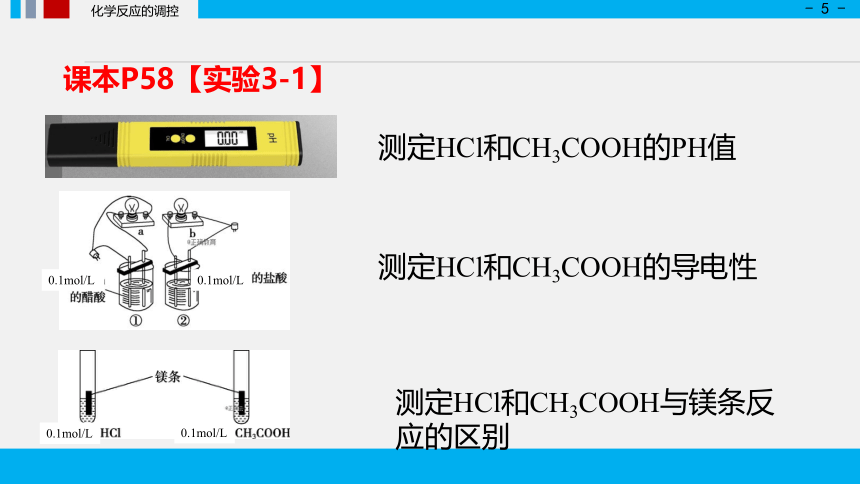
课本P58【实验3-1】
0.1mol/L
0.1mol/L
0.1mol/L
0.1mol/L
测定HCl和CH3COOH的PH值
测定HCl和CH3COOH的导电性
测定HCl和CH3COOH与镁条反应的区别
测定HCl和CH3COOH的PH值
0.1mol/L
0.1mol/L
测定HCl和CH3COOH的导电性
0.1mol/L
0.1mol/L
测定HCl和CH3COOH与镁条反应的区别
酸 0.1mol·L-1盐酸 0.1 mol·L-1醋酸
pH大小
导电能力
小
大
强
弱
与镁反应 现象 剧烈反应,产生气体 缓慢反应,产生气体
结论 Mg与盐酸反应速率大,表明盐酸中c(H+)较 ,说明在水中盐酸的电离程度 醋酸的电离程度
实验结论 ①盐酸中c(H+) 醋酸溶液中c(H+),即盐酸中HCl电离程度比醋酸溶液中CH3COOH电离程度 ;
大
大于
大于
大
实验分析
盐酸、醋酸的对比
【分析结果】
HCl完全电离
CH3COOH部分电离
水溶液中不存在溶质分子
水溶液中存在溶质分子
CH3COOH
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
主要粒子
H2O
H2O
H+
H+
CH3COO
Cl
一:强电解质与弱电解质
溶质在溶液中只以离子形式存在,没有分子
强电解质:在水溶液中能够全部电离的电解质
弱电解质:
在水溶液中只能部分电离的电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
Cl- H3O+
H3O+ CH3COO- CH3COOH
电解质
强电解质
弱电解质
强酸→ HCl、 HBr 、HI、 H2SO4、HNO3、HClO4等
强碱→ KOH、NaOH、 Ca(OH)2 、Ba(OH)2等
绝大多数盐→ NaCl、Na2SO4、NaHCO3等
弱碱→ NH3·H2O、Fe(OH)2、 Fe(OH)3等
极少数盐→ (CH3COOH)2Pb等
水
弱酸→H2S、H2CO3、CH3COOH、HCN、H2SO3 、HClO等
二:电离方程式的书写
1.强电解质:完全电离,用“=”连接。
2.弱电解质:部分电离,用“ ”连接。
(1)一元弱酸、弱碱一步电离
(2)多元弱酸(如H2CO3、H2SO3、H2S等均为二元弱酸)分步电离,且电离程度逐步减弱,酸性由第一步电离决定,
如H2CO3的电离方程式为
(3)多元弱碱[如Cu(OH)2、Mg(OH)2、Fe(OH)3等]分步电离,但一步写出,如Fe(OH)3电离方程式
H2CO3 H++HCO3- 、 HCO3- H++CO32-
Fe(OH)3 Fe3++3OH-
NH3·H2O NH4++OH-
(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同,
如NaHSO4溶于水中:
NaHSO4===Na++H++SO42-
在熔融状态下:
NaHSO4===Na++HSO4-
NaHCO3溶于水中:
总结规律:
强等号,弱可逆,多元弱酸分步写,多元弱碱一步完
NaHCO3===Na++HCO3-
巩固提升
请写出H2S、 Ba(OH)2、HClO在水溶液中的电离方程式。
H2S H++HS-
HS- H++S2-
Ba(OH)2=Ba2++2OH-
HClO H++ClO-
研究弱电解质是如何电离的。
(以CH3COOH电离为例进行研究)
任务二
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,用pH传感器记录溶液pH变化。
(已知:CH3COONH4水溶液呈中性)
【实验4】
为什么加“固体”?
保证足量的溶质,同时
控制溶液体积基本不变
实验分析:
pH升高,c(H+)下降
醋酸铵溶液呈中性,醋酸铵的酸碱性不影响溶液pH
1.弱电解质的电离是可逆的,存在电离平衡
弱电解质的电离平衡
【小结2】
2.电离平衡属于动态平衡
(1)定义
三:弱电解质的电离平衡
(2)用v-t图像描述
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
醋酸电离过程中CH3COOH分子电离成离子的速率与离子结合成CH3COOH分子的速率的变化图像:
在一定条件下(如温度和浓度)的弱电解质溶液中,电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程达到电离平衡状态。
(3)特征
电离平衡是一种动态平衡
条件不变,溶液各分子、离子的浓度不变。
条件改变时,电离平衡发生移动。
V电离=V结合≠0
弱电解质的电离是可逆的
弱
等
动
定
变
(4)影响弱电解质电离平衡的因素
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
①温度
②浓度
③其他因素
当外界条件改变时符合“勒夏特列原理”
越强越电离
由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡向逆反应方向移动,电离程度减小。
①温度:
越热越电离
越稀越电离
②浓度:
①增加弱电解质浓度
平衡向电离的方向移动,但电离程度减小
②加水稀释
平衡向电离方向移动,电离程度增大
c(CH3COO-)和c(H+)怎样变化?
减小
n(CH3COO-)和n(H+)怎样变化?
增大
①加入同弱电解质具有相同离子的强电解质
②加入能与弱电解质电离产生的某种离子反应的物质时
③其他因素:
抑制了弱电解质的电离,使电离平衡向逆反应方向移动,电离程度减小(同离子效应);
减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向(即正反应方向)移动,电离程度增大。
实例(稀溶液)
改变条件 平衡移动方向 n(H+) c(H+) c(CH3COO-) c(CH3COOH) 电离程度 导电能力
加HCl(g)
加NaOH(s)
加水稀释
加入少量冰醋酸
加入( CH3COONa)(s)
加入镁粉
CH3COOH CH3COO- +H+ △H>0
向左
增大
增大
减小
增大
减小
增强
向右
减小
减小
增大
减小
增大
增强
向右
增大
减小
减小
减小
增大
减弱
向右
增大
增大
增大
增大
减小
增强
向左
减小
减小
增大
增大
减小
增强
向右
减小
减小
增大
减小
增大
增强
【学以致用】
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度
课堂练习在一定温度下,冰醋酸稀释过程中溶
液的导电能力变化如右图所示,请填写下列空白。
(1)加水前导电能力约为零的原因是____________
(2)a b c三点对应的溶液中,c(H+)由小到大的顺序是______
(3)a 、b、 c三点对应的溶液中,CH3COOH电离程度最大的是 ________
(4)若使b点对应的溶液中c(CH3COO-)增大、c(H+)减小,可采用的方法是_______(填序号)。
①加H2O ②加NaOH固体 ③加浓硫酸 ④加Na2CO3固体
冰醋酸中只有分子,没有自由移动的离子
cC
② ④
课堂小结
弱电解质的电离
相关概念
电离平衡
非电解质
电解质
强电解质
弱电解质
平衡的建立与特征
影响因素
内因:电解质本身
外因:温度、压强
第三章
水溶液中的离子反应与平衡
第一课时
弱电解质的电离平衡
盐酸常用于卫生洁具的清洁,比如某些洁厕灵有效成分是盐酸。
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
导电的原因是?
任务一
研究在相同条件下,不同电解质的电离程度是否有区别。
(以HCl和CH3COOH为例进行研究)
课本P58【实验3-1】
0.1mol/L
0.1mol/L
0.1mol/L
0.1mol/L
测定HCl和CH3COOH的PH值
测定HCl和CH3COOH的导电性
测定HCl和CH3COOH与镁条反应的区别
测定HCl和CH3COOH的PH值
0.1mol/L
0.1mol/L
测定HCl和CH3COOH的导电性
0.1mol/L
0.1mol/L
测定HCl和CH3COOH与镁条反应的区别
酸 0.1mol·L-1盐酸 0.1 mol·L-1醋酸
pH大小
导电能力
小
大
强
弱
与镁反应 现象 剧烈反应,产生气体 缓慢反应,产生气体
结论 Mg与盐酸反应速率大,表明盐酸中c(H+)较 ,说明在水中盐酸的电离程度 醋酸的电离程度
实验结论 ①盐酸中c(H+) 醋酸溶液中c(H+),即盐酸中HCl电离程度比醋酸溶液中CH3COOH电离程度 ;
大
大于
大于
大
实验分析
盐酸、醋酸的对比
【分析结果】
HCl完全电离
CH3COOH部分电离
水溶液中不存在溶质分子
水溶液中存在溶质分子
CH3COOH
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
主要粒子
H2O
H2O
H+
H+
CH3COO
Cl
一:强电解质与弱电解质
溶质在溶液中只以离子形式存在,没有分子
强电解质:在水溶液中能够全部电离的电解质
弱电解质:
在水溶液中只能部分电离的电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
Cl- H3O+
H3O+ CH3COO- CH3COOH
电解质
强电解质
弱电解质
强酸→ HCl、 HBr 、HI、 H2SO4、HNO3、HClO4等
强碱→ KOH、NaOH、 Ca(OH)2 、Ba(OH)2等
绝大多数盐→ NaCl、Na2SO4、NaHCO3等
弱碱→ NH3·H2O、Fe(OH)2、 Fe(OH)3等
极少数盐→ (CH3COOH)2Pb等
水
弱酸→H2S、H2CO3、CH3COOH、HCN、H2SO3 、HClO等
二:电离方程式的书写
1.强电解质:完全电离,用“=”连接。
2.弱电解质:部分电离,用“ ”连接。
(1)一元弱酸、弱碱一步电离
(2)多元弱酸(如H2CO3、H2SO3、H2S等均为二元弱酸)分步电离,且电离程度逐步减弱,酸性由第一步电离决定,
如H2CO3的电离方程式为
(3)多元弱碱[如Cu(OH)2、Mg(OH)2、Fe(OH)3等]分步电离,但一步写出,如Fe(OH)3电离方程式
H2CO3 H++HCO3- 、 HCO3- H++CO32-
Fe(OH)3 Fe3++3OH-
NH3·H2O NH4++OH-
(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同,
如NaHSO4溶于水中:
NaHSO4===Na++H++SO42-
在熔融状态下:
NaHSO4===Na++HSO4-
NaHCO3溶于水中:
总结规律:
强等号,弱可逆,多元弱酸分步写,多元弱碱一步完
NaHCO3===Na++HCO3-
巩固提升
请写出H2S、 Ba(OH)2、HClO在水溶液中的电离方程式。
H2S H++HS-
HS- H++S2-
Ba(OH)2=Ba2++2OH-
HClO H++ClO-
研究弱电解质是如何电离的。
(以CH3COOH电离为例进行研究)
任务二
向0.1 mol/L CH3COOH溶液中加入CH3COONH4固体,用pH传感器记录溶液pH变化。
(已知:CH3COONH4水溶液呈中性)
【实验4】
为什么加“固体”?
保证足量的溶质,同时
控制溶液体积基本不变
实验分析:
pH升高,c(H+)下降
醋酸铵溶液呈中性,醋酸铵的酸碱性不影响溶液pH
1.弱电解质的电离是可逆的,存在电离平衡
弱电解质的电离平衡
【小结2】
2.电离平衡属于动态平衡
(1)定义
三:弱电解质的电离平衡
(2)用v-t图像描述
电离平衡状态建立
反应速率
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
时间
醋酸电离过程中CH3COOH分子电离成离子的速率与离子结合成CH3COOH分子的速率的变化图像:
在一定条件下(如温度和浓度)的弱电解质溶液中,电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程达到电离平衡状态。
(3)特征
电离平衡是一种动态平衡
条件不变,溶液各分子、离子的浓度不变。
条件改变时,电离平衡发生移动。
V电离=V结合≠0
弱电解质的电离是可逆的
弱
等
动
定
变
(4)影响弱电解质电离平衡的因素
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
①温度
②浓度
③其他因素
当外界条件改变时符合“勒夏特列原理”
越强越电离
由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡向逆反应方向移动,电离程度减小。
①温度:
越热越电离
越稀越电离
②浓度:
①增加弱电解质浓度
平衡向电离的方向移动,但电离程度减小
②加水稀释
平衡向电离方向移动,电离程度增大
c(CH3COO-)和c(H+)怎样变化?
减小
n(CH3COO-)和n(H+)怎样变化?
增大
①加入同弱电解质具有相同离子的强电解质
②加入能与弱电解质电离产生的某种离子反应的物质时
③其他因素:
抑制了弱电解质的电离,使电离平衡向逆反应方向移动,电离程度减小(同离子效应);
减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向(即正反应方向)移动,电离程度增大。
实例(稀溶液)
改变条件 平衡移动方向 n(H+) c(H+) c(CH3COO-) c(CH3COOH) 电离程度 导电能力
加HCl(g)
加NaOH(s)
加水稀释
加入少量冰醋酸
加入( CH3COONa)(s)
加入镁粉
CH3COOH CH3COO- +H+ △H>0
向左
增大
增大
减小
增大
减小
增强
向右
减小
减小
增大
减小
增大
增强
向右
增大
减小
减小
减小
增大
减弱
向右
增大
增大
增大
增大
减小
增强
向左
减小
减小
增大
增大
减小
增强
向右
减小
减小
增大
减小
增大
增强
【学以致用】
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度
课堂练习在一定温度下,冰醋酸稀释过程中溶
液的导电能力变化如右图所示,请填写下列空白。
(1)加水前导电能力约为零的原因是____________
(2)a b c三点对应的溶液中,c(H+)由小到大的顺序是______
(3)a 、b、 c三点对应的溶液中,CH3COOH电离程度最大的是 ________
(4)若使b点对应的溶液中c(CH3COO-)增大、c(H+)减小,可采用的方法是_______(填序号)。
①加H2O ②加NaOH固体 ③加浓硫酸 ④加Na2CO3固体
冰醋酸中只有分子,没有自由移动的离子
c
② ④
课堂小结
弱电解质的电离
相关概念
电离平衡
非电解质
电解质
强电解质
弱电解质
平衡的建立与特征
影响因素
内因:电解质本身
外因:温度、压强
