2022-2023学年高一上学期化学苏教版(2019)必修第一册5.2.1离子键 课件(26张PPT)
文档属性
| 名称 | 2022-2023学年高一上学期化学苏教版(2019)必修第一册5.2.1离子键 课件(26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-31 19:05:54 | ||
图片预览








文档简介
(共26张PPT)
世界是由丰富多彩的物质构成的,那么这些物质是由哪些微粒组成的?
微粒间存在什么作用力?
高一化学组 张银利
第二单元 微粒间的相互作用
第一课时 离子键
学习目标
1、理解化学键、离子键的概念;
2、通过NaCl的形成过程,会从微观角度推理分析离子键的
形成,建立判断离子键和离子化合物的思维模型。
3、能运用电子式从微观角度说明物质的组成及其变化,
能用电子式表示离子化合物的形成过程。
重难点:离子键的形成过程,电子式的书写
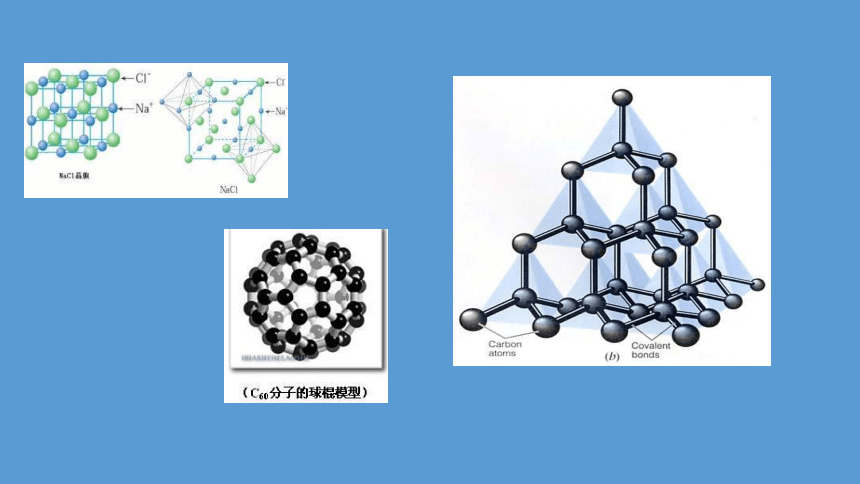
构成物质的微粒有原子、离子和分子等。不同的物质含有不同的微粒,这些微粒间通过一定的作用力彼此结合。
例如,氯化钠和氧化镁这样的化合物是由阴、阳离子构成的,离子间存在着强烈的相互作用;
氯气是由许多氯分子聚集而成的,每个氯分子又是由两个氯原子结合而成的,氯分子中两个氯原子间存在着强烈的相互作用;
金刚石是由许多碳原子彼此结合形成的空间网状晶体,直接相邻的碳原子间存在强烈的相互作用。
一、化学键
1、定义:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
2、分类:离子键、共价键等
理解要点 : (1)直接相邻
(2)原子或离子之间
(3)强烈的相互作用
1.画出钠和氯的原子结构示意图。
2.NaCl是如何由Na原子和Cl原子形成的?
3.在氯化钠中,阴、阳离子间存在怎样的相互作用?
问题思考
活泼金属原子
活泼非金属原子
阳离子
阴离子
静电引力
(一)离子键
1、定义:阴、阳离子之间存在的强烈的相互作用,叫做离子键。
2、成键微粒:阴、阳离子
3、成键本质:静电作用(静电引力和静电斥力)
二、离子键和离子化合物
(二)离子化合物:
定义:由阴、阳离子通过离子键形成的化合物,叫离子化合物。
离子化合物中一定存在离子键。
【思考题】
1、根据氯化钠中离子键的形成过程,分析哪些元素之间易形成离子键?
2、下列哪些物质中存在离子键?并总结存在离子键的物质类别。
Na2O MgCl2 H2SO4 HCl NaOH KNO3 NH4Cl
活泼金属 + 活泼非金属
离子化合物:强碱、大多数盐(除AlCl3 外)、活泼金属氧化物
(第ⅠA、ⅡA族) (第ⅥA、Ⅶ A族)
追问:所有金属和非金属化合都能形成离子键吗?
追问:所有非金属化合都不能形成离子键吗?举例说明
三、电子式
1.定义:在元素符号周围用“·”或“×”来表示原子或离子的最外层电子排布式子称为电子式。用电子式还可以表示离子化合物的组成。
原子 离子 电子式 离子化合物
Cl
Na
Br
Mg
2
Mg
2
Na
Mg
Cl
Na
Cl
Br
Br
Br
【问题思考】
请根据下表,找出原子、离子和离子化合物的
电子式书写的规律。
2、电子式的书写:
1.原子的电子式:在元素符号周围用“ · ”或“×”来表示原子最外层电子
3.阴离子的电子式要标”[ ]”,右上角标上电荷符号“ n一“
2.简单阳离子的电子式:就是其离子符号。
4.离子化合物的电子式:阴、阳离子的电子式相间写,
相同离子不能合并。
Mg2+
··
[ Br ]-
··
:
:
Mg2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
例1.用电子式表示离子化合物NaCl的形成过程:
Cl
Na
Cl
Na
Mg
2
F
F
F
Mg
F
例2.用电子式表示离子化合物MgF2的形成过程:
知识拓展
3、用电子式表示离子化合物的形成
相同离子不合并
IA IIA IIIA IVA VA VIA VIIA
钠 镁 铝 硅 磷 硫 氯
原子
离子
注意 原子和简单离子电子式的书写:
S
Cl
Mg
Na
P
Si
Al
Na+
Mg2+
Al3+
Cl
S
2-
单核阳离子用
离子符号表示
阴离子的电子式, 必须用中括号括起来并写“电性、电荷数”
离子 化合物 CaO Na2S
Ca2+
O
2-
阴阳离子交替出现,少的写中间,多的对称分布在两边。
Na
S
2-
Na
本节总结:
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
离子化合物一定含离子键
离子化合物的电子式:
AB型
AB2型
A2B型
NaCl
Na2S
Na2O
MgCl2
谢谢观看!
2.下列化合物的电子式书写正确的是( )
【思路分析】 解题时要注意阳离子的电子式和离子符号相同(原子团除外),一般阴离子的电子式是在元素符号周围有8个电子
D
Na
+11
+17
Cl
失去电子
得到电子
Na+
+11
+17
Cl—
活泼金属原子
活泼非金属原子
阳离子
阴离子
电子转移
静电引力
静电斥力
静电作用
NaCl
1.下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D. KNO3 、NH4Cl都是离子化合物
D
2.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
6和8 B.11和13
C.11和16 D.12和17
D
3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
课堂练习
AlCl3
HCl
NH4Cl
4.用电子式表示:KBr NaCl CaCl2 K2O
2.电子式书写的规律
原子 在元素符号周围用“·”或“×”来表示原子的最外层电子
离子 ①阳离子的电子式就是其离子符号,即Xm+
②阴离子的电子式要标” [ ]”,右上角标上电荷符号“ n一“
离子化合物 A2B或AB2型的离子化合物:
①同种电荷的离子相互排斥
②离子数目少的微粒写在中间
③离子数目多的同种微粒分开写在左右,不得合并
3、用电子式表示离子化合物的形成
原子的电子式+原子的电子式
化合物的电子式
(1)氯化钠的形成过程
(2)氯化镁的形成过程
(3)氧化钠的形成过程
相同离子不合并
你知道吗?
我们已经学过氯化钠和氧化镁的形成过程。氯和钠、氧和镁化合时,钠、镁原子失去电子,氯、氧原子得到电子,它们通过电子转移分别形成阳离子和阴离子而彼此结合。
①哪类元素的原子能以这种方式相结合?
②这种结合方式与它们的原子结构有什么关系?
③在氯化钠、氧化镁这样的化合物中,阴、阳离子间存在怎样的相互作用?
1、活泼金属氧化物Na2O、K2O、MgO、Al2O3等,其中存在的化学键为离子键
2、碱:强碱中存在离子键,如KOH、Ca(OH)2、NaOH、Ba(OH)2;金属离子与氢氧根离子之间的作用为离子键、氢氧根内部氢原子和氧原子之间为共价键
3、盐:绝大多数盐中存在离子键,少数盐中只存在共价键(如AlCl3等)
注意问题:化学式中只要存在离子键,就一定是离子化合物;但离子化合物中可能存在共价键;
世界是由丰富多彩的物质构成的,那么这些物质是由哪些微粒组成的?
微粒间存在什么作用力?
高一化学组 张银利
第二单元 微粒间的相互作用
第一课时 离子键
学习目标
1、理解化学键、离子键的概念;
2、通过NaCl的形成过程,会从微观角度推理分析离子键的
形成,建立判断离子键和离子化合物的思维模型。
3、能运用电子式从微观角度说明物质的组成及其变化,
能用电子式表示离子化合物的形成过程。
重难点:离子键的形成过程,电子式的书写
构成物质的微粒有原子、离子和分子等。不同的物质含有不同的微粒,这些微粒间通过一定的作用力彼此结合。
例如,氯化钠和氧化镁这样的化合物是由阴、阳离子构成的,离子间存在着强烈的相互作用;
氯气是由许多氯分子聚集而成的,每个氯分子又是由两个氯原子结合而成的,氯分子中两个氯原子间存在着强烈的相互作用;
金刚石是由许多碳原子彼此结合形成的空间网状晶体,直接相邻的碳原子间存在强烈的相互作用。
一、化学键
1、定义:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
2、分类:离子键、共价键等
理解要点 : (1)直接相邻
(2)原子或离子之间
(3)强烈的相互作用
1.画出钠和氯的原子结构示意图。
2.NaCl是如何由Na原子和Cl原子形成的?
3.在氯化钠中,阴、阳离子间存在怎样的相互作用?
问题思考
活泼金属原子
活泼非金属原子
阳离子
阴离子
静电引力
(一)离子键
1、定义:阴、阳离子之间存在的强烈的相互作用,叫做离子键。
2、成键微粒:阴、阳离子
3、成键本质:静电作用(静电引力和静电斥力)
二、离子键和离子化合物
(二)离子化合物:
定义:由阴、阳离子通过离子键形成的化合物,叫离子化合物。
离子化合物中一定存在离子键。
【思考题】
1、根据氯化钠中离子键的形成过程,分析哪些元素之间易形成离子键?
2、下列哪些物质中存在离子键?并总结存在离子键的物质类别。
Na2O MgCl2 H2SO4 HCl NaOH KNO3 NH4Cl
活泼金属 + 活泼非金属
离子化合物:强碱、大多数盐(除AlCl3 外)、活泼金属氧化物
(第ⅠA、ⅡA族) (第ⅥA、Ⅶ A族)
追问:所有金属和非金属化合都能形成离子键吗?
追问:所有非金属化合都不能形成离子键吗?举例说明
三、电子式
1.定义:在元素符号周围用“·”或“×”来表示原子或离子的最外层电子排布式子称为电子式。用电子式还可以表示离子化合物的组成。
原子 离子 电子式 离子化合物
Cl
Na
Br
Mg
2
Mg
2
Na
Mg
Cl
Na
Cl
Br
Br
Br
【问题思考】
请根据下表,找出原子、离子和离子化合物的
电子式书写的规律。
2、电子式的书写:
1.原子的电子式:在元素符号周围用“ · ”或“×”来表示原子最外层电子
3.阴离子的电子式要标”[ ]”,右上角标上电荷符号“ n一“
2.简单阳离子的电子式:就是其离子符号。
4.离子化合物的电子式:阴、阳离子的电子式相间写,
相同离子不能合并。
Mg2+
··
[ Br ]-
··
:
:
Mg2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
例1.用电子式表示离子化合物NaCl的形成过程:
Cl
Na
Cl
Na
Mg
2
F
F
F
Mg
F
例2.用电子式表示离子化合物MgF2的形成过程:
知识拓展
3、用电子式表示离子化合物的形成
相同离子不合并
IA IIA IIIA IVA VA VIA VIIA
钠 镁 铝 硅 磷 硫 氯
原子
离子
注意 原子和简单离子电子式的书写:
S
Cl
Mg
Na
P
Si
Al
Na+
Mg2+
Al3+
Cl
S
2-
单核阳离子用
离子符号表示
阴离子的电子式, 必须用中括号括起来并写“电性、电荷数”
离子 化合物 CaO Na2S
Ca2+
O
2-
阴阳离子交替出现,少的写中间,多的对称分布在两边。
Na
S
2-
Na
本节总结:
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
离子化合物一定含离子键
离子化合物的电子式:
AB型
AB2型
A2B型
NaCl
Na2S
Na2O
MgCl2
谢谢观看!
2.下列化合物的电子式书写正确的是( )
【思路分析】 解题时要注意阳离子的电子式和离子符号相同(原子团除外),一般阴离子的电子式是在元素符号周围有8个电子
D
Na
+11
+17
Cl
失去电子
得到电子
Na+
+11
+17
Cl—
活泼金属原子
活泼非金属原子
阳离子
阴离子
电子转移
静电引力
静电斥力
静电作用
NaCl
1.下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D. KNO3 、NH4Cl都是离子化合物
D
2.下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是
6和8 B.11和13
C.11和16 D.12和17
D
3.下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
D
课堂练习
AlCl3
HCl
NH4Cl
4.用电子式表示:KBr NaCl CaCl2 K2O
2.电子式书写的规律
原子 在元素符号周围用“·”或“×”来表示原子的最外层电子
离子 ①阳离子的电子式就是其离子符号,即Xm+
②阴离子的电子式要标” [ ]”,右上角标上电荷符号“ n一“
离子化合物 A2B或AB2型的离子化合物:
①同种电荷的离子相互排斥
②离子数目少的微粒写在中间
③离子数目多的同种微粒分开写在左右,不得合并
3、用电子式表示离子化合物的形成
原子的电子式+原子的电子式
化合物的电子式
(1)氯化钠的形成过程
(2)氯化镁的形成过程
(3)氧化钠的形成过程
相同离子不合并
你知道吗?
我们已经学过氯化钠和氧化镁的形成过程。氯和钠、氧和镁化合时,钠、镁原子失去电子,氯、氧原子得到电子,它们通过电子转移分别形成阳离子和阴离子而彼此结合。
①哪类元素的原子能以这种方式相结合?
②这种结合方式与它们的原子结构有什么关系?
③在氯化钠、氧化镁这样的化合物中,阴、阳离子间存在怎样的相互作用?
1、活泼金属氧化物Na2O、K2O、MgO、Al2O3等,其中存在的化学键为离子键
2、碱:强碱中存在离子键,如KOH、Ca(OH)2、NaOH、Ba(OH)2;金属离子与氢氧根离子之间的作用为离子键、氢氧根内部氢原子和氧原子之间为共价键
3、盐:绝大多数盐中存在离子键,少数盐中只存在共价键(如AlCl3等)
注意问题:化学式中只要存在离子键,就一定是离子化合物;但离子化合物中可能存在共价键;
