化学人教版(2019)必修第一册4.3.1离子键(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1离子键(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 503.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 13:47:43 | ||
图片预览






文档简介
(共17张PPT)
第四章 物质结构 元素周期律
第三节 化学键
第1课时 离子键
学习目标
1.了解离子键的概念及形成过程。
2.了解离子化合物的概念,并能识别常见的离子化合物。
3.掌握原子、阴阳离子及离子化合物电子式的书写方法,并会用电子式表示离子化合物的形成过程。
问题预设及反馈
1. 如何表示原子、离子、物质的电子式?
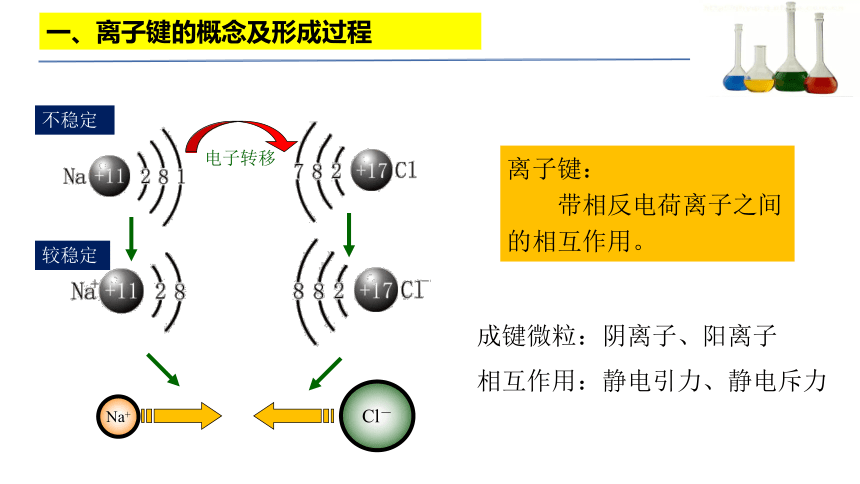
一、离子键的概念及形成过程
Na+
Cl-
电子转移
不稳定
较稳定
离子键:
带相反电荷离子之间的相互作用。
成键微粒:阴离子、阳离子
相互作用:静电引力、静电斥力
二、离子化合物
离子化合物:由离子键构成的化合物
注:必须有离子键,可以有共价键。
②根据性质
熔点高(1000左右)
熔融态能导电
离子化合物判断方法:
①根据定义
一般情况:活泼金属与活泼非金属间形成离子化合物。
特殊情况:①AlCl3、BeCl2形成的是共价键
②NH4+与阴离子间形成的是离子键(如:NH4Cl)
1. 下列物质中含有离子键的是?
CaCl2 H2 NaOH H2SO4
Na2O CO2 Na2O2 NH4Cl NaHCO3
下列物质是离子化合物的是?
2. 下列说法中正确的是 ( )
A.阴阳离子间通过静电引力而形成的化学键叫做离子键
B.离子化合物中可能有共价键
C.只有金属元素和非金属元素化合时才能形成离子键
D.两个金属原子间可能形成离子键
练习
二、电子式、形成过程
电子式:元素符号周围用“ · ”“×”来表示原子最外层电子的式子
1. 原子
写出第三周期元素的电子式
Na ·
·Mg ·
Cl ·
··
··
··
S ·
··
··
·
P ·
··
·
·
Si ·
·
·
·
Al ·
·
·
原则:尽量成单
2. 阳离子
H+
Na+
Mg2+
Ca2+
简单阳离子:
复杂阳离子:
原则:离子符号表示。
3. 阴离子
原则:(进电子关门,标电荷。)
4. 离子化合物电子式
AB型(NaCl)
AB2型( Na2O)
A2B型(MgCl2)
5. 离子化合物形成过程
用电子式表示离子化合物的形成过程。 AB型(如NaCl): AB2型(如MgCl2):
A2B型(如Na2O):
注意:箭头左方相同的微粒可以合并,箭头右方相同的微粒不可以合并,弯箭头可以省略,“→”不可写成“=”
练习
答案 D
答案 D
3、与NaCl化学键类型相同的物质是( )。 A.H2 B.HCl C.KCl D.CO2
答案 C
答案 C
课堂小结
1.了解离子键的概念及形成过程。
2.了解离子化合物的概念,并能识别常见的离子化合物。
3.掌握原子、阴阳离子及离子化合物电子式的书写方法,并会用电子式表示离子化合物的形成过程。
第四章 物质结构 元素周期律
第三节 化学键
第1课时 离子键
学习目标
1.了解离子键的概念及形成过程。
2.了解离子化合物的概念,并能识别常见的离子化合物。
3.掌握原子、阴阳离子及离子化合物电子式的书写方法,并会用电子式表示离子化合物的形成过程。
问题预设及反馈
1. 如何表示原子、离子、物质的电子式?
一、离子键的概念及形成过程
Na+
Cl-
电子转移
不稳定
较稳定
离子键:
带相反电荷离子之间的相互作用。
成键微粒:阴离子、阳离子
相互作用:静电引力、静电斥力
二、离子化合物
离子化合物:由离子键构成的化合物
注:必须有离子键,可以有共价键。
②根据性质
熔点高(1000左右)
熔融态能导电
离子化合物判断方法:
①根据定义
一般情况:活泼金属与活泼非金属间形成离子化合物。
特殊情况:①AlCl3、BeCl2形成的是共价键
②NH4+与阴离子间形成的是离子键(如:NH4Cl)
1. 下列物质中含有离子键的是?
CaCl2 H2 NaOH H2SO4
Na2O CO2 Na2O2 NH4Cl NaHCO3
下列物质是离子化合物的是?
2. 下列说法中正确的是 ( )
A.阴阳离子间通过静电引力而形成的化学键叫做离子键
B.离子化合物中可能有共价键
C.只有金属元素和非金属元素化合时才能形成离子键
D.两个金属原子间可能形成离子键
练习
二、电子式、形成过程
电子式:元素符号周围用“ · ”“×”来表示原子最外层电子的式子
1. 原子
写出第三周期元素的电子式
Na ·
·Mg ·
Cl ·
··
··
··
S ·
··
··
·
P ·
··
·
·
Si ·
·
·
·
Al ·
·
·
原则:尽量成单
2. 阳离子
H+
Na+
Mg2+
Ca2+
简单阳离子:
复杂阳离子:
原则:离子符号表示。
3. 阴离子
原则:(进电子关门,标电荷。)
4. 离子化合物电子式
AB型(NaCl)
AB2型( Na2O)
A2B型(MgCl2)
5. 离子化合物形成过程
用电子式表示离子化合物的形成过程。 AB型(如NaCl): AB2型(如MgCl2):
A2B型(如Na2O):
注意:箭头左方相同的微粒可以合并,箭头右方相同的微粒不可以合并,弯箭头可以省略,“→”不可写成“=”
练习
答案 D
答案 D
3、与NaCl化学键类型相同的物质是( )。 A.H2 B.HCl C.KCl D.CO2
答案 C
答案 C
课堂小结
1.了解离子键的概念及形成过程。
2.了解离子化合物的概念,并能识别常见的离子化合物。
3.掌握原子、阴阳离子及离子化合物电子式的书写方法,并会用电子式表示离子化合物的形成过程。
