化学人教版(2019)必修第一册4.3.2共价键及共价化合物(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键及共价化合物(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1013.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 16:41:41 | ||
图片预览




文档简介
(共25张PPT)
必修第一册
第四单元物质结构有元素周期律
第三节 化学键
第2课时共价键及共价化合物
复习回顾
[思考2]非金属元素的原子之间能形成离子键吗?为什么?
使阴阳离子结合成化合物的静电作用,叫做离子键。
阴阳离子
静电作用(静电吸引和静电排斥的平衡)
得、失电子
活泼金属元素与活泼非金属元素
1.概念
2.成键粒子
3.成键方式
4.成键本质
5.成键元素
带相反电荷离子之间的强烈相互作用
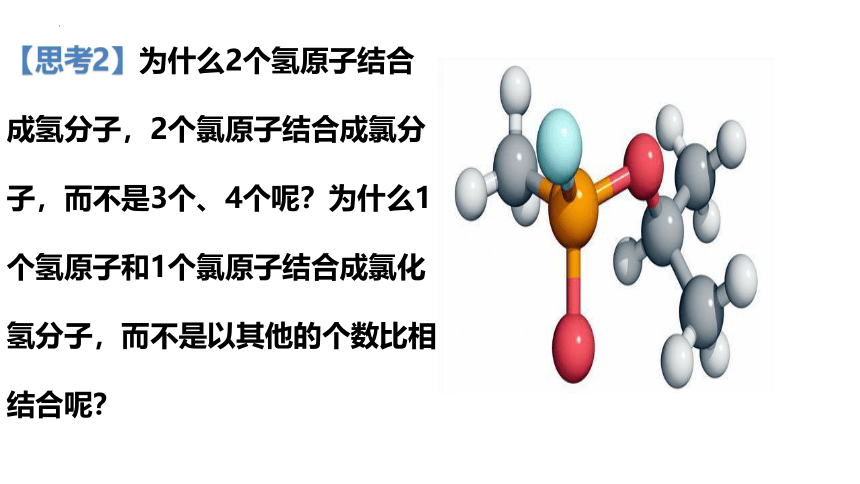
【思考2】为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
学
PART
01
PART
02
PART
03
核心素养发展目标
掌握共价键的形成过程和形成条件
了解共价键的概念及形成
了解共价化合物的不同表示方法,会用电子式表示共价化合物的形成过程。
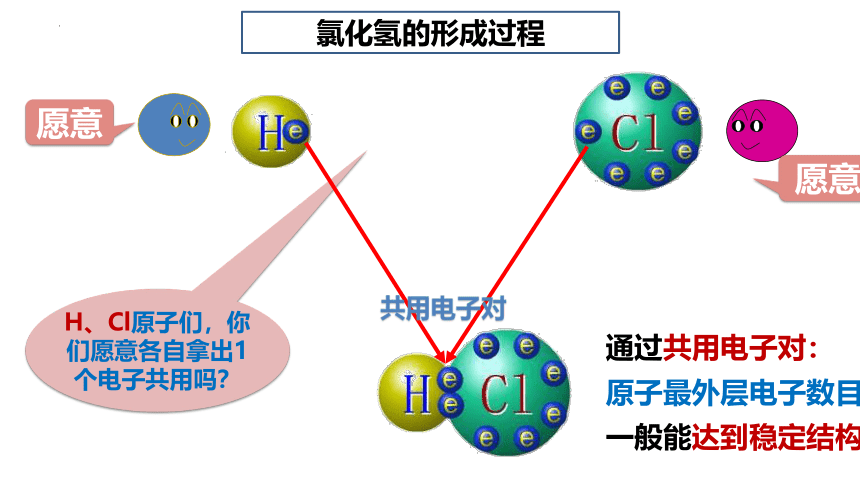
H、Cl原子们,你们愿意各自拿出1个电子共用吗?
氯化氢的形成过程
愿意
愿意
共用电子对
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
愿意
愿意
电子
电子
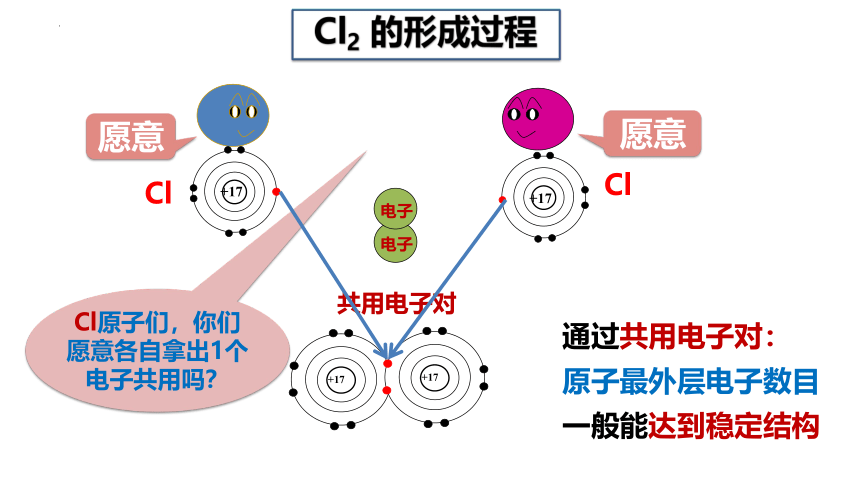
Cl原子们,你们愿意各自拿出1个电子共用吗?
+17
Cl
共用电子对
+17
+17
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
Cl
+17
Cl2 的形成过程
原子之间通过共用电子对所形成的强烈相互作用
原 子
共用电子对
一、共价键
同种或不同种非金属元素原子之间
(稀有气体元素除外)。
1.概念
2.成键粒子
3.成键方式
4.成键本质
5.成键元素
电子的偏移
如:HCl、 CO2 、NH3、Cl2、 O3等
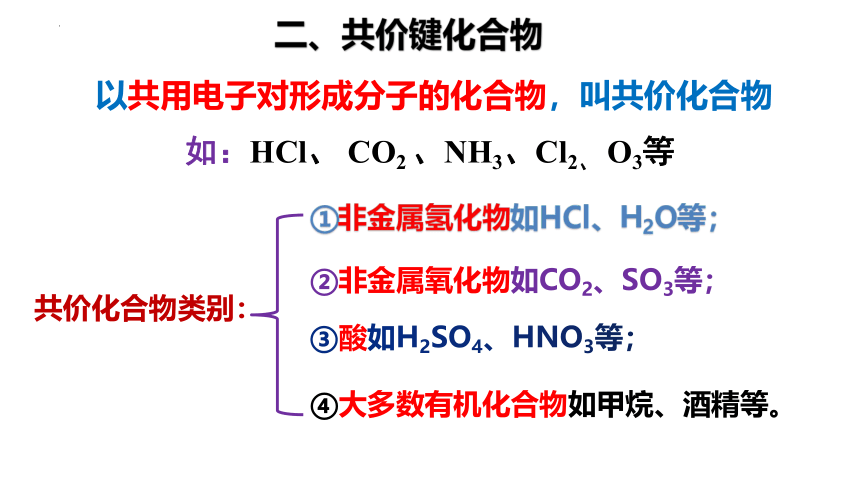
以共用电子对形成分子的化合物,叫共价化合物
二、共价键化合物
共价化合物类别:
④大多数有机化合物如甲烷、酒精等。
①非金属氢化物如HCl、H2O等;
②非金属氧化物如CO2、SO3等;
③酸如H2SO4、HNO3等;
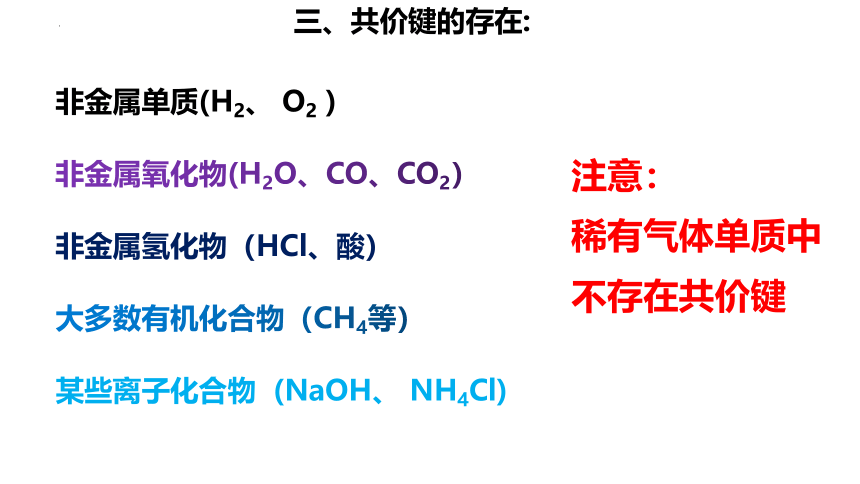
非金属单质(H2、 O2 )
非金属氧化物(H2O、CO、CO2)
非金属氢化物(HCl、酸)
大多数有机化合物(CH4等)
某些离子化合物 (NaOH、 NH4Cl)
注意:
稀有气体单质中不存在共价键
三、共价键的存在:
例1、下列化合物中含有的化学键类型有哪些?
NaOH
O3
HCl
NH4NO3
共价键
即共价键又有离子键
共价键
即共价键又有离子键
共价键的两个“一定”和两个“不一定”
(1)两个“一定”
①共价化合物中一定 共价键;
②共价化合物中一定 离子键。
只含有
不含
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等;
②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O—H共价键,Na2O2中含有O—O共价键,NH4Cl中含有N—H共价键,但它们都是离子化合物。
四、共价键的分类
【思考3】Cl2和HCl都靠共价键形成的分子,其共价键是否相同呢?
Cl2
HCl
特
征
组成
原子吸引电子对能力
共用电子对位置
成键原子电性
结 论
同种原子
不同种原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子一方
不显电性
显电性
非极性键
极性键
+17
+17
+17
+1
非极性键:同种非金属原子间形成的共价键是非极性共价键,简称非极性键。
极性键:两种不同的非金属原子间形成的共价键是极性共价键,简称极性键。
成键元素相同A-A 型
成键元素不同A-B 型
【思考5】如何解释CO2中C显+4价,O显-2价?
CO2中C形成4个共用电子对,每个O形成2个共用电子对,O原子吸引电子的能力比C强,所以C显+4价,O显-2价
【思考4】已知过氧化氢的结构式为H—O—O—H,其中含有的共价键类型有什么?
极性键和非极性键
书写要求:
1、每个原子达到稳定结构
2、不用加括号[ ]
电子对是两原子共用的,并未形成离子,
因此共价化合物的电子式中没有“±”、“[ ]”等符号。
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
五、共价键化合物的电子式
H2
HCl
N2
H2O
CO2
NH3
例3、书写下列共价键化合物的电子式
CO2 H2O CH4
电子式:
结构式:
O=C=O
结构模型:
H—O—H
C
H
H
H
H
常用 1 根短线“-”表示一对共用电子。
六、共价键化合物的结构式
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
七、用电子式表示原子形成共价键的形成过程表示
注意事项:①因没有发生电子的得失,不能画弯箭号
②没有形成离子,不加中括号[ ],不标正负电荷数
碘
+
→
例4、用电子式表示下列共价分子的形成过程
· I
··
··
:
I ·
··
··
:
I
··
··
:
I
··
··
:
:
硫化氢
2 H ·
+
→
﹕
H S H
﹕
﹕
﹕
··
· S ·
··
过氧化氢
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的存在
一般非金属元素之间
一般活泼金属与非金属元素之间
阳离子 ~ 阴离子
原子 ~原子
静电作用
共用电子对
课堂小结
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
1、判断以下说法的正误
A、离子化合物一定含离子键,共价化合物一定含共价键。
B、含离子键的化合物一定为离子化合物。
C、金属元素与非金属元素之间一定形成离子键。
D、由非金属元素组成的化合物一定不含离子键。
E、有离子就一定可以形成离子键。
×
×
×
√
√
同步训练
2、某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键( )
A.一定是共价键
B.一定是离子键
C.可能是共价键,也可能是离子键
D.以上说法均不正确
C
3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
离子化合物
共价化合物
含共价键的离子化合物
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
4、判断下列化合物的类型:NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
谢谢观看
必修第一册
第四单元物质结构有元素周期律
第三节 化学键
第2课时共价键及共价化合物
复习回顾
[思考2]非金属元素的原子之间能形成离子键吗?为什么?
使阴阳离子结合成化合物的静电作用,叫做离子键。
阴阳离子
静电作用(静电吸引和静电排斥的平衡)
得、失电子
活泼金属元素与活泼非金属元素
1.概念
2.成键粒子
3.成键方式
4.成键本质
5.成键元素
带相反电荷离子之间的强烈相互作用
【思考2】为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
学
PART
01
PART
02
PART
03
核心素养发展目标
掌握共价键的形成过程和形成条件
了解共价键的概念及形成
了解共价化合物的不同表示方法,会用电子式表示共价化合物的形成过程。
H、Cl原子们,你们愿意各自拿出1个电子共用吗?
氯化氢的形成过程
愿意
愿意
共用电子对
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
愿意
愿意
电子
电子
Cl原子们,你们愿意各自拿出1个电子共用吗?
+17
Cl
共用电子对
+17
+17
通过共用电子对:
原子最外层电子数目
一般能达到稳定结构
Cl
+17
Cl2 的形成过程
原子之间通过共用电子对所形成的强烈相互作用
原 子
共用电子对
一、共价键
同种或不同种非金属元素原子之间
(稀有气体元素除外)。
1.概念
2.成键粒子
3.成键方式
4.成键本质
5.成键元素
电子的偏移
如:HCl、 CO2 、NH3、Cl2、 O3等
以共用电子对形成分子的化合物,叫共价化合物
二、共价键化合物
共价化合物类别:
④大多数有机化合物如甲烷、酒精等。
①非金属氢化物如HCl、H2O等;
②非金属氧化物如CO2、SO3等;
③酸如H2SO4、HNO3等;
非金属单质(H2、 O2 )
非金属氧化物(H2O、CO、CO2)
非金属氢化物(HCl、酸)
大多数有机化合物(CH4等)
某些离子化合物 (NaOH、 NH4Cl)
注意:
稀有气体单质中不存在共价键
三、共价键的存在:
例1、下列化合物中含有的化学键类型有哪些?
NaOH
O3
HCl
NH4NO3
共价键
即共价键又有离子键
共价键
即共价键又有离子键
共价键的两个“一定”和两个“不一定”
(1)两个“一定”
①共价化合物中一定 共价键;
②共价化合物中一定 离子键。
只含有
不含
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等;
②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O—H共价键,Na2O2中含有O—O共价键,NH4Cl中含有N—H共价键,但它们都是离子化合物。
四、共价键的分类
【思考3】Cl2和HCl都靠共价键形成的分子,其共价键是否相同呢?
Cl2
HCl
特
征
组成
原子吸引电子对能力
共用电子对位置
成键原子电性
结 论
同种原子
不同种原子
相同
不相同
不偏向任何一个原子
偏向吸引电子能力强的原子一方
不显电性
显电性
非极性键
极性键
+17
+17
+17
+1
非极性键:同种非金属原子间形成的共价键是非极性共价键,简称非极性键。
极性键:两种不同的非金属原子间形成的共价键是极性共价键,简称极性键。
成键元素相同A-A 型
成键元素不同A-B 型
【思考5】如何解释CO2中C显+4价,O显-2价?
CO2中C形成4个共用电子对,每个O形成2个共用电子对,O原子吸引电子的能力比C强,所以C显+4价,O显-2价
【思考4】已知过氧化氢的结构式为H—O—O—H,其中含有的共价键类型有什么?
极性键和非极性键
书写要求:
1、每个原子达到稳定结构
2、不用加括号[ ]
电子对是两原子共用的,并未形成离子,
因此共价化合物的电子式中没有“±”、“[ ]”等符号。
氢气
氯化氢
Cl Cl
:
:
:
:
:
:
:
氯气
水
﹕
H O H
﹕
﹕
﹕
H
H
.
五、共价键化合物的电子式
H2
HCl
N2
H2O
CO2
NH3
例3、书写下列共价键化合物的电子式
CO2 H2O CH4
电子式:
结构式:
O=C=O
结构模型:
H—O—H
C
H
H
H
H
常用 1 根短线“-”表示一对共用电子。
六、共价键化合物的结构式
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
★ 二氧化碳分子的形成:
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· C ·
·
·
+
··
· O ·
··
2
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
七、用电子式表示原子形成共价键的形成过程表示
注意事项:①因没有发生电子的得失,不能画弯箭号
②没有形成离子,不加中括号[ ],不标正负电荷数
碘
+
→
例4、用电子式表示下列共价分子的形成过程
· I
··
··
:
I ·
··
··
:
I
··
··
:
I
··
··
:
:
硫化氢
2 H ·
+
→
﹕
H S H
﹕
﹕
﹕
··
· S ·
··
过氧化氢
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的存在
一般非金属元素之间
一般活泼金属与非金属元素之间
阳离子 ~ 阴离子
原子 ~原子
静电作用
共用电子对
课堂小结
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
1、判断以下说法的正误
A、离子化合物一定含离子键,共价化合物一定含共价键。
B、含离子键的化合物一定为离子化合物。
C、金属元素与非金属元素之间一定形成离子键。
D、由非金属元素组成的化合物一定不含离子键。
E、有离子就一定可以形成离子键。
×
×
×
√
√
同步训练
2、某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键( )
A.一定是共价键
B.一定是离子键
C.可能是共价键,也可能是离子键
D.以上说法均不正确
C
3、下列说法正确的是( )
A、含有金属元素的化合物一定是离子化合物
B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
D
离子化合物
共价化合物
含共价键的离子化合物
NaOH
H2S
NaOH
MgCl2
H2SO4
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
4、判断下列化合物的类型:NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
谢谢观看
