化学人教版(2019)必修第一册4.3化学键(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3化学键(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 13:52:17 | ||
图片预览



文档简介
(共23张PPT)
化 学 键
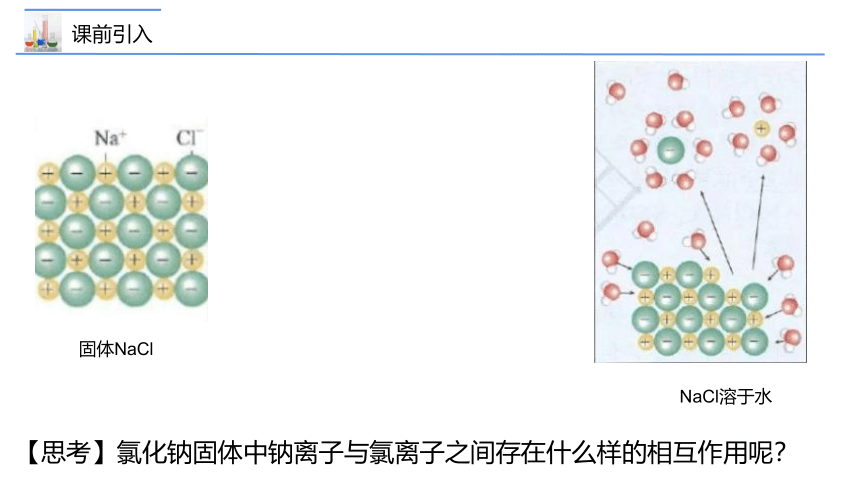
【思考】氯化钠固体中钠离子与氯离子之间存在什么样的相互作用呢?
固体NaCl
NaCl溶于水
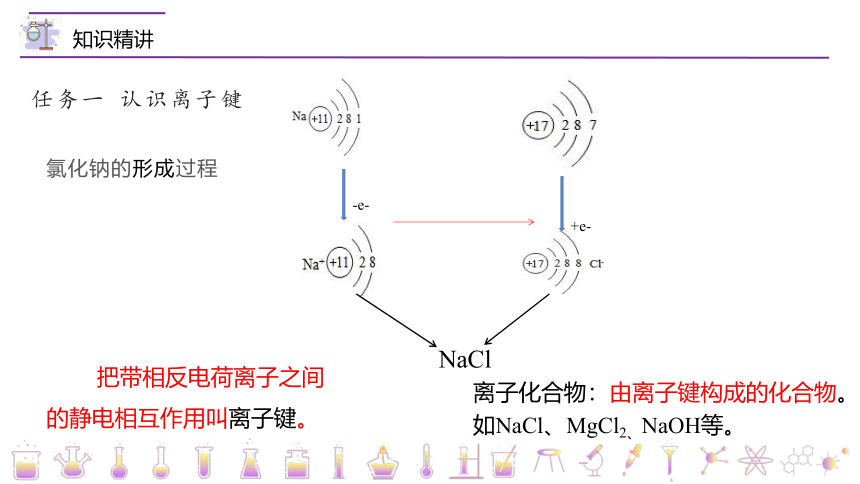
氯化钠的形成过程
任务一 认识离子键
NaCl
-e-
+e-
把带相反电荷离子之间的静电相互作用叫离子键。
离子化合物:由离子键构成的化合物。如NaCl、MgCl2、NaOH等。
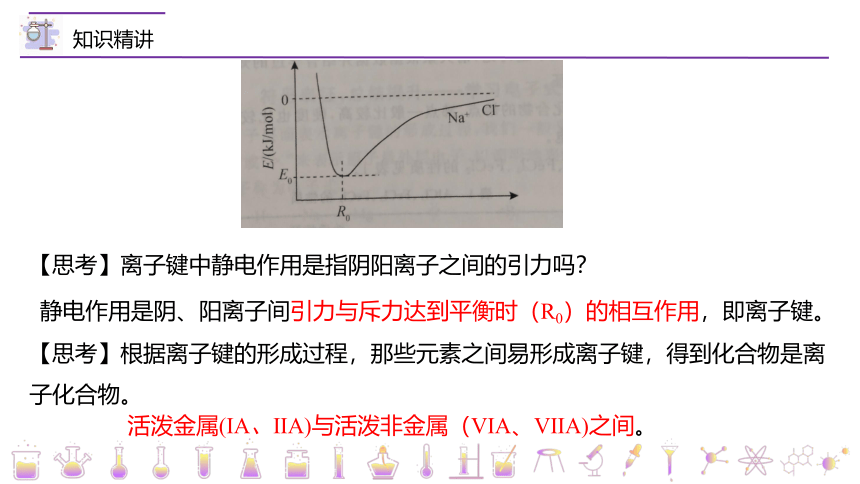
【思考】离子键中静电作用是指阴阳离子之间的引力吗?
静电作用是阴、阳离子间引力与斥力达到平衡时(R0)的相互作用,即离子键。
【思考】根据离子键的形成过程,那些元素之间易形成离子键,得到化合物是离子化合物。
活泼金属(ⅠA、ⅡA)与活泼非金属(ⅥA、ⅦA)之间。
任务二 电子式
用“×”或“ ”表示原子最外层电子(价电子)的图示。
顺时针依次在元素四方画出电子,每个方向不超过两个。
原子:
方法:
元素符号 + 最外层电子
Na
O
Na
×
O
· ·
·
·
· ·
离子:
方法:
简单阳离子:离子符号
简单阴离子:[ ] + 元素符号 + 最外层电子 + 所带电荷数
Na+
Na+
Cl-
[ Cl ]-
· ·
· ·
· ·
· ·
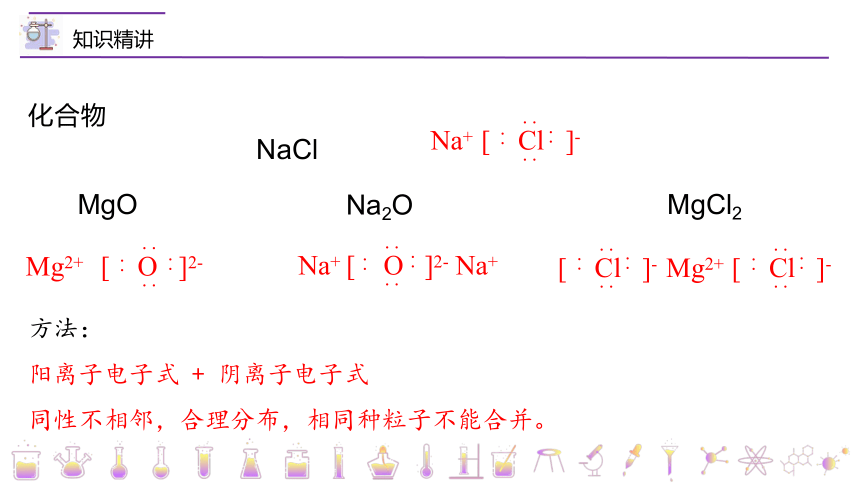
化合物
NaCl
MgO
Na2O
MgCl2
同性不相邻,合理分布,相同种粒子不能合并。
方法:
阳离子电子式 + 阴离子电子式
[ O ]2-
· ·
· ·
· ·
· ·
Na+
Na+
[ O ]2-
· ·
· ·
· ·
· ·
Mg2+
[ Cl ]-
· ·
· ·
· ·
· ·
Mg2+
[ Cl ]-
· ·
· ·
· ·
· ·
[ Cl ]-
· ·
· ·
· ·
· ·
Na+
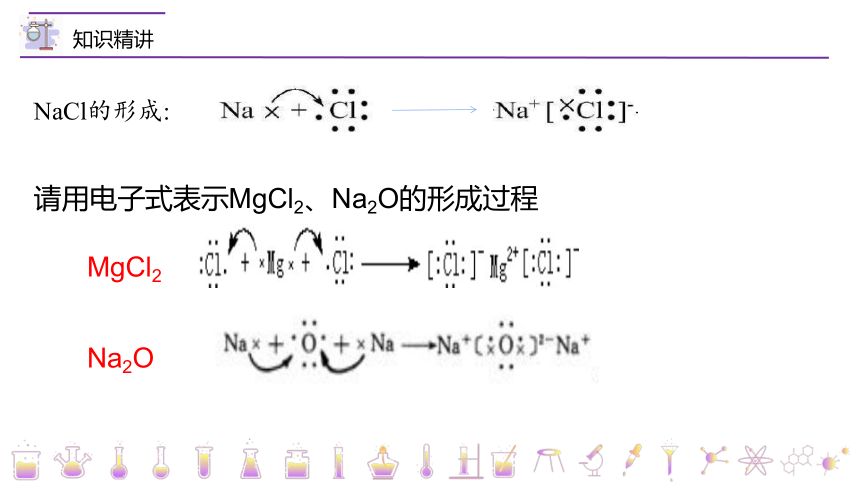
NaCl的形成:
请用电子式表示MgCl2、Na2O的形成过程
MgCl2
Na2O
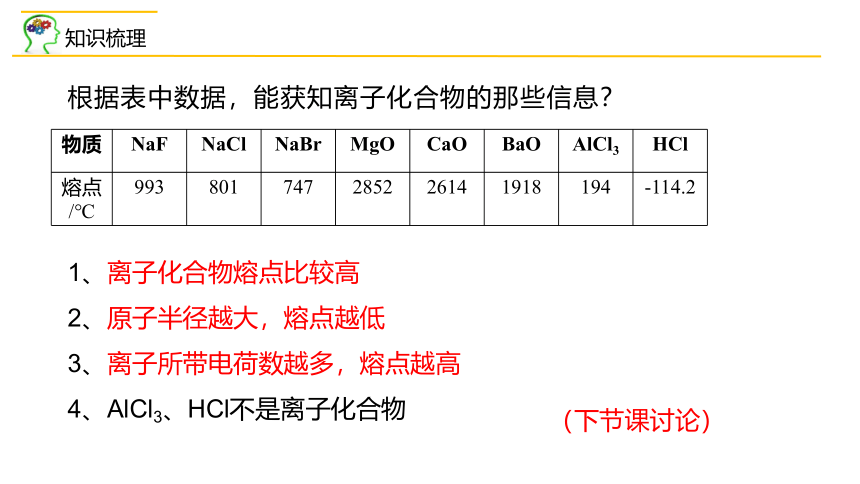
根据表中数据,能获知离子化合物的那些信息?
物质 NaF NaCl NaBr MgO CaO BaO AlCl3 HCl
熔点/℃ 993 801 747 2852 2614 1918 194 -114.2
1、离子化合物熔点比较高
2、原子半径越大,熔点越低
3、离子所带电荷数越多,熔点越高
4、AlCl3、HCl不是离子化合物
(下节课讨论)
+7
+7
+7
H2
Cl2
HCl
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
H
Cl
· ·
· ·
· ·
· ·
H
H
· ·
共用电子对
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
H
H
· ·
H Cl
· ·
· ·
· ·
· ·
共价键:原子间通过共用电子对所形成的相互作用。
共价化合物:只含有共价键的化合物。如HCl 、H2O、 CO2等
H-H
Cl-Cl
H-Cl
结构式:在化学上,常用一根“-”表示1对共用电子的图示。
任务三 认识共价键
【思考】氢原子与氯原子是如何达到稳定结构呢?
H2 + Cl2 === 2HCl
△
+
HCl的形成:
请用电子式表示H2、H2O、CO2的形成过程
H
H
H2
H2O
CO2
请写出H2、Cl2、N2、HCl、H2O、NH3、CH4的电子式与结构式,并回答下例问题。
H2
H
H
· ·
H-H
Cl2
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
Cl-Cl
N2
HCl
H Cl
· ·
· ·
· ·
· ·
H-Cl
H2O
NH3
CH4
1、你能归纳出共价键那些信息?
2、原子之间共用电子对都是平均共用吗?
3、C、N、O、Cl形成氢化物时,结合氢原子数目为何不同?
同种原子之间、不同种原子之间都能形成共价键;能形成单键、双键或三键
不是。
同种原子之间,由于原子吸电子能力相同,电子对不发生偏移。
不同种原子之间,由于原子吸电子能力不同,电子对偏向吸电子能力强的一方。
(非极性共价键,如H2)
(极性共价键,如HCl)
元素与氢原子结合的数目与该元素的最外层电子数有关。
【思考】物质的分子都是平面形吗?
CH4
H2O
CO2
HCl
正四面体
V形
直线形
直线形
物质分子具有一定空间构型
化学键
定义:化学上把相邻原子之间的强烈相互作用叫化学键。
化学键
离子键
共价键
极性共价键
非极性共价键
(不同种原子之间)
(同种原子之间)
活泼金属(ⅠA、ⅡA)与活泼非金属(ⅥA、ⅦA)之间
已知H2 + Cl2 =点燃= 2HCl,根据表中已知数据,你获得那些信息?
断开1molH-H 断开1molCl-Cl 生成1molH-Cl
kJ/mol 吸收436 吸收243 放出431
1、化学反应的本质是旧键断裂与新键生成的过程。
2、断键吸收能量,成键释放能量。
3、该反应为放热反应。
1molH2与molCl2反应放出183kJ
任务四 化学反应的本质
【思考】已知H2O在100℃沸腾形成水蒸气;当温度为1400℃时,H2O分解生成H2和O2,这说明什么?
水由液态变成气体,发生物理变化,说明分子之间存在作用力或氢键。
水分解生成氢气和氧气,发生化学变化,说明分子内部化学键被破坏。
分子之间存在作用力或氢键决定物质的熔沸点,分子间作用力决定分子的稳定性。
(范德华力)
说出物质的种类,及所含的化学键
物质 Na2O MgCl2 Na2O2 CH4 CO2 NaOH (NH4)2CO3
类别
含有化学键
离子化合物
离子化合物
离子化合物
离子化合物
离子化合物
共价化合物
共价化合物
离子键
离子键
离子键
离子键
离子键
非极性键
极性键
极性键
极性键
极性键
离子化合物中一定有离子键,可能有共价键;共价化合物中一定没离子键。
巩固练习
1. 写出下列物质的电子式:
①KCl _________ ; ②H2O2_________ ; ③ OH-_________ ;
④MgF2___________ ; ⑤CaO_________; ⑥NaOH___________
2.下列物质中,只含有非极性共价键的是( )。
A. NaOH B. NaCl C. H2 D.H2S
3.下列物质中,含有极性共价键的是( )。
A.单质碘 B.氯化镁 C.溴化钾 D.水
C
D
[ Cl ]-
· ·
· ·
· ·
· ·
K+
H O O H
· ·
· ·
· ·
· ·
· ·
· ·
· ·
[ O H]-
· ·
· ·
· ·
· ·
Na+
[ O H]-
· ·
· ·
· ·
· ·
[ O ]2-
· ·
· ·
· ·
· ·
Ca2+
[ F ]-
· ·
· ·
· ·
· ·
Mg2+
[ F ]-
· ·
· ·
· ·
· ·
巩固练习
4.下列各分子中,化学键类型有差异的是( )
A.H2O、CO2 B.MgF2、H2O2
C.NaOH、Ba(OH)2 D.NaCl、KCl
5.下列叙述正确的是( )
A、分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B、阴、阳离子通过静电引力所形成的化学键叫做离子键
C、非金属元素之间构成的化合物都不是离子化合物
D、离子化合物中一定含有离子键
B
D
巩固练习
7.下列关于化学键的说法中,不正确的是( )
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D.非极性键不是化学键
D
8.用电子式表示下列物质的形成过程。
(1)MgBr2
(2)Br2
Br
· ·
·
· ·
· ·
Br
· ·
·
· ·
· ·
+
Br Br
· ·
· ·
· ·
· ·
· ·
· ·
· ·
化 学 键
【思考】氯化钠固体中钠离子与氯离子之间存在什么样的相互作用呢?
固体NaCl
NaCl溶于水
氯化钠的形成过程
任务一 认识离子键
NaCl
-e-
+e-
把带相反电荷离子之间的静电相互作用叫离子键。
离子化合物:由离子键构成的化合物。如NaCl、MgCl2、NaOH等。
【思考】离子键中静电作用是指阴阳离子之间的引力吗?
静电作用是阴、阳离子间引力与斥力达到平衡时(R0)的相互作用,即离子键。
【思考】根据离子键的形成过程,那些元素之间易形成离子键,得到化合物是离子化合物。
活泼金属(ⅠA、ⅡA)与活泼非金属(ⅥA、ⅦA)之间。
任务二 电子式
用“×”或“ ”表示原子最外层电子(价电子)的图示。
顺时针依次在元素四方画出电子,每个方向不超过两个。
原子:
方法:
元素符号 + 最外层电子
Na
O
Na
×
O
· ·
·
·
· ·
离子:
方法:
简单阳离子:离子符号
简单阴离子:[ ] + 元素符号 + 最外层电子 + 所带电荷数
Na+
Na+
Cl-
[ Cl ]-
· ·
· ·
· ·
· ·
化合物
NaCl
MgO
Na2O
MgCl2
同性不相邻,合理分布,相同种粒子不能合并。
方法:
阳离子电子式 + 阴离子电子式
[ O ]2-
· ·
· ·
· ·
· ·
Na+
Na+
[ O ]2-
· ·
· ·
· ·
· ·
Mg2+
[ Cl ]-
· ·
· ·
· ·
· ·
Mg2+
[ Cl ]-
· ·
· ·
· ·
· ·
[ Cl ]-
· ·
· ·
· ·
· ·
Na+
NaCl的形成:
请用电子式表示MgCl2、Na2O的形成过程
MgCl2
Na2O
根据表中数据,能获知离子化合物的那些信息?
物质 NaF NaCl NaBr MgO CaO BaO AlCl3 HCl
熔点/℃ 993 801 747 2852 2614 1918 194 -114.2
1、离子化合物熔点比较高
2、原子半径越大,熔点越低
3、离子所带电荷数越多,熔点越高
4、AlCl3、HCl不是离子化合物
(下节课讨论)
+7
+7
+7
H2
Cl2
HCl
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
H
Cl
· ·
· ·
· ·
· ·
H
H
· ·
共用电子对
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
H
H
· ·
H Cl
· ·
· ·
· ·
· ·
共价键:原子间通过共用电子对所形成的相互作用。
共价化合物:只含有共价键的化合物。如HCl 、H2O、 CO2等
H-H
Cl-Cl
H-Cl
结构式:在化学上,常用一根“-”表示1对共用电子的图示。
任务三 认识共价键
【思考】氢原子与氯原子是如何达到稳定结构呢?
H2 + Cl2 === 2HCl
△
+
HCl的形成:
请用电子式表示H2、H2O、CO2的形成过程
H
H
H2
H2O
CO2
请写出H2、Cl2、N2、HCl、H2O、NH3、CH4的电子式与结构式,并回答下例问题。
H2
H
H
· ·
H-H
Cl2
Cl
· ·
· ·
· ·
Cl
· ·
· ·
· ·
· ·
Cl-Cl
N2
HCl
H Cl
· ·
· ·
· ·
· ·
H-Cl
H2O
NH3
CH4
1、你能归纳出共价键那些信息?
2、原子之间共用电子对都是平均共用吗?
3、C、N、O、Cl形成氢化物时,结合氢原子数目为何不同?
同种原子之间、不同种原子之间都能形成共价键;能形成单键、双键或三键
不是。
同种原子之间,由于原子吸电子能力相同,电子对不发生偏移。
不同种原子之间,由于原子吸电子能力不同,电子对偏向吸电子能力强的一方。
(非极性共价键,如H2)
(极性共价键,如HCl)
元素与氢原子结合的数目与该元素的最外层电子数有关。
【思考】物质的分子都是平面形吗?
CH4
H2O
CO2
HCl
正四面体
V形
直线形
直线形
物质分子具有一定空间构型
化学键
定义:化学上把相邻原子之间的强烈相互作用叫化学键。
化学键
离子键
共价键
极性共价键
非极性共价键
(不同种原子之间)
(同种原子之间)
活泼金属(ⅠA、ⅡA)与活泼非金属(ⅥA、ⅦA)之间
已知H2 + Cl2 =点燃= 2HCl,根据表中已知数据,你获得那些信息?
断开1molH-H 断开1molCl-Cl 生成1molH-Cl
kJ/mol 吸收436 吸收243 放出431
1、化学反应的本质是旧键断裂与新键生成的过程。
2、断键吸收能量,成键释放能量。
3、该反应为放热反应。
1molH2与molCl2反应放出183kJ
任务四 化学反应的本质
【思考】已知H2O在100℃沸腾形成水蒸气;当温度为1400℃时,H2O分解生成H2和O2,这说明什么?
水由液态变成气体,发生物理变化,说明分子之间存在作用力或氢键。
水分解生成氢气和氧气,发生化学变化,说明分子内部化学键被破坏。
分子之间存在作用力或氢键决定物质的熔沸点,分子间作用力决定分子的稳定性。
(范德华力)
说出物质的种类,及所含的化学键
物质 Na2O MgCl2 Na2O2 CH4 CO2 NaOH (NH4)2CO3
类别
含有化学键
离子化合物
离子化合物
离子化合物
离子化合物
离子化合物
共价化合物
共价化合物
离子键
离子键
离子键
离子键
离子键
非极性键
极性键
极性键
极性键
极性键
离子化合物中一定有离子键,可能有共价键;共价化合物中一定没离子键。
巩固练习
1. 写出下列物质的电子式:
①KCl _________ ; ②H2O2_________ ; ③ OH-_________ ;
④MgF2___________ ; ⑤CaO_________; ⑥NaOH___________
2.下列物质中,只含有非极性共价键的是( )。
A. NaOH B. NaCl C. H2 D.H2S
3.下列物质中,含有极性共价键的是( )。
A.单质碘 B.氯化镁 C.溴化钾 D.水
C
D
[ Cl ]-
· ·
· ·
· ·
· ·
K+
H O O H
· ·
· ·
· ·
· ·
· ·
· ·
· ·
[ O H]-
· ·
· ·
· ·
· ·
Na+
[ O H]-
· ·
· ·
· ·
· ·
[ O ]2-
· ·
· ·
· ·
· ·
Ca2+
[ F ]-
· ·
· ·
· ·
· ·
Mg2+
[ F ]-
· ·
· ·
· ·
· ·
巩固练习
4.下列各分子中,化学键类型有差异的是( )
A.H2O、CO2 B.MgF2、H2O2
C.NaOH、Ba(OH)2 D.NaCl、KCl
5.下列叙述正确的是( )
A、分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B、阴、阳离子通过静电引力所形成的化学键叫做离子键
C、非金属元素之间构成的化合物都不是离子化合物
D、离子化合物中一定含有离子键
B
D
巩固练习
7.下列关于化学键的说法中,不正确的是( )
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D.非极性键不是化学键
D
8.用电子式表示下列物质的形成过程。
(1)MgBr2
(2)Br2
Br
· ·
·
· ·
· ·
Br
· ·
·
· ·
· ·
+
Br Br
· ·
· ·
· ·
· ·
· ·
· ·
· ·
