2022-2023学年高一上学期化学鲁科版(2019)选择性必修2 2.3.2离子晶体 (共27张PPT)
文档属性
| 名称 | 2022-2023学年高一上学期化学鲁科版(2019)选择性必修2 2.3.2离子晶体 (共27张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 00:00:00 | ||
图片预览




文档简介
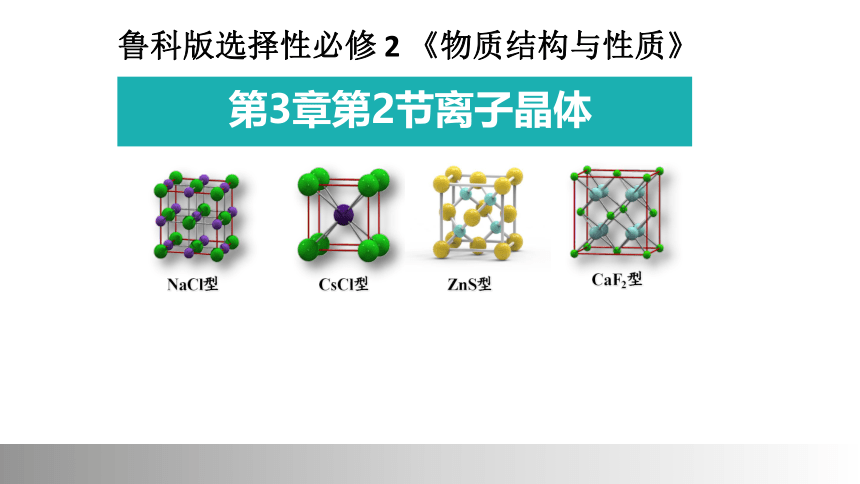
(共27张PPT)
第3章第2节离子晶体
鲁科版选择性必修 2 《物质结构与性质》
CaF2型
NaCl型
CsCl型
ZnS型
学习目标
1、借助氯化钠、氯化铯、硫化锌、氟化钙的模型认识离子晶体的结构特征。
发展证据推理与模型认知的化学核心素养。
2、知道晶格能的概念,能用晶格能解释离子晶体的性质。发展宏观辨析与
微观探析的核心素养。
3、认识实际晶体的复杂性,能将晶体结构与物质应用联系起来,发展实验
探究与创新意识的核心素养。
乳山市银滩高中
乳山市银滩高中
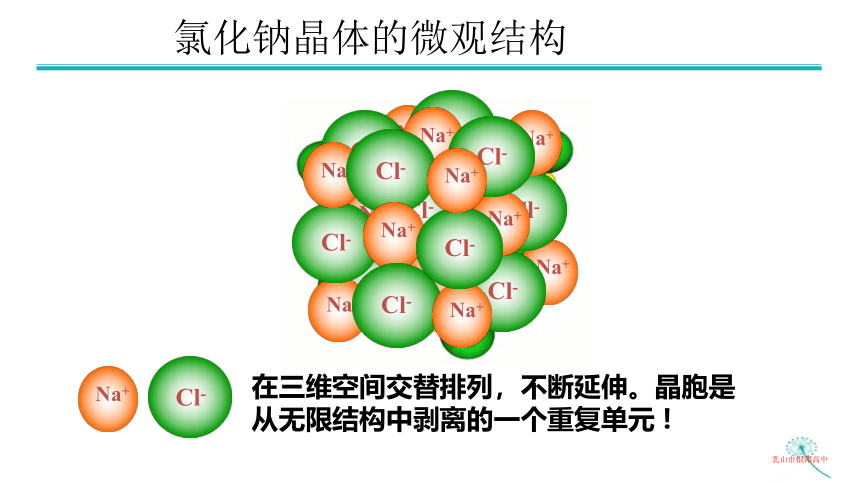
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
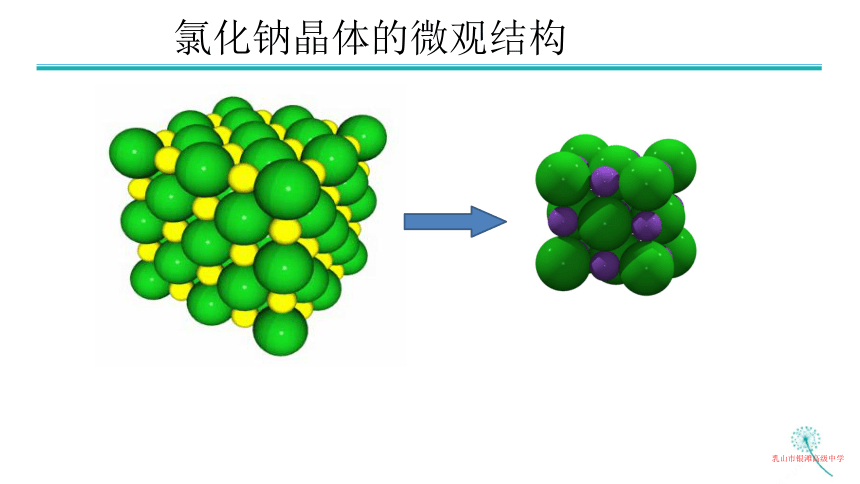
氯化钠晶体的微观结构
乳山市银滩高中
Na+
Cl-
在三维空间交替排列,不断延伸。晶胞是从无限结构中剥离的一个重复单元 !
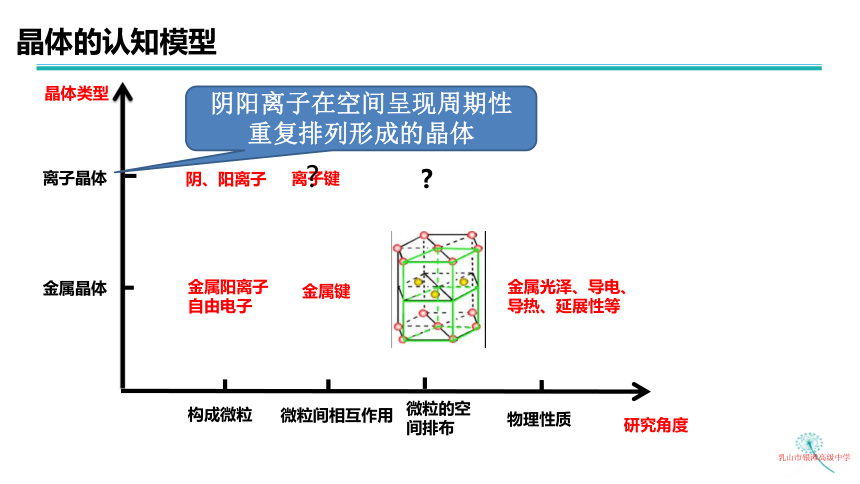
晶体的认知模型
晶体类型
研究角度
乳山市银滩高级中学
构成微粒
微粒间相互作用
微粒的空间排布
物理性质
金属晶体
离子晶体
金属阳离子
自由电子
金属键
金属光泽、导电、
导热、延展性等
阴、阳离子
离子键
阴阳离子在空间呈现周期性
重复排列形成的晶体
氯化钠晶体的微观结构
乳山市银滩高中
乳山市银滩高级中学
乳山市银滩高中
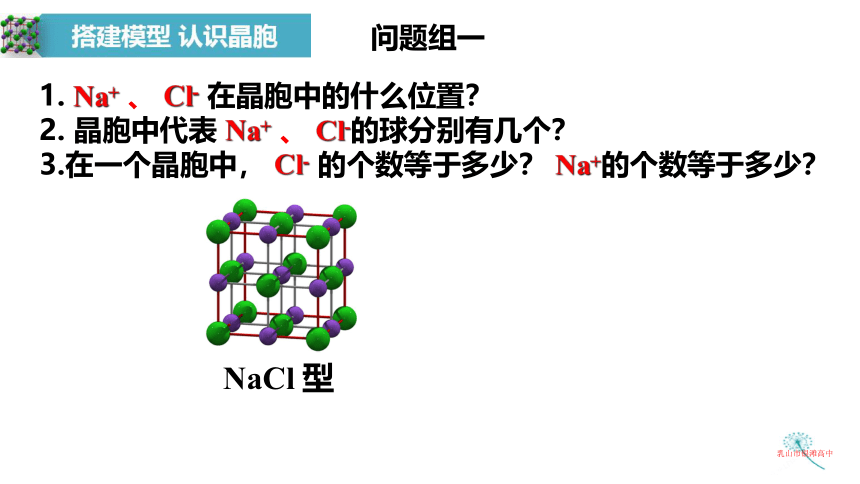
问题组一
1. Na+ 、 Cl- 在晶胞中的什么位置?
2. 晶胞中代表 Na+ 、 Cl-的球分别有几个?
3.在一个晶胞中, Cl- 的个数等于多少? Na+的个数等于多少?
NaCl 型
NaCl型
Cl-位于顶点和面心
Na+位于棱心和体心
4个Cl-, 4个Na+
1. 粒子位置:
2. 一个晶胞中含:
Cl-
Na+
8× = 1
6 × = 3
1 × 1 = 1
12 × = 3
8个顶点:
6个面心:
1个体心:
12条棱上:
Cl-
Na+
在NaCl晶体中,是否存在单独“NaCl”分子?
乳山市银滩高中
乳山市银滩高中
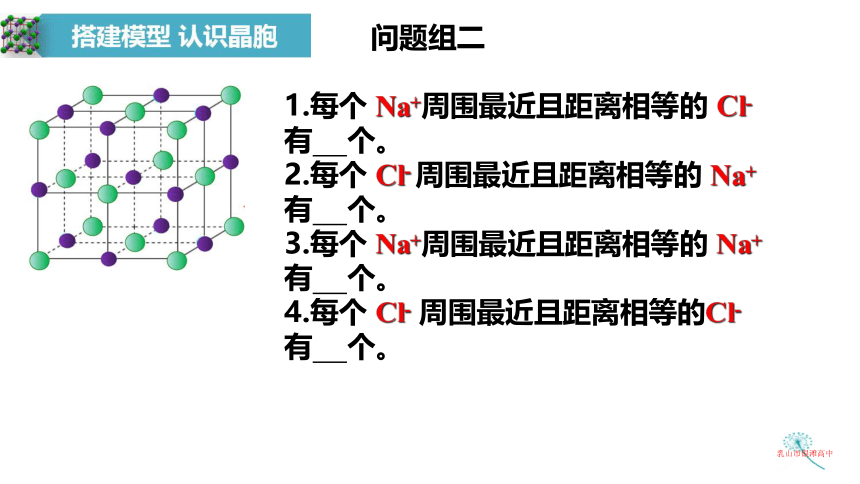
问题组二
1.每个 Na+周围最近且距离相等的 Cl- 有 个。
2.每个 Cl- 周围最近且距离相等的 Na+ 有 个。
3.每个 Na+周围最近且距离相等的 Na+有 个。
4.每个 Cl- 周围最近且距离相等的Cl-
有 个。
每个Cl-周围与之最接近且距离相等的Na+共有 个。
6
6个Cl-连线形成的空间几何构型是
正八面体
每个Na+周围与之最接近且距离相等的Cl-共有 个。
6个Na+连线形成的空间几何构型是
正八面体
离子晶体中离子的配位数:
是指一个离子周围最邻近的异电性离子的数目。
乳山市银滩高中
6
八面体空隙填入正离子
NaCl的微观结构特征
面心立方
最密堆积
每个Na+周围最近的Na+有几个:
每个 Cl-周围最近的Cl-有几个:
12
12
乳山市银滩高中
8
CsCl型
1. Cs+、Cl- 分别在晶胞中的什么位置?
2.一个晶胞中Cs+和Cl-的个数:
3. Cs+周围最近且距离相等的Cl-个数:
Cl-周围最近且距离相等的Cs+ 个数:
4. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
5. Cs+、Cl- 之间的最短距离b与晶胞边长a的关系
6
6
Cl-
Cs+
8
问题组三
1
乳山市银滩高中
1. 粒子位置:
2. 微粒数:
3. 正负离子配位数比:
CaF2晶胞
Ca2+位于顶点和面心
F-位于立方体内
Ca2+
F-
4个Ca2+,8个F-
Ca2+
F-
F- 配位数:
配位Ca2+的几何图形:
8:4
Ca2+配位数:
配位F-的几何图形:
8
立方体
4
正四面体
乳山市银滩高中
问题组四
ZnS型
1. ZnS晶胞中微粒的位置?
一个晶胞中Zn2+和S2-的个数:
2. Zn2+的配位数:
3. S2-的配位数:
4. S2-周围最近且距离相等的S2-个数:
5. Zn2+ 、 S2-之间的最短距离b与晶胞边长a的关系
乳山市银滩高中
乳山市银滩高中
【问题探究】
为什么同为AB型离子晶体,配位数不同
离子晶体 阴离子的配位数 阳离子的配位数 阴阳离子配位 数的比值
NaCl型
ZnS型
CsCl型
4
4
8
8
6
6
1:1
1:1
1:1
当堂达标检测
高温下,超氧化钾晶体(KO2)呈立方体结构。如下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,
每个晶胞含有1个K+和1个O2-
C.晶体中与每个K+距离最近的O2-有6个
D.晶体中,所有原子之间都以离子键相结合
C
乳山市银滩高中
离子晶体的用途
乳山市银滩高中
已投入使用的半导体除了硅、锗单晶外,许多半导体晶体都是ZnS型。且以闪锌
矿为主,利用这一结构可以研发出一系列的半导体材料。
离子晶体的用途
乳山市银滩高中
钙钛矿型太阳能电池被评为2013年10大科学突破之一,可以提高光电转化效率。
【问题探究】离子晶体结构与性质的关系
NaCl MgO
熔点 /℃ 801 2800
沸点 /℃ 1413 3600
思考:结构相似的离子晶体,为什么熔沸点仍存在差异?
思考:离子键的强弱通常用什么来衡量?
晶格能
乳山市银滩高中
离子键的强弱不同
2、晶格能
【问题探究】离子晶体结构与性质的关系
将1mol 离子晶体完全气化为阴、阳离子所吸收的能量。
NaCl (s) = Na+ (g) + Cl- (g)
U = 787kJ/mol
(在一定程度上可以用来衡量离子键的强弱)
(1)定义:
思考:影响晶格能大小的因素是什么?
乳山市银滩高中
影响晶格能大小的因素
根据表中数据,你能得出什么结论?
②离子半径越小,所带电荷数越多,晶格能越大
①离子电荷一定时,离子半径越大,晶格能越小
③晶格能越大,离子晶体的熔点越高,硬度越大
【交流研讨】
乳山市银滩高中
晶格能的应用
乳山市银滩高中
1.晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬
度越大。
2.岩浆晶出规则与晶格能的关系。
离子晶体的应用
乳山市银滩高中
优点: 化学稳定性好、熔点较低、对无机物、有机化合物和聚合物的良好溶解性 。
应用:有机合成、聚合反应、分离提纯以及电化学研究。
晶体的认知模型
晶体类型
研究角度
乳山市银滩高级中学
构成微粒
微粒间相互作用
微粒的空间排布
物理性质
金属晶体
离子晶体
金属阳离子
自由电子
金属键
金属光泽、导电、导热延展性等
阴、阳离子
离子键
氢键
范德华力
熔点、
沸点
晶格能
乳山市银滩高级中学
录制时间:2021.11.20
第3章第2节离子晶体
鲁科版选择性必修 2 《物质结构与性质》
CaF2型
NaCl型
CsCl型
ZnS型
学习目标
1、借助氯化钠、氯化铯、硫化锌、氟化钙的模型认识离子晶体的结构特征。
发展证据推理与模型认知的化学核心素养。
2、知道晶格能的概念,能用晶格能解释离子晶体的性质。发展宏观辨析与
微观探析的核心素养。
3、认识实际晶体的复杂性,能将晶体结构与物质应用联系起来,发展实验
探究与创新意识的核心素养。
乳山市银滩高中
乳山市银滩高中
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
氯化钠晶体的微观结构
乳山市银滩高中
Na+
Cl-
在三维空间交替排列,不断延伸。晶胞是从无限结构中剥离的一个重复单元 !
晶体的认知模型
晶体类型
研究角度
乳山市银滩高级中学
构成微粒
微粒间相互作用
微粒的空间排布
物理性质
金属晶体
离子晶体
金属阳离子
自由电子
金属键
金属光泽、导电、
导热、延展性等
阴、阳离子
离子键
阴阳离子在空间呈现周期性
重复排列形成的晶体
氯化钠晶体的微观结构
乳山市银滩高中
乳山市银滩高级中学
乳山市银滩高中
问题组一
1. Na+ 、 Cl- 在晶胞中的什么位置?
2. 晶胞中代表 Na+ 、 Cl-的球分别有几个?
3.在一个晶胞中, Cl- 的个数等于多少? Na+的个数等于多少?
NaCl 型
NaCl型
Cl-位于顶点和面心
Na+位于棱心和体心
4个Cl-, 4个Na+
1. 粒子位置:
2. 一个晶胞中含:
Cl-
Na+
8× = 1
6 × = 3
1 × 1 = 1
12 × = 3
8个顶点:
6个面心:
1个体心:
12条棱上:
Cl-
Na+
在NaCl晶体中,是否存在单独“NaCl”分子?
乳山市银滩高中
乳山市银滩高中
问题组二
1.每个 Na+周围最近且距离相等的 Cl- 有 个。
2.每个 Cl- 周围最近且距离相等的 Na+ 有 个。
3.每个 Na+周围最近且距离相等的 Na+有 个。
4.每个 Cl- 周围最近且距离相等的Cl-
有 个。
每个Cl-周围与之最接近且距离相等的Na+共有 个。
6
6个Cl-连线形成的空间几何构型是
正八面体
每个Na+周围与之最接近且距离相等的Cl-共有 个。
6个Na+连线形成的空间几何构型是
正八面体
离子晶体中离子的配位数:
是指一个离子周围最邻近的异电性离子的数目。
乳山市银滩高中
6
八面体空隙填入正离子
NaCl的微观结构特征
面心立方
最密堆积
每个Na+周围最近的Na+有几个:
每个 Cl-周围最近的Cl-有几个:
12
12
乳山市银滩高中
8
CsCl型
1. Cs+、Cl- 分别在晶胞中的什么位置?
2.一个晶胞中Cs+和Cl-的个数:
3. Cs+周围最近且距离相等的Cl-个数:
Cl-周围最近且距离相等的Cs+ 个数:
4. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
5. Cs+、Cl- 之间的最短距离b与晶胞边长a的关系
6
6
Cl-
Cs+
8
问题组三
1
乳山市银滩高中
1. 粒子位置:
2. 微粒数:
3. 正负离子配位数比:
CaF2晶胞
Ca2+位于顶点和面心
F-位于立方体内
Ca2+
F-
4个Ca2+,8个F-
Ca2+
F-
F- 配位数:
配位Ca2+的几何图形:
8:4
Ca2+配位数:
配位F-的几何图形:
8
立方体
4
正四面体
乳山市银滩高中
问题组四
ZnS型
1. ZnS晶胞中微粒的位置?
一个晶胞中Zn2+和S2-的个数:
2. Zn2+的配位数:
3. S2-的配位数:
4. S2-周围最近且距离相等的S2-个数:
5. Zn2+ 、 S2-之间的最短距离b与晶胞边长a的关系
乳山市银滩高中
乳山市银滩高中
【问题探究】
为什么同为AB型离子晶体,配位数不同
离子晶体 阴离子的配位数 阳离子的配位数 阴阳离子配位 数的比值
NaCl型
ZnS型
CsCl型
4
4
8
8
6
6
1:1
1:1
1:1
当堂达标检测
高温下,超氧化钾晶体(KO2)呈立方体结构。如下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 ( )
A.KO2中只存在离子键
B.超氧化钾的化学式为KO2,
每个晶胞含有1个K+和1个O2-
C.晶体中与每个K+距离最近的O2-有6个
D.晶体中,所有原子之间都以离子键相结合
C
乳山市银滩高中
离子晶体的用途
乳山市银滩高中
已投入使用的半导体除了硅、锗单晶外,许多半导体晶体都是ZnS型。且以闪锌
矿为主,利用这一结构可以研发出一系列的半导体材料。
离子晶体的用途
乳山市银滩高中
钙钛矿型太阳能电池被评为2013年10大科学突破之一,可以提高光电转化效率。
【问题探究】离子晶体结构与性质的关系
NaCl MgO
熔点 /℃ 801 2800
沸点 /℃ 1413 3600
思考:结构相似的离子晶体,为什么熔沸点仍存在差异?
思考:离子键的强弱通常用什么来衡量?
晶格能
乳山市银滩高中
离子键的强弱不同
2、晶格能
【问题探究】离子晶体结构与性质的关系
将1mol 离子晶体完全气化为阴、阳离子所吸收的能量。
NaCl (s) = Na+ (g) + Cl- (g)
U = 787kJ/mol
(在一定程度上可以用来衡量离子键的强弱)
(1)定义:
思考:影响晶格能大小的因素是什么?
乳山市银滩高中
影响晶格能大小的因素
根据表中数据,你能得出什么结论?
②离子半径越小,所带电荷数越多,晶格能越大
①离子电荷一定时,离子半径越大,晶格能越小
③晶格能越大,离子晶体的熔点越高,硬度越大
【交流研讨】
乳山市银滩高中
晶格能的应用
乳山市银滩高中
1.晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬
度越大。
2.岩浆晶出规则与晶格能的关系。
离子晶体的应用
乳山市银滩高中
优点: 化学稳定性好、熔点较低、对无机物、有机化合物和聚合物的良好溶解性 。
应用:有机合成、聚合反应、分离提纯以及电化学研究。
晶体的认知模型
晶体类型
研究角度
乳山市银滩高级中学
构成微粒
微粒间相互作用
微粒的空间排布
物理性质
金属晶体
离子晶体
金属阳离子
自由电子
金属键
金属光泽、导电、导热延展性等
阴、阳离子
离子键
氢键
范德华力
熔点、
沸点
晶格能
乳山市银滩高级中学
录制时间:2021.11.20
