2022-2023学年人教版九年级化学下册 第1-8单元综合复习测试题(三)(含答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 第1-8单元综合复习测试题(三)(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 304.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 10:02:41 | ||
图片预览



文档简介
第1-8单元综合复习测试题(三)
一、选择题
1.古诗词是中国传统文化的瑰宝。下列古诗词中蕴含着化学变化的是( )
A.野火烧不尽,春风吹又生
B.夜来风雨声,花落知多少
C.忽如一夜春风来,千树万树梨花开
D.宝剑锋从磨砺出,梅花香自苦寒来
2.下列化学仪器对应的名称正确的是( )
A.燃烧匙 B.分液漏斗 C. 试管夹 D.烧杯
3.如图是用红磷燃烧法测定空气里氧气含量的装置图,有关此实验的结论与分析错误的是( )
A.此实验证明,氧气约占空气体积的
B.此实验证明,反应后组气瓶内剩余的气体,既不易溶于水,也不支持燃烧
C.该实验中的红磷还可以用硫来代替
D..若该实验没有达到预期目的,可能的原因之一是装置气密性不好造成的
4.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
5.化学的学习使我们学会了从微观的角度认识宏观现象,下列对宏观现象解释不正确的是( )
A.干冰升华——分子的体积变大
B.闻到远处花香——分子在不断地运动
C.水变为水蒸气体积变大——分子间间隔增大
D.氧化汞受热分解——分子在化学变化中可以再分
6.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数X>Y
B.核外电子数X=Z
C.Y和Z处于同一周期
D.X和Z的电子层数相同
7.一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如图所示。
下列说法不正确的是( )
A.反应前后分子种类改变
B.反应前后原子种类不变
C.反应前后氧元素质量减小
D.生成物丙和丁的分子个数比为3﹕4
8.下列化学符号或符号中“2”的含义表述正确的是( )
A.2H——2个氢元素
B.O2——2个氧原子
C.2N2——2个氮分子
D.CO2——二氧化碳中含有2个氧原子
9.“环境就是民生,青山就是美丽,蓝天也是幸福”。习近平在十二届人大三次会议上提出了民生视角下的生态观,要求全面落实“水十条”。下列做法中不符合这一主题的是( )
A.严格监管农药和化肥的使用 B.富含氮、磷的生活污水直接排放
C.对水源地和自然保护区的水体严格保护 D.农田灌溉使用喷灌、滴灌技术
10.已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是( )
A.X氧化物的化学式只能表示为XO B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在 D.三种金属的活动性顺序:X>Y>Z
11.孔明灯燃气的火焰温度可达300℃,但纸质灯罩却没被点燃的原因是( )
A.纸张不是可燃物,不能燃烧
B.空气不充足,纸张不会燃烧
C.风将热量吹散使灯罩处温度低于纸的着火点
D.风将热量吹散后灯罩的着火点降低了
12.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
下列说法正确的是( )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7﹕8
二、非选择题
13.多角度认识物质能帮助我们更全面地了解物质世界。以金属为例回答下列问题:
(1)认识金属元素的存在
①在自然界中,大多数金属以化合物存在,而金、铂等极少数金属因为化学性质_____(填“活泼”或“不活泼”)却能以单质存在。
②常见铁矿石有:黄铁矿(主要成分FeS2)、磁铁矿(主要成分Fe3O4)等。这两种铁矿石的主要成分含铁元素质量分数较大的是_____。
(2)认识金属的性质 用粗木棍在涂有蜡的锌板上写“龙”、“湖”两个字,露出下面的锌板。向“龙”字上滴加稀盐酸,向“湖”字上滴加CuSO4溶液。
龙 湖
①“龙”字上的现象是_________。
②“湖”字上有红色物质析出,用化学方程式解释:_________。
(3)认识金属的制备,工业上,金属钨(W)可由氢气和三氧化钨(WO3)在高温下发生置换反应制得。 反应中化合价升高的元素是_________。
(4)认识金属的用途烤制食物时常用到铝箔,主要利用了金属铝的_____ (填性质)。
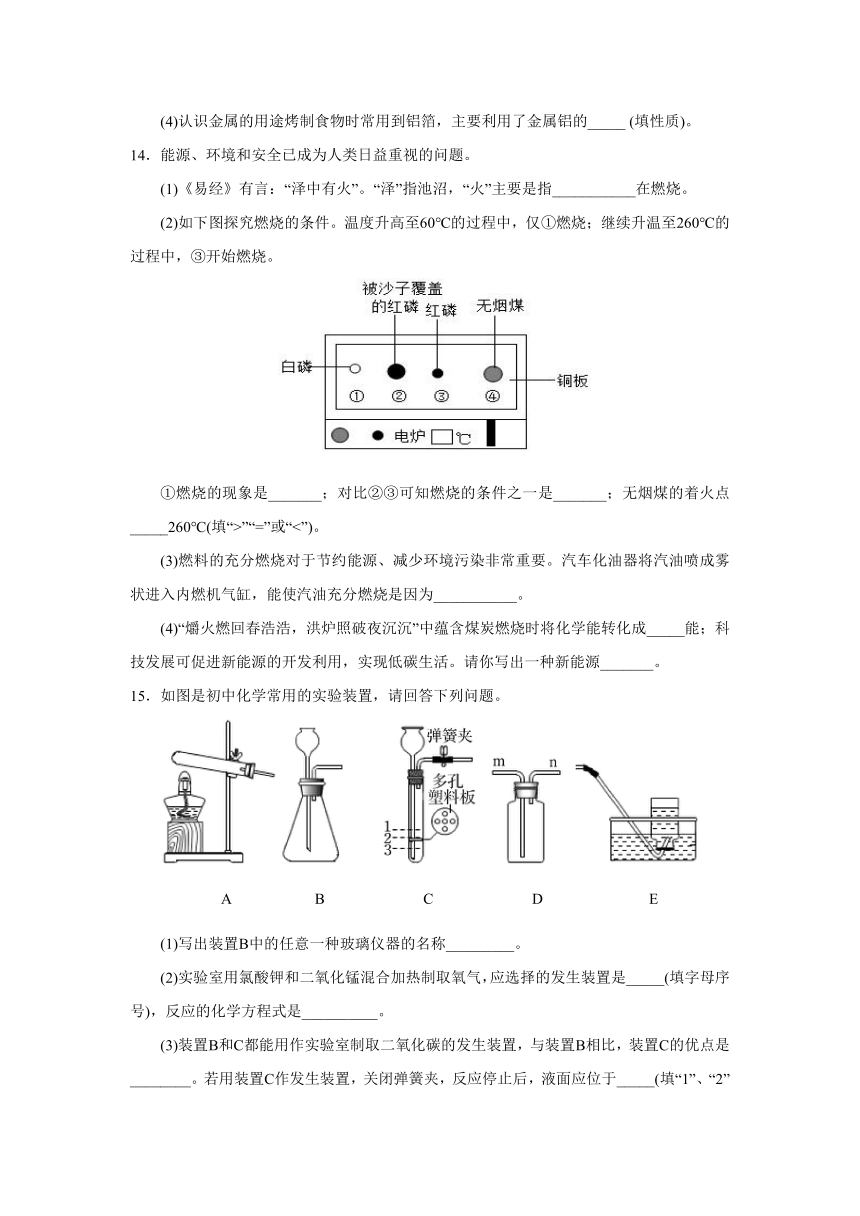
14.能源、环境和安全已成为人类日益重视的问题。
(1)《易经》有言:“泽中有火”。“泽”指池沼,“火”主要是指___________在燃烧。
(2)如下图探究燃烧的条件。温度升高至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,③开始燃烧。
①燃烧的现象是_______;对比②③可知燃烧的条件之一是_______;无烟煤的着火点_____260℃(填“>”“=”或“<”)。
(3)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,能使汽油充分燃烧是因为___________。
(4)“爝火燃回春浩浩,洪炉照破夜沉沉”中蕴含煤炭燃烧时将化学能转化成_____能;科技发展可促进新能源的开发利用,实现低碳生活。请你写出一种新能源_______。
15.如图是初中化学常用的实验装置,请回答下列问题。
A B C D E
(1)写出装置B中的任意一种玻璃仪器的名称_________。
(2)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选择的发生装置是_____(填字母序号),反应的化学方程式是__________。
(3)装置B和C都能用作实验室制取二氧化碳的发生装置,与装置B相比,装置C的优点是________。若用装置C作发生装置,关闭弹簧夹,反应停止后,液面应位于_____(填“1”、“2”或“3”)处。
(4)若用装置D收集二氧化碳,气体应从_____(填“m”或“n”)端进入。
(5)小红同学用装置E收集了一瓶氧气,测得氧气浓度偏低,原因可能是_____(填序号)
a.收集气体前,集气瓶中没有注满水 b.导管口开始有气泡冒出,立刻收集
c.收集气体后,集气瓶中仍有少量水 d.收集气体后,集气瓶正放在桌面上
(6)以下是化学教材中的几个实验,请据图回答问题。
实验一、二、三中都要在集气瓶中放少量的水。实验一中水的作用是吸收二氧化硫,防止污染空气,由此推测,二氧化硫具有的物理性质之一是______;在“实验一”“实验二”“实验三”中,可以把水换成细沙的实验是_____________。
实验一 实验二 实验三
16.某化学小组同学收集到一些铝制易拉罐,将其剪成条状并打磨,与铝片进行相互刻画,发现纯铝片表面有划痕。
(提出问题)通过分析上述现象,同学们认为该易拉罐不是纯铝制作的,因为合金的硬度比组成它的纯金属硬度更______。那么易拉罐中除铝外,还含有什么金属呢?
(查阅资料)①铝制易拉罐中的主要成分是铝,可能还含有铁、铜等。
②常温下铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铁和铜都不能与氢氧化钠溶液反应。
(作出猜想)该易拉罐的金属组成除铝外,可能还含有铁和铜中的一种或两种。
(实验探究)小明取打磨后的铝制易拉罐样品按如下方案进行实验:
实验步骤 实验现象 解释与结论
(1)取一定量的样品于烧杯中,加入足量的 溶液 ________,烧杯底部有固体剩余 样品中含铝
(2)另取一定量的样品于烧杯中,加入足量的稀盐酸。 样品逐渐溶解,表面有大量气泡生成,溶液变成__________色,充分 反应后试管底部仍有部分不溶物。 样品中含铁,反应的化学方程式为:_______。
(3)将(2)中得到的不溶物洗涤、干燥,向其中加入AgNO3溶液。 溶液由无色变成浅蓝色。 样品中含铜,反应的化学方程式为_________。
(实验结论)该易拉罐组成金属包括铝、铁和铜。
(拓展应用)铝制品被大量使用,其中一个重要原因是铝具有良好的抗腐蚀性能,铝具有良好的抗腐蚀性能的原因是: ________。图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有 (填序号)图标的垃圾桶内。
17.二氧化碳是导致温室效应的气体,也是一种宝贵的资源。
I .超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程如下:
(1)乳化池中,生石灰与水发生反应,化学方程式为_____________________________。该反应为_________反应(填“放热”或“吸热”)
(2)与“过筛”原理相同的基本实验操作是___________。
(3)碳化塔中反应的化学方程式为____________________。
Ⅱ.为解决温室效应加剧问题,同时实现光能转化为所需能量的目的,科学家正在研究二氧化碳新的应用技术,示意图如下:
(4)已知反应①为分解反应,写出反应的化学方程式:___________________。
(5)已知反应②为化合反应,推断化合物甲含_________元素。
(6)该体系中循环利用的物质是___________。
18.小红为了测定如下图的钙片中碳酸钙的含量标注是否属实,她取出5片钙片(每片2.5克),研碎后放入烧杯中,把30g稀盐酸分3次加入烧杯中进行反应(假定钙片其它成分不与盐酸反应),每次充分反应后得到的实验数据如表:
实验编号 1 2 3
稀盐酸的用量 10g 20g 30g
二氧化碳的质量 1.1g 2.2g 2.75g
(1)碳酸钙中碳元素的质量分数是_______。
(2)5片钙片完全反应可生成二氧化碳的质量为________。
(3)①计算5片钙片中含有碳酸钙的质量(写出计算过程)
②由上题计算可知,标签中碳酸钙的含量标注________(填“属实”或“不属实”)。
(4)在下图画出产生气体与所加盐酸溶液质量关系的曲线图。
答案
1-12 A A C D A C C C B D C D
13.不活泼 Fe3O4 (2分) 冒气泡 Zn+CuSO4=Cu+ZnSO4 氢元素 导热性和延展性
(答对1个就给分)
14.沼气(甲烷/CH4) 白磷燃烧产生大量白烟,放热 与氧气接触 > 增大汽油与氧气的接触面积 光和热(只写光或热不给分) 氢能、核能、太阳能、生物质能、地热能、潮汐能等(填一种即可)
15.(1)长颈漏斗(或锥形瓶、导管) (2) A 2KClO32KCl+3O2↑
(3) 可以控制反应的发生和停止 3 (4)m (5) ab(全对才给1分) (6)易溶于水 实验二
16.大 氢氧化钠 样品逐渐溶解,表面有气泡生成 浅绿 Fe+2HCl=FeCl2+H2↑
Cu+2AgNO3=2Ag+Cu(NO3)2 铝表面易生成致密的氧化膜 B
17.CaO+H2O=Ca(OH)2 放热 过滤 Ca(OH)2+CO2=CaCO3↓+H2O
碳、氢、氧 CO2
18.(1)40%(1分) (2)2.75g (1分)
(3)①解:设5片钙片中含有碳酸钙的质量为x,
……(1分)
答:5片钙片中含有碳酸钙的质量为6.25g
②标注属实。(2分)
(4) 见右图
一、选择题
1.古诗词是中国传统文化的瑰宝。下列古诗词中蕴含着化学变化的是( )
A.野火烧不尽,春风吹又生
B.夜来风雨声,花落知多少
C.忽如一夜春风来,千树万树梨花开
D.宝剑锋从磨砺出,梅花香自苦寒来
2.下列化学仪器对应的名称正确的是( )
A.燃烧匙 B.分液漏斗 C. 试管夹 D.烧杯
3.如图是用红磷燃烧法测定空气里氧气含量的装置图,有关此实验的结论与分析错误的是( )
A.此实验证明,氧气约占空气体积的
B.此实验证明,反应后组气瓶内剩余的气体,既不易溶于水,也不支持燃烧
C.该实验中的红磷还可以用硫来代替
D..若该实验没有达到预期目的,可能的原因之一是装置气密性不好造成的
4.保护金属资源的有效途径,不包括下列的( )
A.合理开采矿物 B.寻找金属替代品
C.回收利用金属 D.禁止使用铁制品
5.化学的学习使我们学会了从微观的角度认识宏观现象,下列对宏观现象解释不正确的是( )
A.干冰升华——分子的体积变大
B.闻到远处花香——分子在不断地运动
C.水变为水蒸气体积变大——分子间间隔增大
D.氧化汞受热分解——分子在化学变化中可以再分
6.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数X>Y
B.核外电子数X=Z
C.Y和Z处于同一周期
D.X和Z的电子层数相同
7.一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如图所示。
下列说法不正确的是( )
A.反应前后分子种类改变
B.反应前后原子种类不变
C.反应前后氧元素质量减小
D.生成物丙和丁的分子个数比为3﹕4
8.下列化学符号或符号中“2”的含义表述正确的是( )
A.2H——2个氢元素
B.O2——2个氧原子
C.2N2——2个氮分子
D.CO2——二氧化碳中含有2个氧原子
9.“环境就是民生,青山就是美丽,蓝天也是幸福”。习近平在十二届人大三次会议上提出了民生视角下的生态观,要求全面落实“水十条”。下列做法中不符合这一主题的是( )
A.严格监管农药和化肥的使用 B.富含氮、磷的生活污水直接排放
C.对水源地和自然保护区的水体严格保护 D.农田灌溉使用喷灌、滴灌技术
10.已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是( )
A.X氧化物的化学式只能表示为XO B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在 D.三种金属的活动性顺序:X>Y>Z
11.孔明灯燃气的火焰温度可达300℃,但纸质灯罩却没被点燃的原因是( )
A.纸张不是可燃物,不能燃烧
B.空气不充足,纸张不会燃烧
C.风将热量吹散使灯罩处温度低于纸的着火点
D.风将热量吹散后灯罩的着火点降低了
12.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
下列说法正确的是( )
A.x等于90
B.b可能是单质
C.c一定是催化剂
D.参加反应的a与d的质量比为7﹕8
二、非选择题
13.多角度认识物质能帮助我们更全面地了解物质世界。以金属为例回答下列问题:
(1)认识金属元素的存在
①在自然界中,大多数金属以化合物存在,而金、铂等极少数金属因为化学性质_____(填“活泼”或“不活泼”)却能以单质存在。
②常见铁矿石有:黄铁矿(主要成分FeS2)、磁铁矿(主要成分Fe3O4)等。这两种铁矿石的主要成分含铁元素质量分数较大的是_____。
(2)认识金属的性质 用粗木棍在涂有蜡的锌板上写“龙”、“湖”两个字,露出下面的锌板。向“龙”字上滴加稀盐酸,向“湖”字上滴加CuSO4溶液。
龙 湖
①“龙”字上的现象是_________。
②“湖”字上有红色物质析出,用化学方程式解释:_________。
(3)认识金属的制备,工业上,金属钨(W)可由氢气和三氧化钨(WO3)在高温下发生置换反应制得。 反应中化合价升高的元素是_________。
(4)认识金属的用途烤制食物时常用到铝箔,主要利用了金属铝的_____ (填性质)。
14.能源、环境和安全已成为人类日益重视的问题。
(1)《易经》有言:“泽中有火”。“泽”指池沼,“火”主要是指___________在燃烧。
(2)如下图探究燃烧的条件。温度升高至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,③开始燃烧。
①燃烧的现象是_______;对比②③可知燃烧的条件之一是_______;无烟煤的着火点_____260℃(填“>”“=”或“<”)。
(3)燃料的充分燃烧对于节约能源、减少环境污染非常重要。汽车化油器将汽油喷成雾状进入内燃机气缸,能使汽油充分燃烧是因为___________。
(4)“爝火燃回春浩浩,洪炉照破夜沉沉”中蕴含煤炭燃烧时将化学能转化成_____能;科技发展可促进新能源的开发利用,实现低碳生活。请你写出一种新能源_______。
15.如图是初中化学常用的实验装置,请回答下列问题。
A B C D E
(1)写出装置B中的任意一种玻璃仪器的名称_________。
(2)实验室用氯酸钾和二氧化锰混合加热制取氧气,应选择的发生装置是_____(填字母序号),反应的化学方程式是__________。
(3)装置B和C都能用作实验室制取二氧化碳的发生装置,与装置B相比,装置C的优点是________。若用装置C作发生装置,关闭弹簧夹,反应停止后,液面应位于_____(填“1”、“2”或“3”)处。
(4)若用装置D收集二氧化碳,气体应从_____(填“m”或“n”)端进入。
(5)小红同学用装置E收集了一瓶氧气,测得氧气浓度偏低,原因可能是_____(填序号)
a.收集气体前,集气瓶中没有注满水 b.导管口开始有气泡冒出,立刻收集
c.收集气体后,集气瓶中仍有少量水 d.收集气体后,集气瓶正放在桌面上
(6)以下是化学教材中的几个实验,请据图回答问题。
实验一、二、三中都要在集气瓶中放少量的水。实验一中水的作用是吸收二氧化硫,防止污染空气,由此推测,二氧化硫具有的物理性质之一是______;在“实验一”“实验二”“实验三”中,可以把水换成细沙的实验是_____________。
实验一 实验二 实验三
16.某化学小组同学收集到一些铝制易拉罐,将其剪成条状并打磨,与铝片进行相互刻画,发现纯铝片表面有划痕。
(提出问题)通过分析上述现象,同学们认为该易拉罐不是纯铝制作的,因为合金的硬度比组成它的纯金属硬度更______。那么易拉罐中除铝外,还含有什么金属呢?
(查阅资料)①铝制易拉罐中的主要成分是铝,可能还含有铁、铜等。
②常温下铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铁和铜都不能与氢氧化钠溶液反应。
(作出猜想)该易拉罐的金属组成除铝外,可能还含有铁和铜中的一种或两种。
(实验探究)小明取打磨后的铝制易拉罐样品按如下方案进行实验:
实验步骤 实验现象 解释与结论
(1)取一定量的样品于烧杯中,加入足量的 溶液 ________,烧杯底部有固体剩余 样品中含铝
(2)另取一定量的样品于烧杯中,加入足量的稀盐酸。 样品逐渐溶解,表面有大量气泡生成,溶液变成__________色,充分 反应后试管底部仍有部分不溶物。 样品中含铁,反应的化学方程式为:_______。
(3)将(2)中得到的不溶物洗涤、干燥,向其中加入AgNO3溶液。 溶液由无色变成浅蓝色。 样品中含铜,反应的化学方程式为_________。
(实验结论)该易拉罐组成金属包括铝、铁和铜。
(拓展应用)铝制品被大量使用,其中一个重要原因是铝具有良好的抗腐蚀性能,铝具有良好的抗腐蚀性能的原因是: ________。图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有 (填序号)图标的垃圾桶内。
17.二氧化碳是导致温室效应的气体,也是一种宝贵的资源。
I .超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程如下:
(1)乳化池中,生石灰与水发生反应,化学方程式为_____________________________。该反应为_________反应(填“放热”或“吸热”)
(2)与“过筛”原理相同的基本实验操作是___________。
(3)碳化塔中反应的化学方程式为____________________。
Ⅱ.为解决温室效应加剧问题,同时实现光能转化为所需能量的目的,科学家正在研究二氧化碳新的应用技术,示意图如下:
(4)已知反应①为分解反应,写出反应的化学方程式:___________________。
(5)已知反应②为化合反应,推断化合物甲含_________元素。
(6)该体系中循环利用的物质是___________。
18.小红为了测定如下图的钙片中碳酸钙的含量标注是否属实,她取出5片钙片(每片2.5克),研碎后放入烧杯中,把30g稀盐酸分3次加入烧杯中进行反应(假定钙片其它成分不与盐酸反应),每次充分反应后得到的实验数据如表:
实验编号 1 2 3
稀盐酸的用量 10g 20g 30g
二氧化碳的质量 1.1g 2.2g 2.75g
(1)碳酸钙中碳元素的质量分数是_______。
(2)5片钙片完全反应可生成二氧化碳的质量为________。
(3)①计算5片钙片中含有碳酸钙的质量(写出计算过程)
②由上题计算可知,标签中碳酸钙的含量标注________(填“属实”或“不属实”)。
(4)在下图画出产生气体与所加盐酸溶液质量关系的曲线图。
答案
1-12 A A C D A C C C B D C D
13.不活泼 Fe3O4 (2分) 冒气泡 Zn+CuSO4=Cu+ZnSO4 氢元素 导热性和延展性
(答对1个就给分)
14.沼气(甲烷/CH4) 白磷燃烧产生大量白烟,放热 与氧气接触 > 增大汽油与氧气的接触面积 光和热(只写光或热不给分) 氢能、核能、太阳能、生物质能、地热能、潮汐能等(填一种即可)
15.(1)长颈漏斗(或锥形瓶、导管) (2) A 2KClO32KCl+3O2↑
(3) 可以控制反应的发生和停止 3 (4)m (5) ab(全对才给1分) (6)易溶于水 实验二
16.大 氢氧化钠 样品逐渐溶解,表面有气泡生成 浅绿 Fe+2HCl=FeCl2+H2↑
Cu+2AgNO3=2Ag+Cu(NO3)2 铝表面易生成致密的氧化膜 B
17.CaO+H2O=Ca(OH)2 放热 过滤 Ca(OH)2+CO2=CaCO3↓+H2O
碳、氢、氧 CO2
18.(1)40%(1分) (2)2.75g (1分)
(3)①解:设5片钙片中含有碳酸钙的质量为x,
……(1分)
答:5片钙片中含有碳酸钙的质量为6.25g
②标注属实。(2分)
(4) 见右图
同课章节目录
