融合“科”技”力量的发展——金属的冶炼与利用 课件(共30张PPT内嵌视频)
文档属性
| 名称 | 融合“科”技”力量的发展——金属的冶炼与利用 课件(共30张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 85.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-01 00:00:00 | ||
图片预览






文档简介
(共30张PPT)
金属的冶炼与应用
——融合“科”技”力量的发展
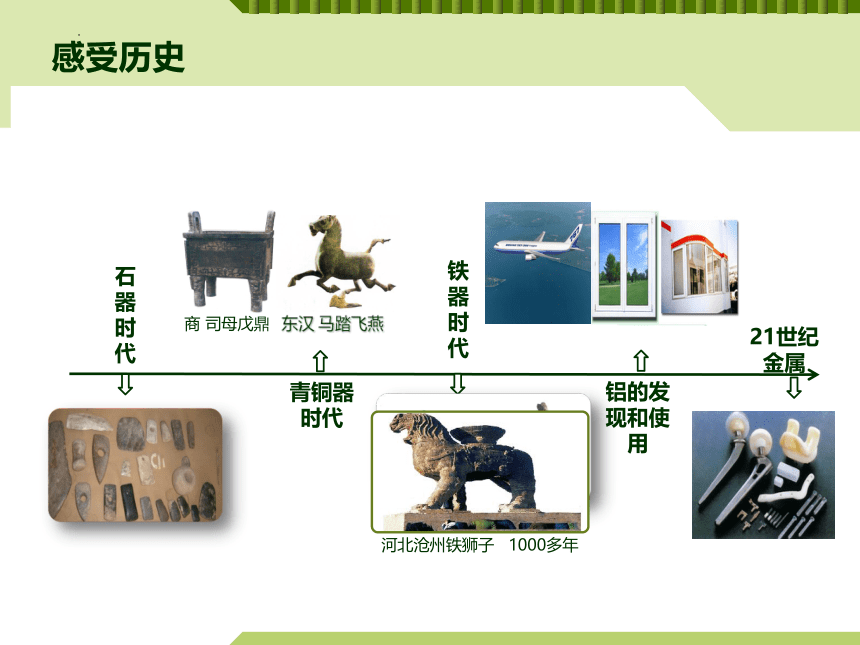
感受历史
石器时代
青铜器
时代
铁器
时代
铝的发现和使用
商 司母戊鼎
东汉 马踏飞燕
河北沧州铁狮子 1000多年
21世纪金属
三星堆出土文物蒙金面罩和青铜大立人,距今已有3000至5000年历史。
感受历史
古代冶炼金属历史
认知存在
Ag Pt Au性质稳定
自然界中有以单质存在
金 Au
铂 Pt
银 Ag
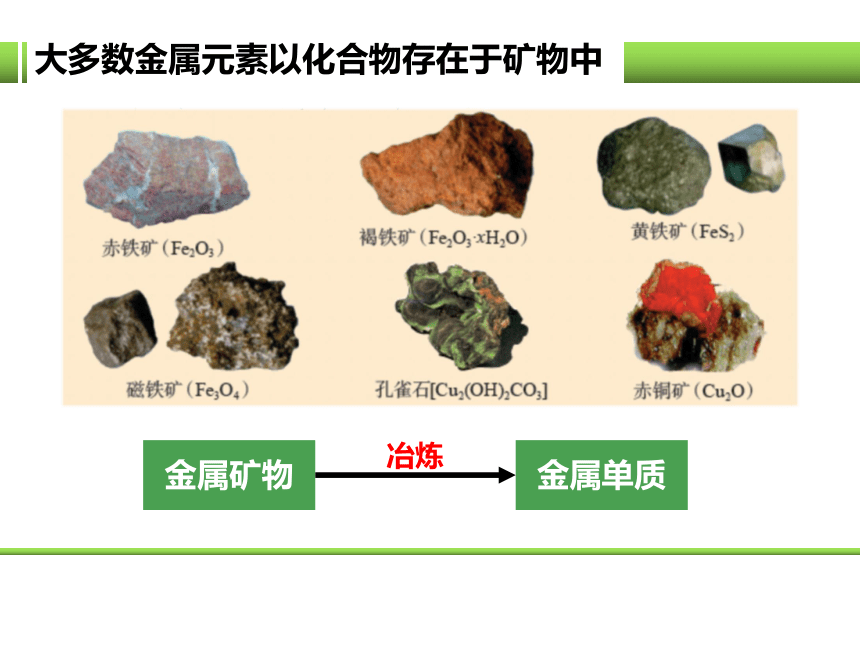
大多数金属元素以化合物存在于矿物中
金属矿物
金属单质
冶炼
探究原理
人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧后,
余烬里有一种红色光亮的金属显露出来?
理论推想
Fe2O3 Fe
失氧
(1)利用一定条件,使金属氧化物直接失去氧, 分解生成金属
(2)一定条件下,加入某类物质, 主动夺取金属氧化物中
的氧元素,使金属氧化物失去氧变成金属单质
C
CO2
夺氧
CO
H2
H2O
实验验证
查阅资料:
下图是CO与铁的氧化物反应生成的固体产物受到温度的影响。
一般酒精灯火焰能提供加热温度是400~600℃
固体
温度
Fe2O3
Fe3O4
FeO
Fe
氧化铁
一氧化碳
实验验证
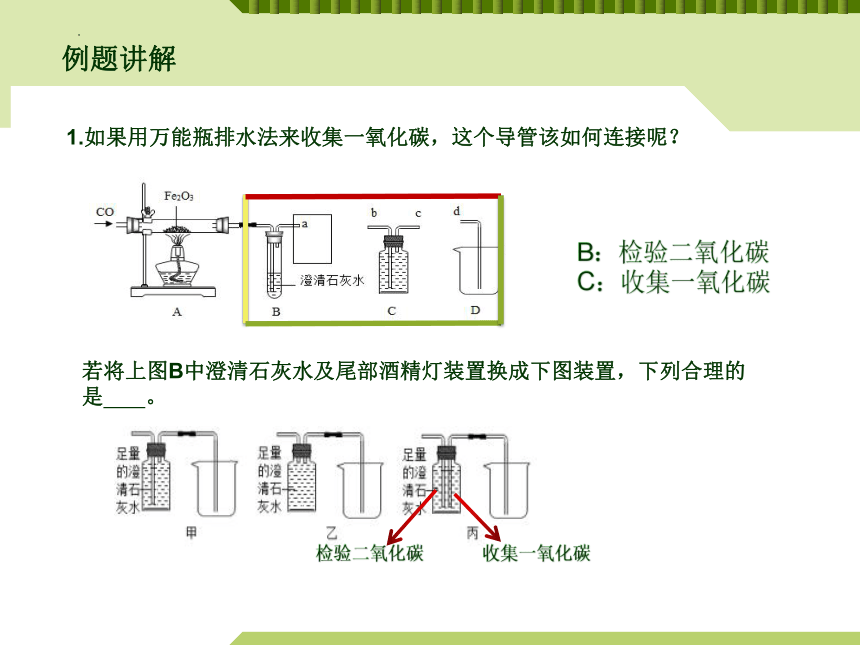
例题讲解
若将上图B中澄清石灰水及尾部酒精灯装置换成下图装置,下列合理的是 。
1.如果用万能瓶排水法来收集一氧化碳,这个导管该如何连接呢?
B:检验二氧化碳
C:收集一氧化碳
检验二氧化碳
收集一氧化碳
A
D
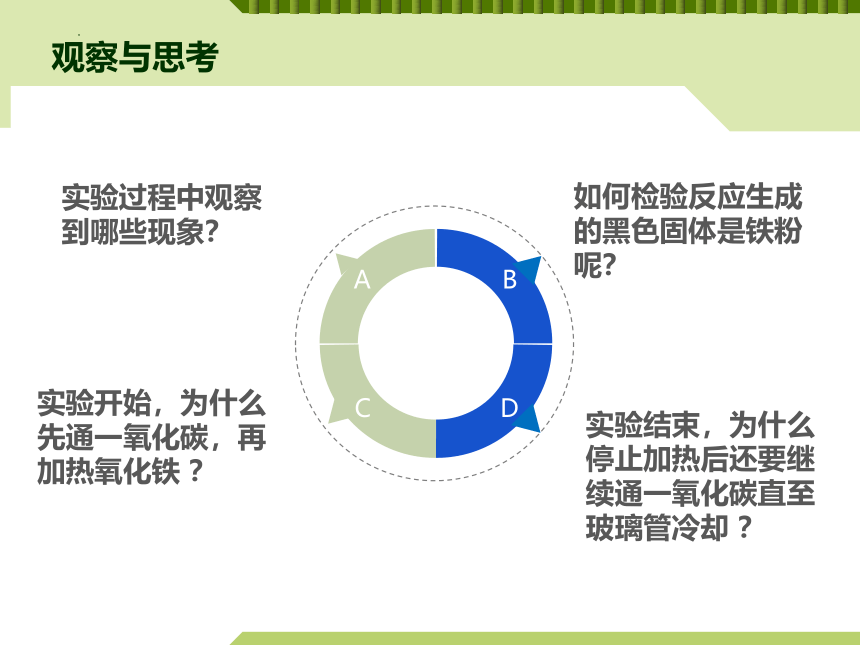
实验开始,为什么先通一氧化碳,再加热氧化铁 ?
实验结束,为什么停止加热后还要继续通一氧化碳直至玻璃管冷却 ?
如何检验反应生成的黑色固体是铁粉呢?
B
C
观察与思考
实验过程中观察
到哪些现象?
反应原理
被还原
还原剂
检查装置气密性
向硬质玻璃管中装入氧化铁
通入纯净的一氧化碳
点燃酒精喷灯加热固体
熄灭酒喷灯
继续通CO直至装置冷却
实验步骤
一氧化碳:早出晚归 酒精喷灯:迟到早退
工业炼铁
原料
铁矿石、焦炭、石灰石
高炉
将杂质转化为炉渣而除去
70%
72.4%
46.7%
磁铁矿
Fe3O4
赤铁矿
Fe2O3
黄铁矿
FeS2
选哪种矿石炼铁比较好?
依据:
含铁量
产物是否环保
问题探究
1.高炉中发生了哪些化学反应?
2. 焦炭的作用是什么?
3.通过哪些方法提高反应速率?
4.生铁出口为何低于炉渣出口?
C+O2===CO2
点燃
CO2+C===2CO
高温
Fe2O3+3CO===2Fe+3CO2
高温
实验室模拟炼铁 工业炼铁
原料
反应
产物
高温来源
生产效率
Fe2O3, CO
铁矿石,焦炭,热空气,石灰石
Fe2O3+3CO===2Fe+3CO2
高温
C+O2===CO2
点燃
CO2+C===2CO
高温
纯铁
生铁(含碳量2%-4.3%)
用酒精喷灯提供高温
焦炭燃烧放热,提高炉温
一次性生产
连续不断生产
Fe2O3+3CO===2Fe+3CO2
高温
对照比较
2.右图所示是高炉炼铁时高炉内的化学变化过程,回答下列问题:
(1)将铁铁矿石中还原出来的物质是 (填化学) ;
(2)取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象 ,
发生反应的化学方程式为 ,
(3)当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式) 。
请设计一个简单实验证明你的判断,简要写出主要操作和现象:
。
例题讲解
资料卡:金属的冶炼方法
①电解法 ②热还原法 ③热分解法 ④物理提取法
归纳总结
(2)热还原
(1)电解法
归纳总结
把金属矿物与CO、H2、C等物质一起高温反应
冶炼锰、锌、铁、镍、铅等都是这种方法。
冶炼钠、钾、镁、铝等是这种方法
举例: 2Al2O3 4Al+3O2↑
通电
用活泼金属将一些不太活泼的金属从其盐溶液中置换出来。适于处理金属含量较低和组分比较复杂的原料,如有色和稀有金属
(3)湿法冶金
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。
铝热反应原理可以应用在野外焊接钢轨
拓展视野
Fe2O3+2Al===2Fe+3Al2O3
高温
科技引领发展——高炉新智造
科技引领发展——高炉新智造
拓展视野
美国Lunar Resources公司称,遍布月球表面的月壤蕴藏着巨大价值,他们正在开发从月壤中冶炼铁、铝、镁和硅的技术,拟2024年在月球上冶炼多种金属。月球上有大量非常重要的金属材料等着人们去开采。
课后测验解析
第1题 该题所述的冶炼锌的过程中,反应物只有碳酸锌与碳,并没有铅,所以符合题意的选项应为A
第2题 铝在常温下易与氧气反尖生成致密的氧化膜所以符合题意的选项应为D
第3题 第1问 是铁 ;第2问是+6价;第3问选C D
第4题 (1)根据题意可知,反应物中有,元素种类在反应前后不变,产生的一种可燃性气体为CO,化学方程式为TiO2+2Cl2+2C==TiCl4+2CO; (2)由于是置换反应,所以生成物是氯化镁和钛,而氩气则为保护气,防止镁与钛氧化,2Mg+TiCl4==2MgCl2+Ti
高温
加热
第5题
(1)增加反应物的接触面积,提高反应速率,使反应更充分;
(2)因为通入热空气和反应产生大量的二氧化碳气体,所以应是N2 、CO2;
(3)CaCO3+SiO2==CaSiO3+CO2↑
(4)玻璃棒
课后测验解析
高温
高温
第6题
(1)一氧化碳还原氧化铜后的尾气中含有一氧化碳,一氧化碳有毒,不能直接排放到空气,所以装置中气球的作用是收集一氧化碳,防止造成空气污染;
(2)一氧化碳与氧化铜在高温条件下反应生成铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊,当观察到澄清石灰水变浑浊,说明有二氧化碳生成,即CO与CuO已经发生反应;
课后测验解析
第6题
(3)①由图象可知,400℃时,反应的固体产物中含有Cu和Cu2O;②由图象可知,500℃时固体中只有铜,则该反应是在加热的条件下,一氧化碳和氧化铜反应生成铜和二氧化碳,氧化铜被一氧化碳夺走了氧元素生成了铜,氧化铜属于氧化剂,发生了还原反应;
(4)用CO还原CuO制取纯净的Cu,由图象可知:温度高于500℃时,产物中只有铜,反应温度至少要控制在500℃以上。
课后测验解析
课后测验解析
第7题
(1)组装好实验装置后,应先进行的操作是先检查装置气密性,再装入药品。实验开始时,先通一会CO,作用是排净装置内空气,防止和空气混合发生爆炸,故填:检查装置气密性排;净装置内空气,防止和空气混合发生爆炸;
(2)A中一氧化碳和氧化铁高温生成铁和二氧化碳,红色固体变为黑色,故填:红色固体变为黑色;Fe2O3+3CO===2Fe+3CO2;
高温
课后测验解析
第7题
(3)停止加热后,还要再通一会儿CO,除了将A装置中的CO2送入B装置的溶液中,另一个作用是防止铁在高温下被氧气重新氧化,故填:防止铁在高温下被氧气重新氧化。
(4)若将B装置改成C虚线方框内装置,则该装置还可以收集气体,起到尾气处理收集一氧化碳作用,故填:尾气处理
(5)根据固体质量的减少量就是参加反应的氧化铁中氧元素的质量:13.6g-11.2g=2.4g,
所以m(Fe2O3)=2.4g÷30%=8g
同学们,再见!
金属的冶炼与应用
——融合“科”技”力量的发展
感受历史
石器时代
青铜器
时代
铁器
时代
铝的发现和使用
商 司母戊鼎
东汉 马踏飞燕
河北沧州铁狮子 1000多年
21世纪金属
三星堆出土文物蒙金面罩和青铜大立人,距今已有3000至5000年历史。
感受历史
古代冶炼金属历史
认知存在
Ag Pt Au性质稳定
自然界中有以单质存在
金 Au
铂 Pt
银 Ag
大多数金属元素以化合物存在于矿物中
金属矿物
金属单质
冶炼
探究原理
人类很早就发现,孔雀石在熊熊燃烧的树木中灼烧后,
余烬里有一种红色光亮的金属显露出来?
理论推想
Fe2O3 Fe
失氧
(1)利用一定条件,使金属氧化物直接失去氧, 分解生成金属
(2)一定条件下,加入某类物质, 主动夺取金属氧化物中
的氧元素,使金属氧化物失去氧变成金属单质
C
CO2
夺氧
CO
H2
H2O
实验验证
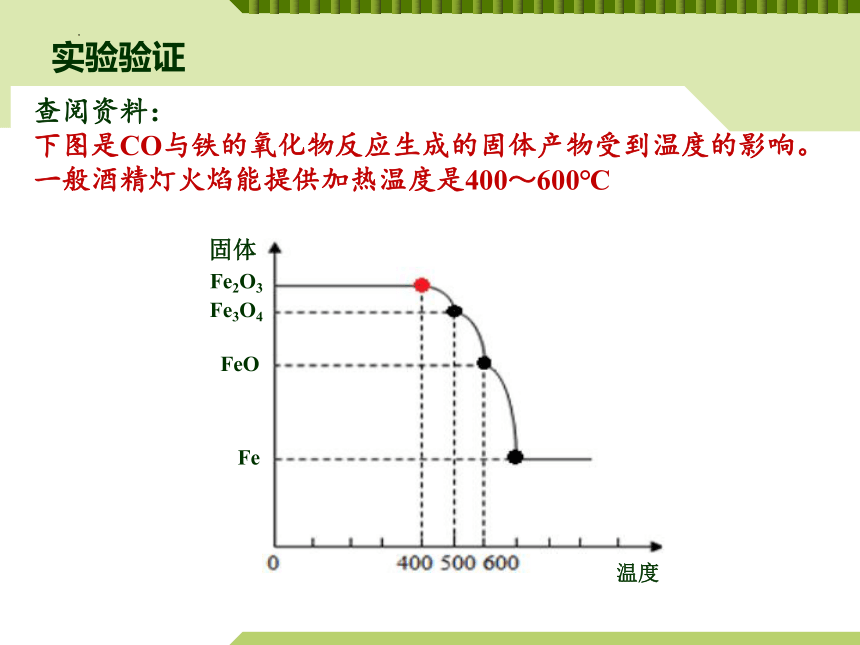
查阅资料:
下图是CO与铁的氧化物反应生成的固体产物受到温度的影响。
一般酒精灯火焰能提供加热温度是400~600℃
固体
温度
Fe2O3
Fe3O4
FeO
Fe
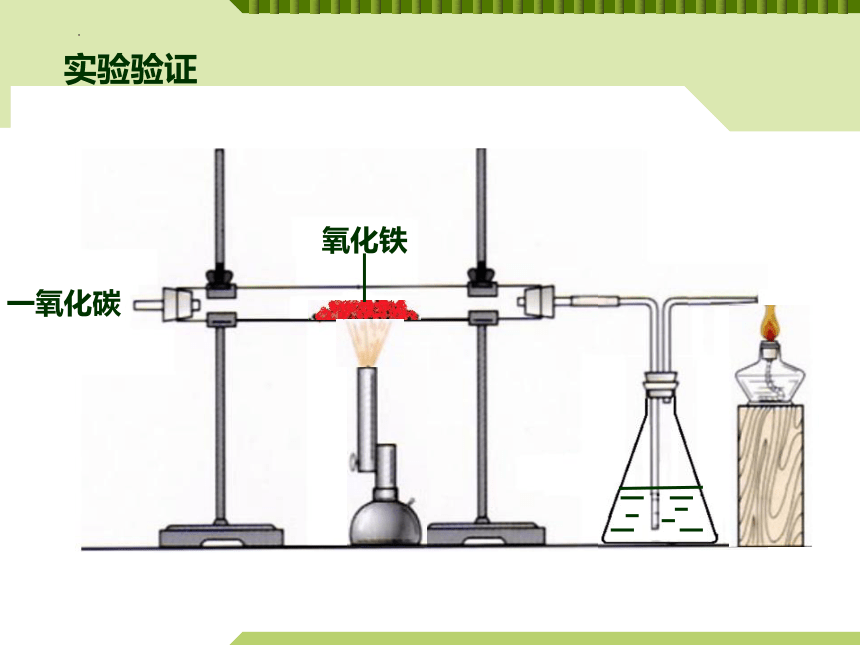
氧化铁
一氧化碳
实验验证
例题讲解
若将上图B中澄清石灰水及尾部酒精灯装置换成下图装置,下列合理的是 。
1.如果用万能瓶排水法来收集一氧化碳,这个导管该如何连接呢?
B:检验二氧化碳
C:收集一氧化碳
检验二氧化碳
收集一氧化碳
A
D
实验开始,为什么先通一氧化碳,再加热氧化铁 ?
实验结束,为什么停止加热后还要继续通一氧化碳直至玻璃管冷却 ?
如何检验反应生成的黑色固体是铁粉呢?
B
C
观察与思考
实验过程中观察
到哪些现象?
反应原理
被还原
还原剂
检查装置气密性
向硬质玻璃管中装入氧化铁
通入纯净的一氧化碳
点燃酒精喷灯加热固体
熄灭酒喷灯
继续通CO直至装置冷却
实验步骤
一氧化碳:早出晚归 酒精喷灯:迟到早退
工业炼铁
原料
铁矿石、焦炭、石灰石
高炉
将杂质转化为炉渣而除去
70%
72.4%
46.7%
磁铁矿
Fe3O4
赤铁矿
Fe2O3
黄铁矿
FeS2
选哪种矿石炼铁比较好?
依据:
含铁量
产物是否环保
问题探究
1.高炉中发生了哪些化学反应?
2. 焦炭的作用是什么?
3.通过哪些方法提高反应速率?
4.生铁出口为何低于炉渣出口?
C+O2===CO2
点燃
CO2+C===2CO
高温
Fe2O3+3CO===2Fe+3CO2
高温
实验室模拟炼铁 工业炼铁
原料
反应
产物
高温来源
生产效率
Fe2O3, CO
铁矿石,焦炭,热空气,石灰石
Fe2O3+3CO===2Fe+3CO2
高温
C+O2===CO2
点燃
CO2+C===2CO
高温
纯铁
生铁(含碳量2%-4.3%)
用酒精喷灯提供高温
焦炭燃烧放热,提高炉温
一次性生产
连续不断生产
Fe2O3+3CO===2Fe+3CO2
高温
对照比较
2.右图所示是高炉炼铁时高炉内的化学变化过程,回答下列问题:
(1)将铁铁矿石中还原出来的物质是 (填化学) ;
(2)取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象 ,
发生反应的化学方程式为 ,
(3)当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式) 。
请设计一个简单实验证明你的判断,简要写出主要操作和现象:
。
例题讲解
资料卡:金属的冶炼方法
①电解法 ②热还原法 ③热分解法 ④物理提取法
归纳总结
(2)热还原
(1)电解法
归纳总结
把金属矿物与CO、H2、C等物质一起高温反应
冶炼锰、锌、铁、镍、铅等都是这种方法。
冶炼钠、钾、镁、铝等是这种方法
举例: 2Al2O3 4Al+3O2↑
通电
用活泼金属将一些不太活泼的金属从其盐溶液中置换出来。适于处理金属含量较低和组分比较复杂的原料,如有色和稀有金属
(3)湿法冶金
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。
铝热反应原理可以应用在野外焊接钢轨
拓展视野
Fe2O3+2Al===2Fe+3Al2O3
高温
科技引领发展——高炉新智造
科技引领发展——高炉新智造
拓展视野
美国Lunar Resources公司称,遍布月球表面的月壤蕴藏着巨大价值,他们正在开发从月壤中冶炼铁、铝、镁和硅的技术,拟2024年在月球上冶炼多种金属。月球上有大量非常重要的金属材料等着人们去开采。
课后测验解析
第1题 该题所述的冶炼锌的过程中,反应物只有碳酸锌与碳,并没有铅,所以符合题意的选项应为A
第2题 铝在常温下易与氧气反尖生成致密的氧化膜所以符合题意的选项应为D
第3题 第1问 是铁 ;第2问是+6价;第3问选C D
第4题 (1)根据题意可知,反应物中有,元素种类在反应前后不变,产生的一种可燃性气体为CO,化学方程式为TiO2+2Cl2+2C==TiCl4+2CO; (2)由于是置换反应,所以生成物是氯化镁和钛,而氩气则为保护气,防止镁与钛氧化,2Mg+TiCl4==2MgCl2+Ti
高温
加热
第5题
(1)增加反应物的接触面积,提高反应速率,使反应更充分;
(2)因为通入热空气和反应产生大量的二氧化碳气体,所以应是N2 、CO2;
(3)CaCO3+SiO2==CaSiO3+CO2↑
(4)玻璃棒
课后测验解析
高温
高温
第6题
(1)一氧化碳还原氧化铜后的尾气中含有一氧化碳,一氧化碳有毒,不能直接排放到空气,所以装置中气球的作用是收集一氧化碳,防止造成空气污染;
(2)一氧化碳与氧化铜在高温条件下反应生成铜和二氧化碳,二氧化碳能使澄清石灰水变浑浊,当观察到澄清石灰水变浑浊,说明有二氧化碳生成,即CO与CuO已经发生反应;
课后测验解析
第6题
(3)①由图象可知,400℃时,反应的固体产物中含有Cu和Cu2O;②由图象可知,500℃时固体中只有铜,则该反应是在加热的条件下,一氧化碳和氧化铜反应生成铜和二氧化碳,氧化铜被一氧化碳夺走了氧元素生成了铜,氧化铜属于氧化剂,发生了还原反应;
(4)用CO还原CuO制取纯净的Cu,由图象可知:温度高于500℃时,产物中只有铜,反应温度至少要控制在500℃以上。
课后测验解析
课后测验解析
第7题
(1)组装好实验装置后,应先进行的操作是先检查装置气密性,再装入药品。实验开始时,先通一会CO,作用是排净装置内空气,防止和空气混合发生爆炸,故填:检查装置气密性排;净装置内空气,防止和空气混合发生爆炸;
(2)A中一氧化碳和氧化铁高温生成铁和二氧化碳,红色固体变为黑色,故填:红色固体变为黑色;Fe2O3+3CO===2Fe+3CO2;
高温
课后测验解析
第7题
(3)停止加热后,还要再通一会儿CO,除了将A装置中的CO2送入B装置的溶液中,另一个作用是防止铁在高温下被氧气重新氧化,故填:防止铁在高温下被氧气重新氧化。
(4)若将B装置改成C虚线方框内装置,则该装置还可以收集气体,起到尾气处理收集一氧化碳作用,故填:尾气处理
(5)根据固体质量的减少量就是参加反应的氧化铁中氧元素的质量:13.6g-11.2g=2.4g,
所以m(Fe2O3)=2.4g÷30%=8g
同学们,再见!
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
