《酸和碱的中和反应》第2课时(教学课件29页)-九年级化学下册同步备课系列(人教版)
文档属性
| 名称 | 《酸和碱的中和反应》第2课时(教学课件29页)-九年级化学下册同步备课系列(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 52.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 22:54:58 | ||
图片预览








文档简介
(共29张PPT)
课题1 酸和碱的中和反应
第十单元 酸和碱
第2课时
1.知道溶液酸碱度的表示方法,会用pH试纸测定溶液的酸碱度;
2.了解酸碱度在实际中的意义。
溶液酸碱度的表示法
01
溶液的酸碱度的重要意义
02
生活中柠檬,山楂苹果谁的吃起来更酸呢?
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
实验室中盐酸,硫酸,硝酸谁的酸性更强呢?
酸碱指示剂可以测定溶液的酸碱性
如何精确地知道溶液的酸碱性强弱程度(溶液的酸碱度)?
溶液酸碱度的表示法
溶液酸碱度的表示法
酸碱度就是溶液酸碱性强弱的程度
视频:溶液酸碱度的表示方法
溶液酸碱度的表示法
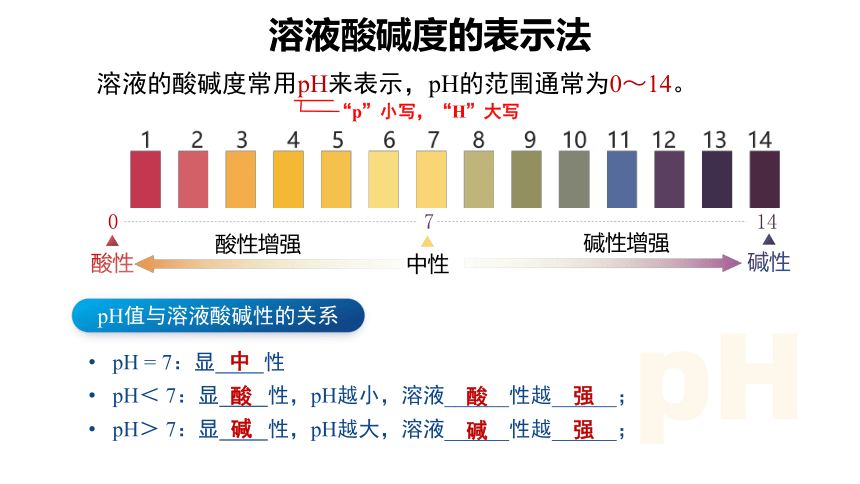
溶液的酸碱度常用pH来表示,pH的范围通常为0~14。
0
7
14
中性
酸性
碱性
酸性增强
碱性增强
pH值与溶液酸碱性的关系
pH = 7:显 性
pH< 7:显 性,pH越小,溶液______性越______;
pH> 7:显 性,pH越大,溶液______性越______;
中
酸
酸
强
碱
碱
强
“p”小写,“H”大写
溶液酸碱度的表示法
测定pH最简单的方法——使用pH试纸
pH试纸
标准比色卡
把试纸显示的颜色与标准比色卡比较,读出该溶液的pH
溶液酸碱度的表示法
用pH试纸测定溶液的pH
在洁净的玻璃片或白瓷板上放一小片pH试纸
用玻璃棒蘸取溶液滴到pH试纸上
使用方法
注意事项
pH试纸不能直接插入待测溶液中
不能用水润湿
(会污染药品)
溶液酸碱度的表示法
学生实验——测定一些溶液的pH
溶液酸碱度的表示法
请同学们绘制:中和反应过程中溶液pH变化曲线图。
pH
酸溶液的量
7
0
pH
碱溶液的量
7
0
以盐酸与氢氧化钠中和反应为例。
b
a
HCl + NaOH NaCl + H2O
酸溶液
碱溶液
酸溶液
碱溶液
OH-
Cl-
Na+
H2O
Cl-
Na+
H2O
G
Cl-
Na+
H2O
H+
OH-
Cl-
Na+
H2O
Cl-
Na+
H2O
b
c
a
c
Cl-
Na+
H2O
H+
溶液酸碱度的表示法
交流讨论:
1.用被水湿润的pH试纸测溶液pH会产生什么影响?
相当于稀释溶液
只能改变溶液的酸碱度,不能改变溶液酸碱性
中性溶液:不受影响
酸性溶液:pH 偏大
碱性溶液:pH 偏小
pH
加水的质量
7
0
pH
加水的质量
7
0
pH
加水的质量
7
0
溶液酸碱度的表示法
交流讨论:
2.玻璃棒不干净会怎么样?
会污染药品,且不准确。
3.应立即把试纸所显示的颜色与标准比色卡对比,为什么?
时间长了易变色,导致数值不准确。
4.在用pH试纸测定溶液的pH时常会出现什么困惑?
数值不明显或不精确。
溶液酸碱度的表示法
精确测定溶液的pH——使用pH计(酸度计)
两种pH计
溶液酸碱度的表示法
交流讨论:下图是身边一些物质的pH,与你预想中的一样吗?
溶液的酸碱度的重要意义
溶液的酸碱度的重要意义
1.人的体液的pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现酸中毒或碱中毒。
7.35~7.45
6.6~7.1
0.9~1.5
6.6~7.6
血 浆
唾 液
胃 液
乳 汁
胆 汁
7.1~7.3
溶液的酸碱度的重要意义
2.在化工生产中,许多反应必须在一定的pH溶液中才能进行。
溶液的酸碱度的重要意义
3.在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长。
溶液的酸碱度的重要意义
4.测定雨水的pH,可以了解空气的污染情况。
酸雨:
pH<5.6 的雨水。
溶液的酸碱度的重要意义
雨水一般呈弱酸性(由于空气中的二氧化碳溶解在雨水中 CO2+ H2O= H2CO3,正常雨水的pH≈5.6 ),但某些酸性气体未经处理排放到空气中,可导致降雨酸性增强。
酸雨的危害
溶液的酸碱度的重要意义
5.溶液酸碱度对头发的影响
健康的头发
受损伤的头发
一般情况下,我们使用的洗发用品是酸性的还是碱性的
洗发时,在用过洗发剂后再使用护发剂,这样对头发有保护作用。
你能解释这是为什么吗
洗发液pH值:6.5-8.5 护发素pH值:2.8-3.5
头发在pH值为4.5-5.5的弱酸环境下,最利于头发健康。
科普视频:《洗发和护发的奥秘》
溶液酸碱度的表示法—pH
pH与溶液的酸碱性的关系
碱性溶液,pH﹥7,pH越大,碱性越强
中性溶液,pH=7
酸性溶液,pH﹤7,pH越小,酸性越强
溶液酸碱性的重要意义
农业、工业、环境 、生活
pH测定方法
pH试纸、pH计
1.有三个实验操作:①向氢氧化钠溶液中加水;②向水中加入氢氧化钠溶液;③向盐酸中加水。下列是溶液 pH 变化的三个图像,与上述实验操作顺序相对应的排列是( )
C
A.a、b、c B.c、a、b C.b、c、a D.a、c、b
2.下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,滴在置于洁净表面皿的pH试纸上,根据试纸呈现的颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液滴在用蒸馏水润湿pH试纸上,对照标准比色卡读数
D.用玻璃棒蘸取待测液滴pH试纸上,3分钟后对照标准比色卡读数
B
3.不同物质的酸碱性不同,根据表中各物质的pH,判断下列说法
正确的是:( )
物质 盐酸 CuSO4溶液 NaCl溶液 水 Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
D
A.pH<7的溶液一定是酸溶液
B.pH>7的溶液一定是碱溶液
C.pH=7的溶液一定是盐溶液
D.盐溶液可能显酸性、碱性或中性
4.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图示。
(1)该实验操作是将 滴加到 溶液中。
(2) 当加入溶液的质量为a g时,
所得溶液中的溶质为 。
(3)当加入溶液的质量为b g时,
向所得溶液中滴加酚酞溶液,溶液呈 色。
HCl、NaCl
红
NaOH溶液
稀盐酸
NaOH+HCl=NaCl+H2O
加入溶液的质量/g
pH
a
b
课题1 酸和碱的中和反应
第十单元 酸和碱
第2课时
1.知道溶液酸碱度的表示方法,会用pH试纸测定溶液的酸碱度;
2.了解酸碱度在实际中的意义。
溶液酸碱度的表示法
01
溶液的酸碱度的重要意义
02
生活中柠檬,山楂苹果谁的吃起来更酸呢?
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
实验室中盐酸,硫酸,硝酸谁的酸性更强呢?
酸碱指示剂可以测定溶液的酸碱性
如何精确地知道溶液的酸碱性强弱程度(溶液的酸碱度)?
溶液酸碱度的表示法
溶液酸碱度的表示法
酸碱度就是溶液酸碱性强弱的程度
视频:溶液酸碱度的表示方法
溶液酸碱度的表示法
溶液的酸碱度常用pH来表示,pH的范围通常为0~14。
0
7
14
中性
酸性
碱性
酸性增强
碱性增强
pH值与溶液酸碱性的关系
pH = 7:显 性
pH< 7:显 性,pH越小,溶液______性越______;
pH> 7:显 性,pH越大,溶液______性越______;
中
酸
酸
强
碱
碱
强
“p”小写,“H”大写
溶液酸碱度的表示法
测定pH最简单的方法——使用pH试纸
pH试纸
标准比色卡
把试纸显示的颜色与标准比色卡比较,读出该溶液的pH
溶液酸碱度的表示法
用pH试纸测定溶液的pH
在洁净的玻璃片或白瓷板上放一小片pH试纸
用玻璃棒蘸取溶液滴到pH试纸上
使用方法
注意事项
pH试纸不能直接插入待测溶液中
不能用水润湿
(会污染药品)
溶液酸碱度的表示法
学生实验——测定一些溶液的pH
溶液酸碱度的表示法
请同学们绘制:中和反应过程中溶液pH变化曲线图。
pH
酸溶液的量
7
0
pH
碱溶液的量
7
0
以盐酸与氢氧化钠中和反应为例。
b
a
HCl + NaOH NaCl + H2O
酸溶液
碱溶液
酸溶液
碱溶液
OH-
Cl-
Na+
H2O
Cl-
Na+
H2O
G
Cl-
Na+
H2O
H+
OH-
Cl-
Na+
H2O
Cl-
Na+
H2O
b
c
a
c
Cl-
Na+
H2O
H+
溶液酸碱度的表示法
交流讨论:
1.用被水湿润的pH试纸测溶液pH会产生什么影响?
相当于稀释溶液
只能改变溶液的酸碱度,不能改变溶液酸碱性
中性溶液:不受影响
酸性溶液:pH 偏大
碱性溶液:pH 偏小
pH
加水的质量
7
0
pH
加水的质量
7
0
pH
加水的质量
7
0
溶液酸碱度的表示法
交流讨论:
2.玻璃棒不干净会怎么样?
会污染药品,且不准确。
3.应立即把试纸所显示的颜色与标准比色卡对比,为什么?
时间长了易变色,导致数值不准确。
4.在用pH试纸测定溶液的pH时常会出现什么困惑?
数值不明显或不精确。
溶液酸碱度的表示法
精确测定溶液的pH——使用pH计(酸度计)
两种pH计
溶液酸碱度的表示法
交流讨论:下图是身边一些物质的pH,与你预想中的一样吗?
溶液的酸碱度的重要意义
溶液的酸碱度的重要意义
1.人的体液的pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现酸中毒或碱中毒。
7.35~7.45
6.6~7.1
0.9~1.5
6.6~7.6
血 浆
唾 液
胃 液
乳 汁
胆 汁
7.1~7.3
溶液的酸碱度的重要意义
2.在化工生产中,许多反应必须在一定的pH溶液中才能进行。
溶液的酸碱度的重要意义
3.在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长。
溶液的酸碱度的重要意义
4.测定雨水的pH,可以了解空气的污染情况。
酸雨:
pH<5.6 的雨水。
溶液的酸碱度的重要意义
雨水一般呈弱酸性(由于空气中的二氧化碳溶解在雨水中 CO2+ H2O= H2CO3,正常雨水的pH≈5.6 ),但某些酸性气体未经处理排放到空气中,可导致降雨酸性增强。
酸雨的危害
溶液的酸碱度的重要意义
5.溶液酸碱度对头发的影响
健康的头发
受损伤的头发
一般情况下,我们使用的洗发用品是酸性的还是碱性的
洗发时,在用过洗发剂后再使用护发剂,这样对头发有保护作用。
你能解释这是为什么吗
洗发液pH值:6.5-8.5 护发素pH值:2.8-3.5
头发在pH值为4.5-5.5的弱酸环境下,最利于头发健康。
科普视频:《洗发和护发的奥秘》
溶液酸碱度的表示法—pH
pH与溶液的酸碱性的关系
碱性溶液,pH﹥7,pH越大,碱性越强
中性溶液,pH=7
酸性溶液,pH﹤7,pH越小,酸性越强
溶液酸碱性的重要意义
农业、工业、环境 、生活
pH测定方法
pH试纸、pH计
1.有三个实验操作:①向氢氧化钠溶液中加水;②向水中加入氢氧化钠溶液;③向盐酸中加水。下列是溶液 pH 变化的三个图像,与上述实验操作顺序相对应的排列是( )
C
A.a、b、c B.c、a、b C.b、c、a D.a、c、b
2.下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,滴在置于洁净表面皿的pH试纸上,根据试纸呈现的颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液滴在用蒸馏水润湿pH试纸上,对照标准比色卡读数
D.用玻璃棒蘸取待测液滴pH试纸上,3分钟后对照标准比色卡读数
B
3.不同物质的酸碱性不同,根据表中各物质的pH,判断下列说法
正确的是:( )
物质 盐酸 CuSO4溶液 NaCl溶液 水 Na2CO3溶液 NaOH溶液
pH <7 <7 =7 =7 >7 >7
D
A.pH<7的溶液一定是酸溶液
B.pH>7的溶液一定是碱溶液
C.pH=7的溶液一定是盐溶液
D.盐溶液可能显酸性、碱性或中性
4.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图示。
(1)该实验操作是将 滴加到 溶液中。
(2) 当加入溶液的质量为a g时,
所得溶液中的溶质为 。
(3)当加入溶液的质量为b g时,
向所得溶液中滴加酚酞溶液,溶液呈 色。
HCl、NaCl
红
NaOH溶液
稀盐酸
NaOH+HCl=NaCl+H2O
加入溶液的质量/g
pH
a
b
同课章节目录
