九年级化学人教版下册第10单元《常见的酸和碱》第三课时课件(18页)
文档属性
| 名称 | 九年级化学人教版下册第10单元《常见的酸和碱》第三课时课件(18页) |  | |
| 格式 | pptx | ||
| 文件大小 | 47.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 22:59:48 | ||
图片预览



文档简介
(共18张PPT)
人教版 九年级化学 下册
第十单元 课题1
常见的酸和碱
(第三课时)
1、某无色溶液中滴加无色酚酞溶液,酚酞溶液变红,若滴加紫色石蕊溶液,则石蕊溶液变( )。
A、红色 B、紫色 C、蓝色 D、无色
2、同学们打开盛有浓盐酸和浓硫酸的试剂瓶的瓶塞,立即就能把它们区分开来,这是为什么?
C
3、现有稀盐酸、澄清石灰水和蒸馏水各一瓶,请你设计实验将它们一一鉴别开?
各取少量试剂于试管中,分别向试管中滴加几滴紫色石蕊溶液,震荡,若紫色石蕊溶液变红,则原溶液是稀盐酸,若紫色石蕊溶液变蓝,则原溶液是澄清石灰水,若不变色,则原溶液是蒸馏水。
浓盐酸具有挥发性,打开瓶塞有白雾出现
4、按照如图所示的装置,在锥形瓶中盛浓硫酸,在分液漏斗中装水。打开分液漏斗的活塞,让水滴入锥形瓶。
(1)你可观察到什么现象?
(2)分析产生上述现象的原因。
(3)写出实验室正确稀释浓硫酸的操作步骤。
酸液飞溅
将水倒入浓硫酸中,水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热会使水沸腾,造成酸液飞溅。
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
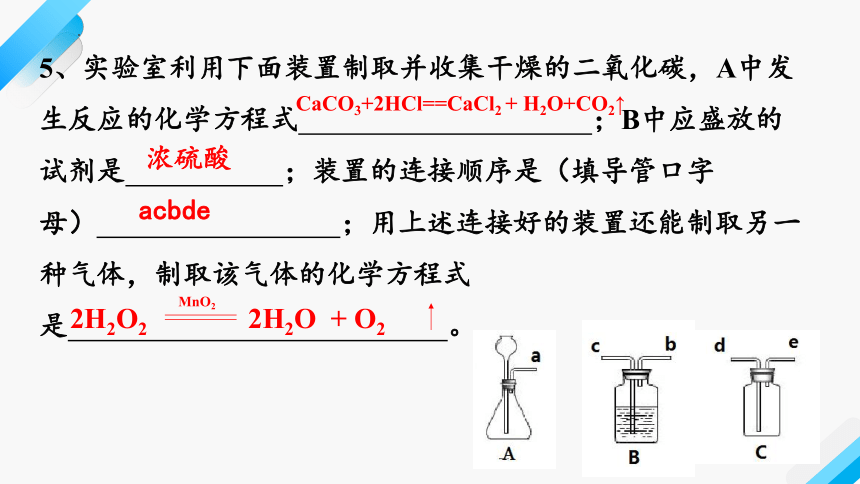
5、实验室利用下面装置制取并收集干燥的二氧化碳,A中发生反应的化学方程式 ;B中应盛放的试剂是 ;装置的连接顺序是(填导管口字母) ;用上述连接好的装置还能制取另一种气体,制取该气体的化学方程式是 。
CaCO3+2HCl==CaCl2 + H2O+CO2↑
浓硫酸
acbde
2H2O2
MnO2
2H2O + O2
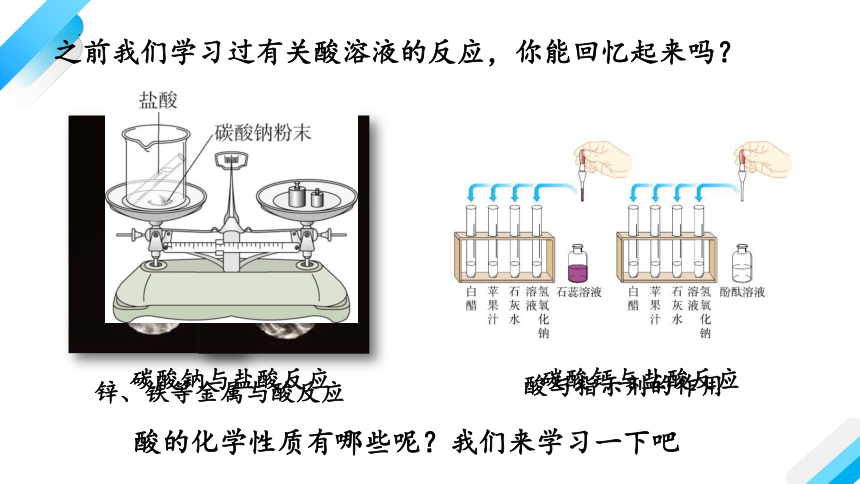
之前我们学习过有关酸溶液的反应,你能回忆起来吗?
锌、铁等金属与酸反应
实
验
室
制
取
CO2
碳酸钙与盐酸反应
碳酸钠与盐酸反应
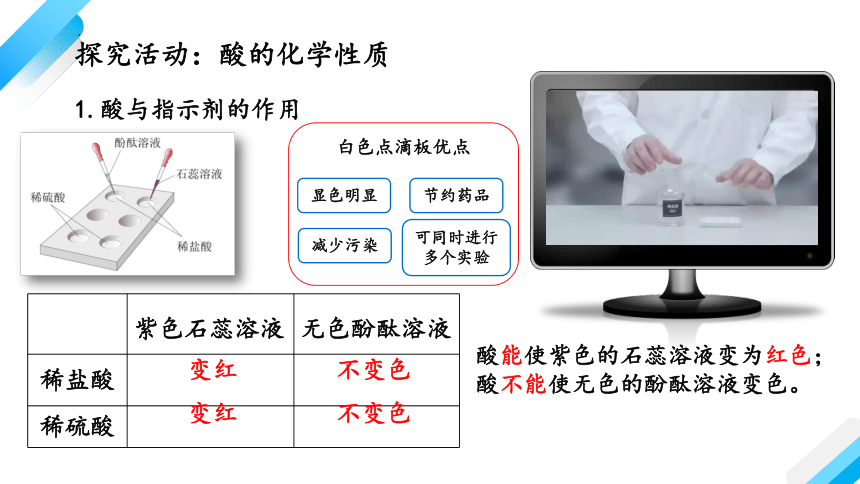
酸与指示剂的作用
酸的化学性质有哪些呢?我们来学习一下吧
探究活动:酸的化学性质
1.酸与指示剂的作用
紫色石蕊溶液 无色酚酞溶液
稀盐酸
稀硫酸
变红
不变色
变红
不变色
酸能使紫色的石蕊溶液变为红色;
酸不能使无色的酚酞溶液变色。
白色点滴板优点
节约药品
显色明显
减少污染
可同时进行多个实验
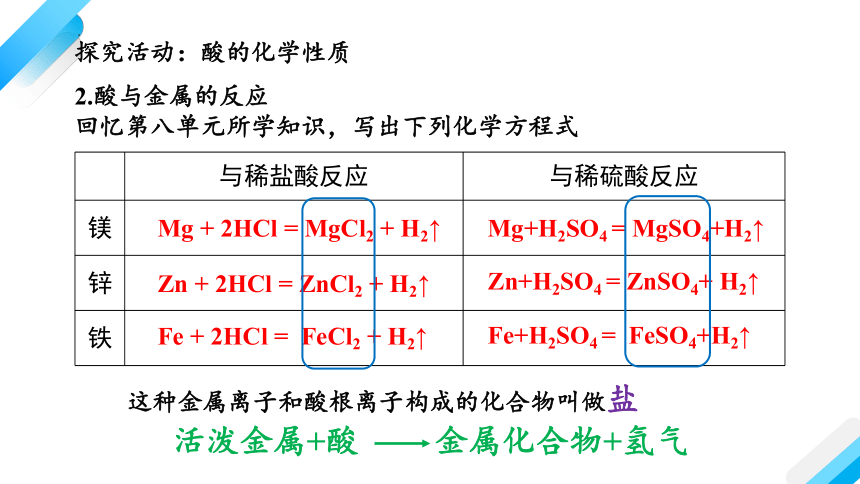
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
探究活动:酸的化学性质
2.酸与金属的反应
回忆第八单元所学知识,写出下列化学方程式
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg+H2SO4 = MgSO4+H2↑
Zn+H2SO4 = ZnSO4+ H2↑
Fe+H2SO4 = FeSO4+H2↑
活泼金属+酸 金属化合物+氢气
这种金属离子和酸根离子构成的化合物叫做盐
思考:想一想,为什么不可将醋放在铁锅里长时间烹调,不可用铝制品调拌要放醋的凉菜?
食醋中含有醋酸,能与铁、铝发生化学反应
探究活动:酸的化学性质
3.1.酸与氧化铁的反应
探究活动:酸的化学性质
3.1.酸与氧化铁的反应
现象 化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
Fe2O3+3H2SO4 =Fe2(SO4)3 +3H2O
铁锈溶解,溶液由无色变黄色。
铁锈溶解,溶液由无色变黄色。
Fe2O3+6HCl == 2FeCl3 +3H2O
金属氧化物+酸 盐+水
交流讨论:能不能将铁钉长时间浸泡在酸溶液中?
反应初期:酸溶液与铁锈发生了反应
铁锈消失后:酸溶液又与铁发生了反应
Fe2O3 + 6HCl == 2FeCl3+ 3H2O
Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
溶液为黄色
有气泡产生,溶液为浅绿色
不能
探究活动:酸的化学性质
3.1.酸与氧化铜的反应
探究活动:酸的化学性质
3.2 酸与氧化铜的反应
现象 化学方程式
CuO+ 稀盐酸
CuO+ 稀硫酸
黑色粉末溶解,溶液由无色变蓝色。
黑色粉末溶解,溶液由无色变蓝色。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
金属氧化物+酸 金属化合物+水
小结
酸的化学性质
1、酸溶液能与指示剂反应,使指示剂显示不同颜色;
2、酸溶液能与较活泼金属反应,都生成氢气;
3、酸溶液能与某些金属氧化物反应,都生成水。
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸 H++酸根离子
酸有相似化学性质,其原因是它们的溶液中都含有H+。
酸是溶于水解离出的阳离子全部是H+的化合物。
知识拓展
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。
某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因?
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,放出热量,稀硫酸与铁发生化学反应生成了氢气,氢气在爆炸极限内遇火发生了爆炸。
课堂练习
1.下列物质间充分反应后,固体全部消失的是( )
A.铁粉与足量的稀硫酸
B.生铁与足量的稀盐酸
C.大理石与足量的稀盐酸
D.铁粉与足量的硫酸铜溶液
A
2. 生锈的铁钉放入足量的稀盐酸中,片刻后观察到的现象是 ,
发生反应的化学方程式为:
;
反应一段时间后,又观察到铁钉表面 ,
发生反应的化学方程式为 。
铁锈消失,溶液由无色变为黄色
有气泡产生
(2)清洗水垢时盐酸的用量不能过多,否则会损坏水壶,原因是:_______________________________________________
反应的化学方程式 ,
_________________________________.
3.家用铝制电热水壶,长期使用后会在壶底结一层水垢(主要成分是CaCO3)
(1)用适量的稀盐酸可以除去水垢,
反应的化学方程式为 .
盐酸先与铝表面的氧化膜反应,后与内部的铝反应
CaCO3+2HCl= CaCl2+H2O+CO2↑
Al2O3+6HCl= 2AlCl3+3H2O
2Al+6HCl= 2AlCl3+3H2↑
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
人教版 九年级化学 下册
第十单元 课题1
常见的酸和碱
(第三课时)
1、某无色溶液中滴加无色酚酞溶液,酚酞溶液变红,若滴加紫色石蕊溶液,则石蕊溶液变( )。
A、红色 B、紫色 C、蓝色 D、无色
2、同学们打开盛有浓盐酸和浓硫酸的试剂瓶的瓶塞,立即就能把它们区分开来,这是为什么?
C
3、现有稀盐酸、澄清石灰水和蒸馏水各一瓶,请你设计实验将它们一一鉴别开?
各取少量试剂于试管中,分别向试管中滴加几滴紫色石蕊溶液,震荡,若紫色石蕊溶液变红,则原溶液是稀盐酸,若紫色石蕊溶液变蓝,则原溶液是澄清石灰水,若不变色,则原溶液是蒸馏水。
浓盐酸具有挥发性,打开瓶塞有白雾出现
4、按照如图所示的装置,在锥形瓶中盛浓硫酸,在分液漏斗中装水。打开分液漏斗的活塞,让水滴入锥形瓶。
(1)你可观察到什么现象?
(2)分析产生上述现象的原因。
(3)写出实验室正确稀释浓硫酸的操作步骤。
酸液飞溅
将水倒入浓硫酸中,水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热会使水沸腾,造成酸液飞溅。
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
5、实验室利用下面装置制取并收集干燥的二氧化碳,A中发生反应的化学方程式 ;B中应盛放的试剂是 ;装置的连接顺序是(填导管口字母) ;用上述连接好的装置还能制取另一种气体,制取该气体的化学方程式是 。
CaCO3+2HCl==CaCl2 + H2O+CO2↑
浓硫酸
acbde
2H2O2
MnO2
2H2O + O2
之前我们学习过有关酸溶液的反应,你能回忆起来吗?
锌、铁等金属与酸反应
实
验
室
制
取
CO2
碳酸钙与盐酸反应
碳酸钠与盐酸反应
酸与指示剂的作用
酸的化学性质有哪些呢?我们来学习一下吧
探究活动:酸的化学性质
1.酸与指示剂的作用
紫色石蕊溶液 无色酚酞溶液
稀盐酸
稀硫酸
变红
不变色
变红
不变色
酸能使紫色的石蕊溶液变为红色;
酸不能使无色的酚酞溶液变色。
白色点滴板优点
节约药品
显色明显
减少污染
可同时进行多个实验
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
探究活动:酸的化学性质
2.酸与金属的反应
回忆第八单元所学知识,写出下列化学方程式
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg+H2SO4 = MgSO4+H2↑
Zn+H2SO4 = ZnSO4+ H2↑
Fe+H2SO4 = FeSO4+H2↑
活泼金属+酸 金属化合物+氢气
这种金属离子和酸根离子构成的化合物叫做盐
思考:想一想,为什么不可将醋放在铁锅里长时间烹调,不可用铝制品调拌要放醋的凉菜?
食醋中含有醋酸,能与铁、铝发生化学反应
探究活动:酸的化学性质
3.1.酸与氧化铁的反应
探究活动:酸的化学性质
3.1.酸与氧化铁的反应
现象 化学方程式
铁锈+稀盐酸
铁锈+稀硫酸
Fe2O3+3H2SO4 =Fe2(SO4)3 +3H2O
铁锈溶解,溶液由无色变黄色。
铁锈溶解,溶液由无色变黄色。
Fe2O3+6HCl == 2FeCl3 +3H2O
金属氧化物+酸 盐+水
交流讨论:能不能将铁钉长时间浸泡在酸溶液中?
反应初期:酸溶液与铁锈发生了反应
铁锈消失后:酸溶液又与铁发生了反应
Fe2O3 + 6HCl == 2FeCl3+ 3H2O
Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
溶液为黄色
有气泡产生,溶液为浅绿色
不能
探究活动:酸的化学性质
3.1.酸与氧化铜的反应
探究活动:酸的化学性质
3.2 酸与氧化铜的反应
现象 化学方程式
CuO+ 稀盐酸
CuO+ 稀硫酸
黑色粉末溶解,溶液由无色变蓝色。
黑色粉末溶解,溶液由无色变蓝色。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
金属氧化物+酸 金属化合物+水
小结
酸的化学性质
1、酸溶液能与指示剂反应,使指示剂显示不同颜色;
2、酸溶液能与较活泼金属反应,都生成氢气;
3、酸溶液能与某些金属氧化物反应,都生成水。
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸 H++酸根离子
酸有相似化学性质,其原因是它们的溶液中都含有H+。
酸是溶于水解离出的阳离子全部是H+的化合物。
知识拓展
常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应,所以可以用铁罐车运输浓硫酸。
某新上岗的工人违反操作规定,边吸烟边用水冲洗运输过浓硫酸的铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因?
用水冲洗铁罐车时,浓硫酸被稀释成稀硫酸,放出热量,稀硫酸与铁发生化学反应生成了氢气,氢气在爆炸极限内遇火发生了爆炸。
课堂练习
1.下列物质间充分反应后,固体全部消失的是( )
A.铁粉与足量的稀硫酸
B.生铁与足量的稀盐酸
C.大理石与足量的稀盐酸
D.铁粉与足量的硫酸铜溶液
A
2. 生锈的铁钉放入足量的稀盐酸中,片刻后观察到的现象是 ,
发生反应的化学方程式为:
;
反应一段时间后,又观察到铁钉表面 ,
发生反应的化学方程式为 。
铁锈消失,溶液由无色变为黄色
有气泡产生
(2)清洗水垢时盐酸的用量不能过多,否则会损坏水壶,原因是:_______________________________________________
反应的化学方程式 ,
_________________________________.
3.家用铝制电热水壶,长期使用后会在壶底结一层水垢(主要成分是CaCO3)
(1)用适量的稀盐酸可以除去水垢,
反应的化学方程式为 .
盐酸先与铝表面的氧化膜反应,后与内部的铝反应
CaCO3+2HCl= CaCl2+H2O+CO2↑
Al2O3+6HCl= 2AlCl3+3H2O
2Al+6HCl= 2AlCl3+3H2↑
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
