2022—2023学年化学人教版九年级下册第九单元 溶液 分层选练题(有答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第九单元 溶液 分层选练题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 636.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-03 12:49:12 | ||
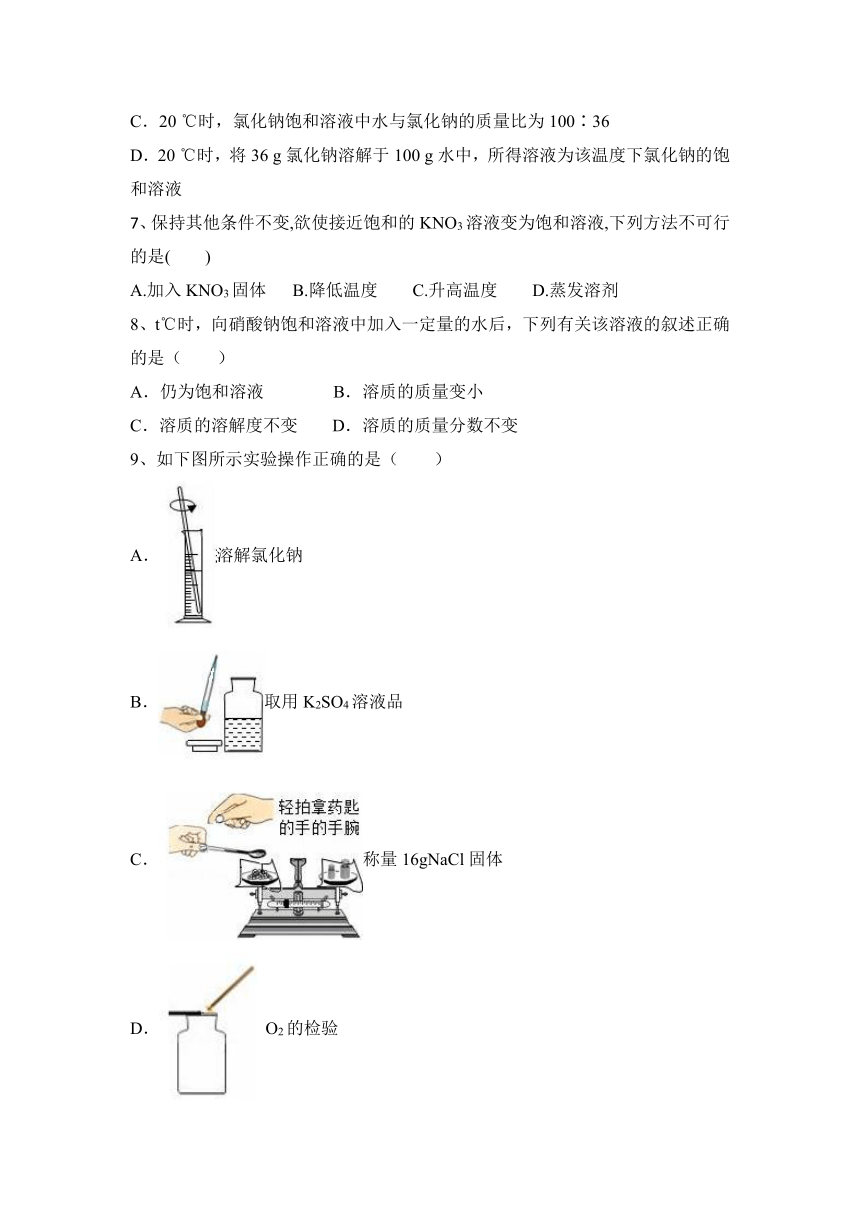
图片预览




文档简介
2022—2023学年化学人教版九年级下册第九单元 溶液 分层选练题含答案
人教第九单元 溶液
一、选择题。
1、下列物质溶于水时,溶液温度明显下降的是( )
A、食盐 B. 浓硫酸 C. 硝酸铵 D. 氢氧化钠
2、在工农业生产中,许多化学反应都在溶液中进行的主要原因是( )
A.便于观察现象 B.溶液间的反应不需要加热
C.水是反应的催化剂 D.溶液中分子或离子接触充分,反应速率快
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
4、下列操作,原理利用了乳化作用的是( )
A.修车工用汽油洗去手上的油污
B.用酒精洗掉衣服上圆珠笔油
C.用洗涤灵清洗餐具上的油污
D.用蒸馏水清洗试管内壁附着的氯化钠固体
5、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是 ( )
A.恒温蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
6、20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
7、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法不可行的是( )
A.加入KNO3固体 B.降低温度 C.升高温度 D.蒸发溶剂
8、t℃时,向硝酸钠饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.溶质的溶解度不变 D.溶质的质量分数不变
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
10、下列说法正确的是( )
A.溶液都是均一、稳定、无色透明的
B.金刚石、石墨、活性炭性质相同
C.排放CO2是引起酸雨的主要原因
D.空气中O2的体积约占21%
11、根据图所示实验判断,下列说法正确的是 ( )
A.氯化钠的饱和溶液中不能溶解其他溶质
B.20 mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量增加
D.加热后硝酸钾溶液是不饱和溶液
12、某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是( )
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200ml量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
13、小明在实验操作技能考试中抽中的题目是:用固体氯化钠配制50 g 溶质质量分数为6% 的氯化钠溶液。他的有关做法中正确的是( )
A. 选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B. 将氯化钠直接放在托盘天平左盘上称量3.0 g
C.用100 mL 量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
14、从化学的角度看下列分析或做法,错误的是( )
A.洗涤剂清除油污利用了乳化功能
B.天然气泄露,立即关闭阀门并开窗通风
C.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀
D.炒菜时油锅着火,立即用水浇灭
15、20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.第一组所得溶液为不饱和溶液
B.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
C、用蒸发的方法可以使不饱和溶液变成饱和溶液
D.第二组所得溶液中溶质与溶剂的质量比为 9∶25
二、填空题。
16、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__(填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__乙(填“大于”、“等于”、“小于”)。
17、如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题。
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)P点表示的意义是 。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度随温度的升高而减小。
(4)要将A的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(5)将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,不会析出晶体的是 。
18、请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 ________ 10 ________
150 ________ ________ 16%
19、量取水时,选量筒的原则:在一次量取的前提下,量程要__ __。量取时先倾倒至接近刻度,再用__ __滴加至所需刻度。
20、如图是A、B两种物质的溶解度曲线,回答下列问题:
⑴t3℃时,A、B两种物质的溶解度大小顺序是:___________;
⑵M点表示的含义是:_________;
⑶将含等质量溶剂的A、B两种饱和溶液从t3℃降温至t1℃,析出晶体较多的是______。
21、炎热的夏天,在家中可以自制汽水来解暑消热。
【准备材料】1.5 g小苏打、1.5 g柠檬酸、蔗糖、果汁、凉开水、500 mL的饮料瓶。(柠檬酸与小苏打发生反应生成二氧化碳气体)
【配制流程】
下列是制汽水的操作或现象的相关问题,请回答:
Ⅰ、步骤②中为什么要用凉开水制汽水
。
Ⅱ、步骤③旋紧瓶盖后,为什么汽水中的气泡会由多变少直至不再冒出
。
22、如图是氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
(1)30℃时,氯化钠的溶解度________ 碳酸钠的溶解度.(填“>”、“<”或“=”)
(2)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,两种溶液中溶质的质量分数大的是________溶液;
(3)将30℃时相同质量的饱和溶液,分别降温到10℃,晶体析出较多的是________ 。
(4)如图2所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是________ (填字母序号)。
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
23、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
三、实验题。
24、实验室常用的气体发生装置如图一所示。
①实验室常用溶质质量分数为5%的过氧化氢溶液制取氧气,“5%”的含义是________。
②用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是________(选填装置编号);
③探究溶质质量分数、催化剂质量、温度等因素对过氧化氢分解速率的影响,设计以下实验方案,其中实验甲、乙、丙的目的是________;实验戊中,w=________,t=________。
实验序号 过氧化氢溶液溶质质量分数 二氧化锰质量(g) 温度(℃)
甲 10% 0.5 20
乙 10% 1 20
丙 10% 1.5 20
丁 5% 1.5 30
戊 w 1.5 t
④加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是________;有关该实验的说法合理的是________(选填编号)。
a.实验开始前装置D中必须装满水
b.连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D装置,防止液体倒流
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 分层选练题含答案
人教第九单元 溶液
一、选择题。
1、下列物质溶于水时,溶液温度明显下降的是( )
A、食盐 B. 浓硫酸 C. 硝酸铵 D. 氢氧化钠
【答案】C
2、在工农业生产中,许多化学反应都在溶液中进行的主要原因是( )
A.便于观察现象 B.溶液间的反应不需要加热
C.水是反应的催化剂 D.溶液中分子或离子接触充分,反应速率快
【答案】D
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
【答案】C
4、下列操作,原理利用了乳化作用的是( )
A.修车工用汽油洗去手上的油污
B.用酒精洗掉衣服上圆珠笔油
C.用洗涤灵清洗餐具上的油污
D.用蒸馏水清洗试管内壁附着的氯化钠固体
【答案】C
5、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是 ( )
A.恒温蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
【答案】B
6、20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
【答案】B
7、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法不可行的是( )
A.加入KNO3固体 B.降低温度 C.升高温度 D.蒸发溶剂
【答案】C
8、t℃时,向硝酸钠饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.溶质的溶解度不变 D.溶质的质量分数不变
【答案】C
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
【答案】C
10、下列说法正确的是( )
A.溶液都是均一、稳定、无色透明的
B.金刚石、石墨、活性炭性质相同
C.排放CO2是引起酸雨的主要原因
D.空气中O2的体积约占21%
【答案】D
11、根据图所示实验判断,下列说法正确的是 ( )
A.氯化钠的饱和溶液中不能溶解其他溶质
B.20 mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量增加
D.加热后硝酸钾溶液是不饱和溶液
【答案】C
12、某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是( )
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200ml量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
【答案】B
13、小明在实验操作技能考试中抽中的题目是:用固体氯化钠配制50 g 溶质质量分数为6% 的氯化钠溶液。他的有关做法中正确的是( )
A. 选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B. 将氯化钠直接放在托盘天平左盘上称量3.0 g
C.用100 mL 量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
【答案】A
14、从化学的角度看下列分析或做法,错误的是( )
A.洗涤剂清除油污利用了乳化功能
B.天然气泄露,立即关闭阀门并开窗通风
C.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀
D.炒菜时油锅着火,立即用水浇灭
【答案】D
15、20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.第一组所得溶液为不饱和溶液
B.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
C、用蒸发的方法可以使不饱和溶液变成饱和溶液
D.第二组所得溶液中溶质与溶剂的质量比为 9∶25
【答案】B
二、填空题。
16、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__(填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__乙(填“大于”、“等于”、“小于”)。
【答案】 升高温度 甲 降温结晶 小于
17、如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题。
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)P点表示的意义是 。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度随温度的升高而减小。
(4)要将A的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(5)将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,不会析出晶体的是 。
【答案】(1)C>B>A (2)t1 ℃时,A、C两种物质的溶解度相同
(3)C A (4)升高温度(或加入A物质或恒温蒸发溶剂) (5)A
18、请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 ________ 10 ________
150 ________ ________ 16%
【答案】 190;5%;126;24
19、量取水时,选量筒的原则:在一次量取的前提下,量程要__ __。量取时先倾倒至接近刻度,再用__ __滴加至所需刻度。
【答案】小 胶头滴管
20、如图是A、B两种物质的溶解度曲线,回答下列问题:
⑴t3℃时,A、B两种物质的溶解度大小顺序是:___________;
⑵M点表示的含义是:_________;
⑶将含等质量溶剂的A、B两种饱和溶液从t3℃降温至t1℃,析出晶体较多的是______。
【答案】A > B t20C时,A、B两种物质的溶解度相等 A
21、炎热的夏天,在家中可以自制汽水来解暑消热。
【准备材料】1.5 g小苏打、1.5 g柠檬酸、蔗糖、果汁、凉开水、500 mL的饮料瓶。(柠檬酸与小苏打发生反应生成二氧化碳气体)
【配制流程】
下列是制汽水的操作或现象的相关问题,请回答:
Ⅰ、步骤②中为什么要用凉开水制汽水
。
Ⅱ、步骤③旋紧瓶盖后,为什么汽水中的气泡会由多变少直至不再冒出
。
【答案】Ⅰ、凉开水温度较低,二氧化碳的溶解度随温度的降低而增大
Ⅱ、旋紧瓶盖后,瓶内压强增大,二氧化碳的溶解度增大
22、如图是氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
(1)30℃时,氯化钠的溶解度________ 碳酸钠的溶解度.(填“>”、“<”或“=”)
(2)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,两种溶液中溶质的质量分数大的是________溶液;
(3)将30℃时相同质量的饱和溶液,分别降温到10℃,晶体析出较多的是________ 。
(4)如图2所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是________ (填字母序号)。
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
【答案】=;氯化钠;碳酸钠溶液;C
23、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
【答案】天平平衡 NaCl 砝码
三、实验题。
24、实验室常用的气体发生装置如图一所示。
①实验室常用溶质质量分数为5%的过氧化氢溶液制取氧气,“5%”的含义是________。
②用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是________(选填装置编号);
③探究溶质质量分数、催化剂质量、温度等因素对过氧化氢分解速率的影响,设计以下实验方案,其中实验甲、乙、丙的目的是________;实验戊中,w=________,t=________。
实验序号 过氧化氢溶液溶质质量分数 二氧化锰质量(g) 温度(℃)
甲 10% 0.5 20
乙 10% 1 20
丙 10% 1.5 20
丁 5% 1.5 30
戊 w 1.5 t
④加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是________;有关该实验的说法合理的是________(选填编号)。
a.实验开始前装置D中必须装满水
b.连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D装置,防止液体倒流
【答案】 每100g溶液中含有5g溶质;A;探究催化剂质量对过氧化氢分解速率的影响;10%;30 或( 5%、20);2KClO3 2KCl+3O2↑;ad
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
【答案】(1) 10g (2) 7.3% (3) 12.6%
人教第九单元 溶液
一、选择题。
1、下列物质溶于水时,溶液温度明显下降的是( )
A、食盐 B. 浓硫酸 C. 硝酸铵 D. 氢氧化钠
2、在工农业生产中,许多化学反应都在溶液中进行的主要原因是( )
A.便于观察现象 B.溶液间的反应不需要加热
C.水是反应的催化剂 D.溶液中分子或离子接触充分,反应速率快
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
4、下列操作,原理利用了乳化作用的是( )
A.修车工用汽油洗去手上的油污
B.用酒精洗掉衣服上圆珠笔油
C.用洗涤灵清洗餐具上的油污
D.用蒸馏水清洗试管内壁附着的氯化钠固体
5、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是 ( )
A.恒温蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
6、20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
7、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法不可行的是( )
A.加入KNO3固体 B.降低温度 C.升高温度 D.蒸发溶剂
8、t℃时,向硝酸钠饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.溶质的溶解度不变 D.溶质的质量分数不变
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
10、下列说法正确的是( )
A.溶液都是均一、稳定、无色透明的
B.金刚石、石墨、活性炭性质相同
C.排放CO2是引起酸雨的主要原因
D.空气中O2的体积约占21%
11、根据图所示实验判断,下列说法正确的是 ( )
A.氯化钠的饱和溶液中不能溶解其他溶质
B.20 mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量增加
D.加热后硝酸钾溶液是不饱和溶液
12、某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是( )
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200ml量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
13、小明在实验操作技能考试中抽中的题目是:用固体氯化钠配制50 g 溶质质量分数为6% 的氯化钠溶液。他的有关做法中正确的是( )
A. 选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B. 将氯化钠直接放在托盘天平左盘上称量3.0 g
C.用100 mL 量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
14、从化学的角度看下列分析或做法,错误的是( )
A.洗涤剂清除油污利用了乳化功能
B.天然气泄露,立即关闭阀门并开窗通风
C.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀
D.炒菜时油锅着火,立即用水浇灭
15、20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.第一组所得溶液为不饱和溶液
B.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
C、用蒸发的方法可以使不饱和溶液变成饱和溶液
D.第二组所得溶液中溶质与溶剂的质量比为 9∶25
二、填空题。
16、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__(填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__乙(填“大于”、“等于”、“小于”)。
17、如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题。
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)P点表示的意义是 。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度随温度的升高而减小。
(4)要将A的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(5)将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,不会析出晶体的是 。
18、请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 ________ 10 ________
150 ________ ________ 16%
19、量取水时,选量筒的原则:在一次量取的前提下,量程要__ __。量取时先倾倒至接近刻度,再用__ __滴加至所需刻度。
20、如图是A、B两种物质的溶解度曲线,回答下列问题:
⑴t3℃时,A、B两种物质的溶解度大小顺序是:___________;
⑵M点表示的含义是:_________;
⑶将含等质量溶剂的A、B两种饱和溶液从t3℃降温至t1℃,析出晶体较多的是______。
21、炎热的夏天,在家中可以自制汽水来解暑消热。
【准备材料】1.5 g小苏打、1.5 g柠檬酸、蔗糖、果汁、凉开水、500 mL的饮料瓶。(柠檬酸与小苏打发生反应生成二氧化碳气体)
【配制流程】
下列是制汽水的操作或现象的相关问题,请回答:
Ⅰ、步骤②中为什么要用凉开水制汽水
。
Ⅱ、步骤③旋紧瓶盖后,为什么汽水中的气泡会由多变少直至不再冒出
。
22、如图是氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
(1)30℃时,氯化钠的溶解度________ 碳酸钠的溶解度.(填“>”、“<”或“=”)
(2)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,两种溶液中溶质的质量分数大的是________溶液;
(3)将30℃时相同质量的饱和溶液,分别降温到10℃,晶体析出较多的是________ 。
(4)如图2所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是________ (填字母序号)。
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
23、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
三、实验题。
24、实验室常用的气体发生装置如图一所示。
①实验室常用溶质质量分数为5%的过氧化氢溶液制取氧气,“5%”的含义是________。
②用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是________(选填装置编号);
③探究溶质质量分数、催化剂质量、温度等因素对过氧化氢分解速率的影响,设计以下实验方案,其中实验甲、乙、丙的目的是________;实验戊中,w=________,t=________。
实验序号 过氧化氢溶液溶质质量分数 二氧化锰质量(g) 温度(℃)
甲 10% 0.5 20
乙 10% 1 20
丙 10% 1.5 20
丁 5% 1.5 30
戊 w 1.5 t
④加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是________;有关该实验的说法合理的是________(选填编号)。
a.实验开始前装置D中必须装满水
b.连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D装置,防止液体倒流
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
2022—2023学年化学人教版九年级下册第九单元 溶液 分层选练题含答案
人教第九单元 溶液
一、选择题。
1、下列物质溶于水时,溶液温度明显下降的是( )
A、食盐 B. 浓硫酸 C. 硝酸铵 D. 氢氧化钠
【答案】C
2、在工农业生产中,许多化学反应都在溶液中进行的主要原因是( )
A.便于观察现象 B.溶液间的反应不需要加热
C.水是反应的催化剂 D.溶液中分子或离子接触充分,反应速率快
【答案】D
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
【答案】C
4、下列操作,原理利用了乳化作用的是( )
A.修车工用汽油洗去手上的油污
B.用酒精洗掉衣服上圆珠笔油
C.用洗涤灵清洗餐具上的油污
D.用蒸馏水清洗试管内壁附着的氯化钠固体
【答案】C
5、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法中不可行的是 ( )
A.恒温蒸发溶剂 B.升高温度 C.降低温度 D.加入KNO3固体
【答案】B
6、20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是( )
A.20 ℃时,100 g水中最多能溶解氯化钠36 g
B.20 ℃时,100 g氯化钠饱和溶液中含氯化钠36 g
C.20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20 ℃时,将36 g氯化钠溶解于100 g水中,所得溶液为该温度下氯化钠的饱和溶液
【答案】B
7、保持其他条件不变,欲使接近饱和的KNO3溶液变为饱和溶液,下列方法不可行的是( )
A.加入KNO3固体 B.降低温度 C.升高温度 D.蒸发溶剂
【答案】C
8、t℃时,向硝酸钠饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.溶质的溶解度不变 D.溶质的质量分数不变
【答案】C
9、如下图所示实验操作正确的是( )
A.溶解氯化钠
B.取用K2SO4溶液品
C.称量16gNaCl固体
D. O2的检验
【答案】C
10、下列说法正确的是( )
A.溶液都是均一、稳定、无色透明的
B.金刚石、石墨、活性炭性质相同
C.排放CO2是引起酸雨的主要原因
D.空气中O2的体积约占21%
【答案】D
11、根据图所示实验判断,下列说法正确的是 ( )
A.氯化钠的饱和溶液中不能溶解其他溶质
B.20 mL水中溶解氯化钠的最大质量是定值
C.加热后溶液中硝酸钾的质量增加
D.加热后硝酸钾溶液是不饱和溶液
【答案】C
12、某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是( )
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200ml量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
【答案】B
13、小明在实验操作技能考试中抽中的题目是:用固体氯化钠配制50 g 溶质质量分数为6% 的氯化钠溶液。他的有关做法中正确的是( )
A. 选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B. 将氯化钠直接放在托盘天平左盘上称量3.0 g
C.用100 mL 量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
【答案】A
14、从化学的角度看下列分析或做法,错误的是( )
A.洗涤剂清除油污利用了乳化功能
B.天然气泄露,立即关闭阀门并开窗通风
C.在金属表面刷漆的目的是隔绝氧气和水蒸气,防止锈蚀
D.炒菜时油锅着火,立即用水浇灭
【答案】D
15、20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.第一组所得溶液为不饱和溶液
B.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
C、用蒸发的方法可以使不饱和溶液变成饱和溶液
D.第二组所得溶液中溶质与溶剂的质量比为 9∶25
【答案】B
二、填空题。
16、作图法是常用的数据处理方法,甲、乙两种物质的溶解度曲线如下图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是__。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的__物质。
(3)若甲物质中混有少量的乙物质,提纯甲物质可采取的方法是__(填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲__乙(填“大于”、“等于”、“小于”)。
【答案】 升高温度 甲 降温结晶 小于
17、如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题。
(1)t2 ℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(2)P点表示的意义是 。
(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度随温度的升高而减小。
(4)要将A的不饱和溶液变成饱和溶液,可采取的方法有 (填一种即可)。
(5)将t2 ℃时A、B、C三种物质的饱和溶液降温到t1 ℃,不会析出晶体的是 。
【答案】(1)C>B>A (2)t1 ℃时,A、C两种物质的溶解度相同
(3)C A (4)升高温度(或加入A物质或恒温蒸发溶剂) (5)A
18、请你填全下面两种氯化钠溶液中的各个量
NaCl溶液(g) 水(g) 溶解的NaCl固体(g) 溶质的质量分数
200 ________ 10 ________
150 ________ ________ 16%
【答案】 190;5%;126;24
19、量取水时,选量筒的原则:在一次量取的前提下,量程要__ __。量取时先倾倒至接近刻度,再用__ __滴加至所需刻度。
【答案】小 胶头滴管
20、如图是A、B两种物质的溶解度曲线,回答下列问题:
⑴t3℃时,A、B两种物质的溶解度大小顺序是:___________;
⑵M点表示的含义是:_________;
⑶将含等质量溶剂的A、B两种饱和溶液从t3℃降温至t1℃,析出晶体较多的是______。
【答案】A > B t20C时,A、B两种物质的溶解度相等 A
21、炎热的夏天,在家中可以自制汽水来解暑消热。
【准备材料】1.5 g小苏打、1.5 g柠檬酸、蔗糖、果汁、凉开水、500 mL的饮料瓶。(柠檬酸与小苏打发生反应生成二氧化碳气体)
【配制流程】
下列是制汽水的操作或现象的相关问题,请回答:
Ⅰ、步骤②中为什么要用凉开水制汽水
。
Ⅱ、步骤③旋紧瓶盖后,为什么汽水中的气泡会由多变少直至不再冒出
。
【答案】Ⅰ、凉开水温度较低,二氧化碳的溶解度随温度的降低而增大
Ⅱ、旋紧瓶盖后,瓶内压强增大,二氧化碳的溶解度增大
22、如图是氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
(1)30℃时,氯化钠的溶解度________ 碳酸钠的溶解度.(填“>”、“<”或“=”)
(2)10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,两种溶液中溶质的质量分数大的是________溶液;
(3)将30℃时相同质量的饱和溶液,分别降温到10℃,晶体析出较多的是________ 。
(4)如图2所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是________ (填字母序号)。
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
【答案】=;氯化钠;碳酸钠溶液;C
23、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
【答案】天平平衡 NaCl 砝码
三、实验题。
24、实验室常用的气体发生装置如图一所示。
①实验室常用溶质质量分数为5%的过氧化氢溶液制取氧气,“5%”的含义是________。
②用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是________(选填装置编号);
③探究溶质质量分数、催化剂质量、温度等因素对过氧化氢分解速率的影响,设计以下实验方案,其中实验甲、乙、丙的目的是________;实验戊中,w=________,t=________。
实验序号 过氧化氢溶液溶质质量分数 二氧化锰质量(g) 温度(℃)
甲 10% 0.5 20
乙 10% 1 20
丙 10% 1.5 20
丁 5% 1.5 30
戊 w 1.5 t
④加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是________;有关该实验的说法合理的是________(选填编号)。
a.实验开始前装置D中必须装满水
b.连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D装置,防止液体倒流
【答案】 每100g溶液中含有5g溶质;A;探究催化剂质量对过氧化氢分解速率的影响;10%;30 或( 5%、20);2KClO3 2KCl+3O2↑;ad
四、计算类题。
25、取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:
(1)混合物CaCO3中的质量为_______;
(2)稀盐酸中的溶质质量分数为________;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)
【答案】(1) 10g (2) 7.3% (3) 12.6%
同课章节目录
