【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第五讲 电解质溶液离子反应(53张ppt)
文档属性
| 名称 | 【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第五讲 电解质溶液离子反应(53张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1008.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-15 00:00:00 | ||
图片预览











文档简介
课件53张PPT。第五讲 电解质溶液离子反应电解质?知识回顾
1.电解质:是指在________中或________状态下能导电的________。在水溶液中或________状态下________导电的________是非电解质。
2.电离是指________在溶解于水或受热熔化时,离解成能够____________的过程。
3.强电解质是指在水溶液里能__________成离子的电解质,强电解质在稀溶液中全部以________形式存在,没有________存在。强酸、强碱、大多数盐、活泼金属氧化物等都是强电解质。水溶液 熔化 化合物熔化 不能 化合物电解质自由移动离子完全电离离子分子4.弱电解质是指在水溶液里________电离成离子的电解质。,弱电解质在稀溶液中有________和________存在。弱酸、弱碱、水、有机酸等都是弱电解质。
5.电解质溶液的导电能力:离子________,离子所带________,则溶液的导电性________,反之导电性越弱。
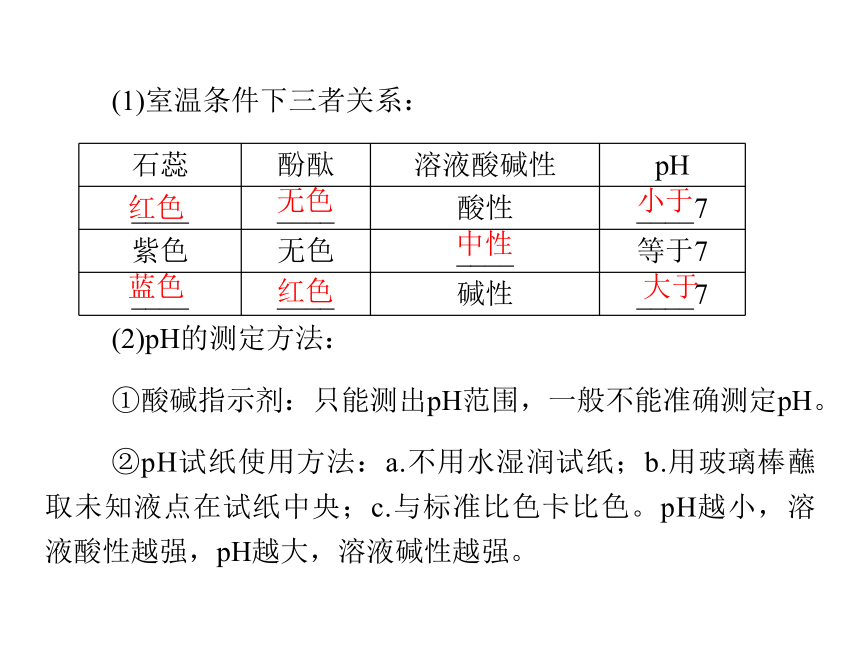
6.酸碱指示剂显色、稀溶液的酸碱性、pH不能完全分子离子浓度越大电荷越多越强(1)室温条件下三者关系:红色无色小于中性蓝色红色大于(2)pH的测定方法:
①酸碱指示剂:只能测出pH范围,一般不能准确测定pH。
②pH试纸使用方法:a.不用水湿润试纸;b.用玻璃棒蘸取未知液点在试纸中央;c.与标准比色卡比色。pH越小,溶液酸性越强,pH越大,溶液碱性越强。【例1】 (2011年广东水平考试)下列气体通入水中,不能形成电解质溶液的是( )
A.NH3 B.O2
C.HBr D.HCl解析:O2是单质,不与水反应,不能形成电解质溶液。NH3与水反应生成的NH3·H2O属于电解质,HBr和HCl是电解质,故NH3、HBr、HCl气体通入水中能形成电解质溶液。
答案:B易错提醒:1.酸、碱、盐、低价活泼金属氧化物等属于电解质。
2.非金属氧化物、高价金属氧化物、大多数有机物不属于电解质。SO2、SO3、NH3等水溶液的导电,不是它们自身电离的离子导电,是与水反应的生成物电离出的离子导电,它们不属于电解质。
3.单质与混合物既不属于电解质又不属于非电解质。如钠、石墨、氯气、盐酸溶液等。
4.难溶物质在熔化条件下能电离的属于电解质。如BaSO4、MgO等。5.浓度不同的强电解质溶液的导电性不一定比弱电解质溶液的导电性强。但同浓度、同温度时,强电解质溶液的导电性比弱电解质溶液的导电性强。
6.HCl、H2SO4等酸是共价化合物,它们的纯液体不导电。在水中发生电离反应后能导电。
7.电离方程式:强电解质的电离方程式用“===”表示电离完全,弱电解质的电离方程式用“??”表示电离不完全。?课堂练习
1.下列物质属于非电解质的是( )
A.碳酸钠 B.蔗糖
C.氢氧化钠 D.硫酸解析:酸、碱、盐属于电解质。蔗糖属于有机物中糖类物质,不属于电解质。
答案:B2.下列实验过程中,溶液的pH增大的是( )
A.向NaOH溶液中加水
B.向NaCl溶液中滴加稀盐酸
C.向NaOH溶液中滴加稀盐酸
D.向稀盐酸中滴加NaOH溶液解析:NaOH中和HCl,溶液酸性减弱,pH增大。
答案:D离子反应?知识回顾
1.离子反应特点:在反应过程中有________参加或生成,离子的________和(或)________发生变化。
2.离子反应发生条件
(1)生成________物质如:CaCO3、AgCl、BaSO4、Fe(OH)3等。
(2)生成________物质如:弱酸、弱碱、水等。
(3)生成挥发性物质如CO2、SO2等。
(4)有元素价态和(或)离子种类发生变化的氧化还原反应。离子数量种类难溶难电离3.离子共存问题的判断
(1)判断离子之间能否共存的条件是:离子之间不发生反应即可共存,若反应则不能大量共存。
(2)常见不能相互共存离子组:离子方程式?知识回顾
1.意义:离子方程式代表的不仅是某________反应,还可以表示某________反应。如:
(1)NaOH+HCl===NaCl+H2O;(2)2KOH+H2SO4===K2SO4+2H2O;(3)NaOH+HNO3===NaNO3+H2O
(1)(2)(3)反应的离子反应方程式都可用:H++OH-===H2O表示。一个一类2.书写原则
(1)只表示实际参加反应的________和(或)单质、化合物的________,删去没有参加反应的离子和(或)单质、化合物的化学式。
(2)离子方程式中可溶性强酸、强碱、可溶性盐用________形式表示。单质、氧化物、弱酸、弱碱、难溶盐等都用化学式表示。
(3)用“↑”“↓”注明气体,沉淀状态。
(4)使方程式两边离子带________总量和______个数相等。离子化学式离子电荷原子解析:Fe与HCl反应生成Fe2+,Fe+2H+===Fe2++H2↑(该题与2012年1月广东水平考试18题相同)。
答案:C解析:选项A错误,硫酸是强酸,完全电离正确式NaHSO4=Na++H++SO;选项B正确;选项C错误,Fe只生成Fe2+,正确式Fe+2H+===Fe2++H2↑;选项D错误,氨水中的NH3·H2O为难电离的弱碱,应写分子式。正确式是Al3++3NH3·H2O===Al(OH)3↓+3NH。
答案:B7.下列化学方程式中,不能用离子方程式H++OH-===H2O表示的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Ba(OH)2+2HCl===BaCl2+2H2O
C.Ba(OH)2+H2SO4===BaSO4↓+2H2O
D.Na2CO3+H2SO4===Na2SO4+H2O+CO2↑常见离子的检验方法?知识回顾
1.常见阳离子的特征反应和检验方法。9.(2012广东水平考试)可用于沉淀Ba2+的试剂有( )
A.NaCl溶液 B.Na2CO3溶液
C.Na2SO4溶液 D.NaNO3溶液一、单选题考点一 电解质1.下列物质属于电解质的是( )
A.Cu B.N2
C.KNO3 D.C2H5OH解析:电解质研究的对象是化合物,是在水溶液或熔融状态能导电的化合物。A、B两项为单质,D项的水溶液不导电。C项是强电解质。
答案:C2.下列物质的水溶液其溶质能导电,但该物质属于非电解质的是( )
A.Cu B.SO2
C.HCl D.CH3CH2OH解析:SO2是非电解质,SO2与水反应生成的硫酸是电解质,能导电;CH3CH2OH是非电解质不导电。
答案:B3.(2012年广东学业水平考试)通入水中能形成电解质溶液的气体是( )
A.HCl B.N2
C.CH4 D.CO解析:HCl是电解质,其水溶液盐酸是电解质溶液。N2、CH4、CO不属于电解质,也不与水反应生成电解质。
答案:A考点二 离子反应6.不能与BaCl2溶液形成沉淀的试剂( )
A.NaCl溶液 B.Na2CO3溶液
C.Na2SO4溶液 D.AgNO3溶液考点三 离子方程式12.下列反应的离子方程式能用H++OH-===H2O表示的是( )
A.氢氧化铝与盐酸反应
B.石灰水跟硫酸溶液反应
C.氢氧化钠溶液与硫酸溶液反应
D.氨气通入稀盐酸溶液中解析:选项A错误,正确式:Fe+2H+===Fe2++H2↑(2010年广东水平考试16题相同)。
答案:A考点四 常见离子的检验方法16.(2012年广东水平考试)可用于鉴别KCl和KOH两种溶液的试剂是( )
A.NaCl溶液 B.酚酞溶液
C.Na2CO3溶液 D.KNO3溶液解析:KCl溶液显中性,遇酚酞溶液不变色。KOH溶液显碱性,遇酚酞溶液由无色变红色。
答案:B17.(2012年广东水平考试)可与NaCl溶液反应生成沉淀且沉淀不溶于稀HNO3的是( )
A.NaOH B.H2SO4
C.Na2CO3 D.AgNO3解析:NaCl与AgNO3反应生成不溶于HNO3的AgCl白色沉淀。
答案:D二、多选题
21.下列属于非电解质的是( )
A.铝 B.小苏打
C.酒精 D.干冰解析:铝是单质,既不属于电解质,也不属于非电解质;小苏打是盐属于电解质;酒精是有机物乙醇,不属于电解质;干冰是非金属氧化物固态的CO2,不属于电解质。
答案:CD感谢您的使用,退出请按ESC键本小节结束
1.电解质:是指在________中或________状态下能导电的________。在水溶液中或________状态下________导电的________是非电解质。
2.电离是指________在溶解于水或受热熔化时,离解成能够____________的过程。
3.强电解质是指在水溶液里能__________成离子的电解质,强电解质在稀溶液中全部以________形式存在,没有________存在。强酸、强碱、大多数盐、活泼金属氧化物等都是强电解质。水溶液 熔化 化合物熔化 不能 化合物电解质自由移动离子完全电离离子分子4.弱电解质是指在水溶液里________电离成离子的电解质。,弱电解质在稀溶液中有________和________存在。弱酸、弱碱、水、有机酸等都是弱电解质。
5.电解质溶液的导电能力:离子________,离子所带________,则溶液的导电性________,反之导电性越弱。
6.酸碱指示剂显色、稀溶液的酸碱性、pH不能完全分子离子浓度越大电荷越多越强(1)室温条件下三者关系:红色无色小于中性蓝色红色大于(2)pH的测定方法:
①酸碱指示剂:只能测出pH范围,一般不能准确测定pH。
②pH试纸使用方法:a.不用水湿润试纸;b.用玻璃棒蘸取未知液点在试纸中央;c.与标准比色卡比色。pH越小,溶液酸性越强,pH越大,溶液碱性越强。【例1】 (2011年广东水平考试)下列气体通入水中,不能形成电解质溶液的是( )
A.NH3 B.O2
C.HBr D.HCl解析:O2是单质,不与水反应,不能形成电解质溶液。NH3与水反应生成的NH3·H2O属于电解质,HBr和HCl是电解质,故NH3、HBr、HCl气体通入水中能形成电解质溶液。
答案:B易错提醒:1.酸、碱、盐、低价活泼金属氧化物等属于电解质。
2.非金属氧化物、高价金属氧化物、大多数有机物不属于电解质。SO2、SO3、NH3等水溶液的导电,不是它们自身电离的离子导电,是与水反应的生成物电离出的离子导电,它们不属于电解质。
3.单质与混合物既不属于电解质又不属于非电解质。如钠、石墨、氯气、盐酸溶液等。
4.难溶物质在熔化条件下能电离的属于电解质。如BaSO4、MgO等。5.浓度不同的强电解质溶液的导电性不一定比弱电解质溶液的导电性强。但同浓度、同温度时,强电解质溶液的导电性比弱电解质溶液的导电性强。
6.HCl、H2SO4等酸是共价化合物,它们的纯液体不导电。在水中发生电离反应后能导电。
7.电离方程式:强电解质的电离方程式用“===”表示电离完全,弱电解质的电离方程式用“??”表示电离不完全。?课堂练习
1.下列物质属于非电解质的是( )
A.碳酸钠 B.蔗糖
C.氢氧化钠 D.硫酸解析:酸、碱、盐属于电解质。蔗糖属于有机物中糖类物质,不属于电解质。
答案:B2.下列实验过程中,溶液的pH增大的是( )
A.向NaOH溶液中加水
B.向NaCl溶液中滴加稀盐酸
C.向NaOH溶液中滴加稀盐酸
D.向稀盐酸中滴加NaOH溶液解析:NaOH中和HCl,溶液酸性减弱,pH增大。
答案:D离子反应?知识回顾
1.离子反应特点:在反应过程中有________参加或生成,离子的________和(或)________发生变化。
2.离子反应发生条件
(1)生成________物质如:CaCO3、AgCl、BaSO4、Fe(OH)3等。
(2)生成________物质如:弱酸、弱碱、水等。
(3)生成挥发性物质如CO2、SO2等。
(4)有元素价态和(或)离子种类发生变化的氧化还原反应。离子数量种类难溶难电离3.离子共存问题的判断
(1)判断离子之间能否共存的条件是:离子之间不发生反应即可共存,若反应则不能大量共存。
(2)常见不能相互共存离子组:离子方程式?知识回顾
1.意义:离子方程式代表的不仅是某________反应,还可以表示某________反应。如:
(1)NaOH+HCl===NaCl+H2O;(2)2KOH+H2SO4===K2SO4+2H2O;(3)NaOH+HNO3===NaNO3+H2O
(1)(2)(3)反应的离子反应方程式都可用:H++OH-===H2O表示。一个一类2.书写原则
(1)只表示实际参加反应的________和(或)单质、化合物的________,删去没有参加反应的离子和(或)单质、化合物的化学式。
(2)离子方程式中可溶性强酸、强碱、可溶性盐用________形式表示。单质、氧化物、弱酸、弱碱、难溶盐等都用化学式表示。
(3)用“↑”“↓”注明气体,沉淀状态。
(4)使方程式两边离子带________总量和______个数相等。离子化学式离子电荷原子解析:Fe与HCl反应生成Fe2+,Fe+2H+===Fe2++H2↑(该题与2012年1月广东水平考试18题相同)。
答案:C解析:选项A错误,硫酸是强酸,完全电离正确式NaHSO4=Na++H++SO;选项B正确;选项C错误,Fe只生成Fe2+,正确式Fe+2H+===Fe2++H2↑;选项D错误,氨水中的NH3·H2O为难电离的弱碱,应写分子式。正确式是Al3++3NH3·H2O===Al(OH)3↓+3NH。
答案:B7.下列化学方程式中,不能用离子方程式H++OH-===H2O表示的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Ba(OH)2+2HCl===BaCl2+2H2O
C.Ba(OH)2+H2SO4===BaSO4↓+2H2O
D.Na2CO3+H2SO4===Na2SO4+H2O+CO2↑常见离子的检验方法?知识回顾
1.常见阳离子的特征反应和检验方法。9.(2012广东水平考试)可用于沉淀Ba2+的试剂有( )
A.NaCl溶液 B.Na2CO3溶液
C.Na2SO4溶液 D.NaNO3溶液一、单选题考点一 电解质1.下列物质属于电解质的是( )
A.Cu B.N2
C.KNO3 D.C2H5OH解析:电解质研究的对象是化合物,是在水溶液或熔融状态能导电的化合物。A、B两项为单质,D项的水溶液不导电。C项是强电解质。
答案:C2.下列物质的水溶液其溶质能导电,但该物质属于非电解质的是( )
A.Cu B.SO2
C.HCl D.CH3CH2OH解析:SO2是非电解质,SO2与水反应生成的硫酸是电解质,能导电;CH3CH2OH是非电解质不导电。
答案:B3.(2012年广东学业水平考试)通入水中能形成电解质溶液的气体是( )
A.HCl B.N2
C.CH4 D.CO解析:HCl是电解质,其水溶液盐酸是电解质溶液。N2、CH4、CO不属于电解质,也不与水反应生成电解质。
答案:A考点二 离子反应6.不能与BaCl2溶液形成沉淀的试剂( )
A.NaCl溶液 B.Na2CO3溶液
C.Na2SO4溶液 D.AgNO3溶液考点三 离子方程式12.下列反应的离子方程式能用H++OH-===H2O表示的是( )
A.氢氧化铝与盐酸反应
B.石灰水跟硫酸溶液反应
C.氢氧化钠溶液与硫酸溶液反应
D.氨气通入稀盐酸溶液中解析:选项A错误,正确式:Fe+2H+===Fe2++H2↑(2010年广东水平考试16题相同)。
答案:A考点四 常见离子的检验方法16.(2012年广东水平考试)可用于鉴别KCl和KOH两种溶液的试剂是( )
A.NaCl溶液 B.酚酞溶液
C.Na2CO3溶液 D.KNO3溶液解析:KCl溶液显中性,遇酚酞溶液不变色。KOH溶液显碱性,遇酚酞溶液由无色变红色。
答案:B17.(2012年广东水平考试)可与NaCl溶液反应生成沉淀且沉淀不溶于稀HNO3的是( )
A.NaOH B.H2SO4
C.Na2CO3 D.AgNO3解析:NaCl与AgNO3反应生成不溶于HNO3的AgCl白色沉淀。
答案:D二、多选题
21.下列属于非电解质的是( )
A.铝 B.小苏打
C.酒精 D.干冰解析:铝是单质,既不属于电解质,也不属于非电解质;小苏打是盐属于电解质;酒精是有机物乙醇,不属于电解质;干冰是非金属氧化物固态的CO2,不属于电解质。
答案:CD感谢您的使用,退出请按ESC键本小节结束
同课章节目录
