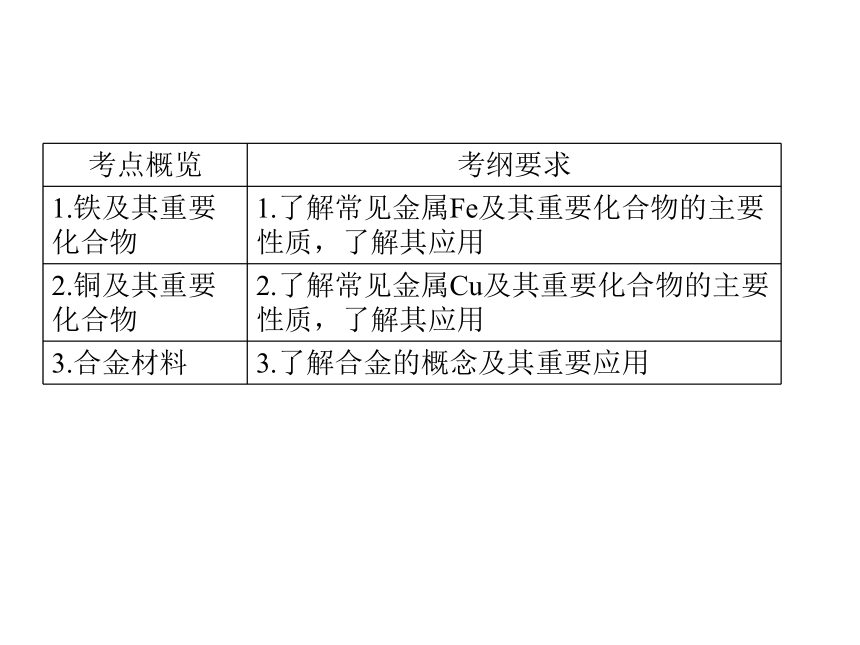
【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第八讲 金属元素二 铁、铜(39张ppt)
文档属性
| 名称 | 【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第八讲 金属元素二 铁、铜(39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 573.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-15 08:26:33 | ||
图片预览










文档简介
课件39张PPT。第八讲 金属元素(二) 铁、铜铁及其重要化合物?知识回顾
1.铁单质
(1)物理性质:纯铁________色,密度大,熔沸点高,有较好的________性、________性、导热性,能被________吸引。铁属黑色金属。
(2)化学性质:
①常见化合价0价、+2价、+3价,Fe3+比Fe2+________。银白延展导电磁铁稳定②在常温干燥的空气中,纯铁________被腐蚀,潮湿空气中,铁________与O2和H2O共同反应生成________色疏松的铁锈(主要成分Fe2O3)。
③铁在冷浓硫酸、硝酸中发生________反应,表面生成致密的氧化物保护膜。
④Fe在与弱氧化剂反应被氧化为+2。如:
Fe+2HCl===____________;Fe+Cu2+===________;Fe+S ________;Fe+2Fe3+=________。
不易易棕褐钝化FeCl2+H2↑ Cu+Fe2+FeS3Fe2+⑤Fe与强氧化剂反应被氧化为+3。如:
2Fe+3Cl2 ________;Fe+4HNO3(稀)===Fe(NO3)3+2H2O+________。
2.铁的化合物
(1)铁的氧化物:FeO黑色、易氧化;Fe3O4黑色、有磁性、俗称磁铁;Fe2O3俗称________,可作颜料;都能与酸反应而溶解,均是炼铁原料。
(2)氢氧化物:
①Fe(OH)2在空气中易被氧化生成________的Fe(OH)3。
②Fe(OH)3不溶于水,受热分解生成红色______。2FeCl3NO↑铁红红褐色Fe2O3 (3)二价铁盐与三价铁盐:Fe2+(浅绿色)与Fe3+(棕黄色)之间的转化:
Ⅰ.Fe2+转变为Fe3+需加入氧化剂:Cl2、O2、HNO3、Na2O2、H2O2、酸性KMnO4等。如:
Cl2+2Fe2+===____________;4Fe2++O2+4H+===____________。
Ⅱ.Fe3+转变为Fe2+需加入还原剂Fe、Cu、SO2等。如:2Fe3++Cu===______________。
(4)Fe3+检验:Fe3+与KSCN反应Fe3++3SCN-===Fe(SCN)3,溶液为血红色。2Fe3++2Cl-4Fe3++2H2O2Fe2++Cu2+3.铁的冶炼
(1)主要原料:主要是各种铁矿石、________。
(2)主要反应原理:C+CO2 ____________;Fe2O3+3CO _____________。焦炭2CO2Fe+3CO2【例1】 下列操作中,溶液的颜色不发生变化的是( )
A.氯化铁溶液中加入足量铁粉,充分振荡
B.氯化铁溶液中滴加几滴硫氰化钾(KSCN)溶液
C.四氧化三铁固体加入稀盐酸中,完全溶解
D.氯化亚铁溶液中滴加几滴硫氰化钾(KSCN)溶液解析:A项,氯化铁与铁反应生成FeCl2,溶液的颜色由棕黄色转变为浅绿色;B项,氯化铁与硫氰化钾反应生成Fe(SCN)3,溶液的颜色由棕黄色转变为血红色;C项,四氧化三铁溶于盐酸生成FeCl2和FeCl3,溶液由无色盐酸溶液转变为有色的铁盐溶液;D项,氯化亚铁不与硫氰化钾生成血红色Fe(SCN)3,离子浓度无明显变化,溶液颜色不发生变化。
答案:D易错提醒:1.Fe与酸或不活泼金属阳离子在溶液中发生置换反应或与弱氧化剂(S、I2等)反应生成Fe2+。
2.Fe与强氧化剂Cl2、O2、稀硝酸、过氧化物、KMO4等反应生成Fe3+。Fe在冷、浓H2SO4和HNO3中钝化,在加热条件下溶解生成Fe3+。
3.Fe(OH)2在空气中受热分解得不到FeO,而是得到Fe2O3。
4.只含还原性的Fe2+溶液滴加KSCN溶液不变红色,滴加氯水、双氧水、硝酸等变红色。?课堂练习
1.(2012年广东学业水平考试)加入适量KSCN溶液后,变成血红色的是( )
A.AlCl3溶液 B.FeCl3溶液
C.NaCl溶液 D.Cu(NO3)2溶液解析:加入KSCN溶液后,变成血红色的是Fe3+的现象。
答案:B2.(2012年广东学业水平考试)向FeCl3溶液中加入过量铁粉,充分反应后再滴加KSCN溶液,不显红色的溶液中不存在的离子是( )
A.Fe2+ B.Cl-
C.Fe3+ D.K+解析:FeCl3与过量铁粉反应生成FeCl2,无Fe3+存在。
答案:C铜及其重要化合物?知识回顾
1.铜单质
(1)物理性质:铜单质呈________色,密度大,熔沸点高,有良好的导电性、导热性、延展性。
(2)化学性质:活泼性较差,在室温下铜难与氧或水作用。
①铜在________条件下易与非金属单质反应(如:O2、Cl2、S)生成+1价、+2价的化合物。如:2Cu+S
________;Cu+Cl2 ____________。
②铜与比铜不活泼金属的盐发生置换反应。如:Cu+2Ag+===________________。紫红加热Cu2S CuCl2Cu2++2Ag↓③铜在含有CO2的潮湿空气中,铜被氧化表面逐渐蒙上________的碱式碳酸铜(Cu2(OH)2CO3)铜锈。2Cu+CO2+H2O+O2===Cu2(OH)2CO3。
2.铜的化合物:铜元素在自然界以________存在,常见有孔雀石[Cu2(OH)2CO3]、辉铜矿(Cu2S)等。
(1)CuO:黑色粉末,不溶于水,溶于酸,具有氧化性。CuO在________条件下能被H2、C、CO等还原为铜单质,在高温下分解为暗________色Cu2O和O2。
如:CuO+H2 ________;2CuO+C ________;
CuO+CO ________;CuO+H2SO4===
____________;4CuO===________________。绿色化合态加热红Cu+H2O2Cu+CO2Cu+CO2CuSO4+H2O2Cu2O+O2(2)Cu(OH)2:淡蓝色固体,不溶于水,溶于酸,加热分解生成氧化铜,用________的氢氧化铜可鉴别________(C6H12O6)等物质。氢氧化铜可以作为陶瓷的釉质材料。
(3)CuCl2:铜在氯气中燃烧生成氯化铜。
(4)碱式碳酸铜:绿色、孔雀石的主要成分,加热分解。Cu2(OH)2CO3 ________+H2O+CO2↑。
(5)胆矾(CuSO4·5H2O):蓝色晶体,完全脱水后变为________粉末CuSO4,也是一种饲料添加剂。新制 葡萄糖2CuO白色【例2】 在含有Fe3+和Cu2+的混合液中,加入一定量的铁粉,充分反应后有紫红色固体物质出现,溶液中存在的金属离子可能是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+解析:因为2Fe3++Fe===3Fe2+、2Fe3++Cu===Cu2++2Fe2+、Cu2++Fe===Cu+Fe2+,有紫红色Cu出现时,Fe3+反应完全,Cu2+不一定反应完全。
答案:AC?课堂练习
3.(2012年广东学业水平考试)在碱性、加热条件下能与新制Cu(OH)2反应生成砖红色沉淀的是( )
A.乙醇 B.氯化钠溶液
C.稀硫酸 D.淀粉完全水解的产物解析:淀粉完全水解生成的葡萄糖能与新制Cu(OH)2反应生成Cu2O砖红色沉淀。
答案:D4.制印刷电路时用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu===2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中( )
A.有铁无铜 B.有铜无铁
C.铁、铜都有 D.铁、铜都无解析:若有铁存在,必然发生Fe+CuCl2===FeCl2+Cu反应,即有铁必有铜。
答案:A合金材料?知识回顾
1.合金是指由两种或两种以上的金属(或金属与非金属)熔合而成的具有________特性的物质。通常合金的硬度较________,一般合金的________比主要成分金属的________,化学性质比主要成分金属________。金属大熔点低稳定2.生活中常见合金
①生铁和钢是含碳量不同的两种铁碳合金,生铁含碳量比钢高。钢和生铁性能有很大差异。生铁:在1200 ℃左右熔化,硬度大、抗压、性脆,可以铸造成型,主要用于制造机座、管道。钢:有良好的延展性,可以锻轧和铸造,主要用于制造机械和交通工具等。
②不锈钢的合金元素主要是铬和镍,空气中稳定存在,不易生锈,有很强抗腐蚀能力。
③硬铝:密度小、强度高,有较强抗腐蚀能力,用于制造门窗、航天器等。
④黄铜是铜和锌等形成的合金。【例3】 钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于制造船舶解析:钛熔点高,做保险丝材料需要低熔点金属,钛和钛合金做保险丝不切合实际。钛密度小,可塑性好、易于加工,可用于制造航天飞机、船舶。钛合金与人体有很好的“相容性”,可用来制造人造骨。
答案:A?课堂练习
5.(2012年广东学业水平考试)合金具有优良的机械性能,用途广泛。下列物质属于合金的是( )
A.铜 B.钢
C.金刚石 D.石英解析:钢是碳与铁的合金。
答案:B6.合金是一类用途广泛的金属材料。下列物质属于合金的是( )
A.石墨 B.锌
C.黄铜 D.黄金易错提醒:1.合金是混合物,不是纯净物或化合物,可看作胶体分散系。
2.由于金属晶体结构变化,其硬度、强度、耐腐蚀性比纯金属性能好。解析:铜是紫红色,黄铜主要是以铜为主的铜锌合金。
答案:C一、单选题考点一 铁及其重要化合物1.铁是一种应用广泛的金属。下列有关铁的说法错误的是( )
A.铁与盐酸反应生成氯化铁与氢气
B.常温下,铁在浓硫酸中会发生钝化
C.铁在氧气中燃烧生成四氧化三铁
D.铁是一种银白色金属解析:铁与盐酸反应生成氯化亚铁与氢气。
答案:A2.铁和铁合金是生活中常用的材料,下列说法不正确的是( )
A.不锈钢是铁合金,含有金属和非金属元素
B.一定条件下,铁粉与水蒸气反应生成氧化铁和H2
C.铁和铁合金均能与盐酸反应
D.纯铁在干燥空气中不易被腐蚀解析:氧化铁成分是Fe2O3,铁粉与水蒸气反应生成Fe3O4和H2。
答案:B3.关于铁及其化合物的叙述正确的是( )
A.铁是一种较活泼的金属
B.Fe2O3在常温下可以导电
C.Fe2O3溶于水生成Fe(OH)3
D.在常温下铁丝容易与水反应放出H2解析:A项正确。B、C、D三项错误,Fe2O3不导电也不与水反应。铁在高温条件下与水反应放出H2。
答案:A考点二 铜及其重要化合物9.将铝、铁、铜粉的混合物,投入少量的盐酸中,充分反应后过滤,滤液中一定含有的物质是( )
A.FeCl3 B.CuCl2
C.AlCl3 D.FeCl2解析:在铝、铁、铜三种金属中,铝还原性最强,优先被氧化生成AlCl3。只有当盐酸过剩时,铁与盐酸反应生成FeCl2,也不会生成FeCl3,铜不与盐酸反应。
答案:C10.某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和稀硝酸反应 B.Zn和稀盐酸反应
C.Fe和稀硫酸反应 D.Al和稀盐酸反应解析:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O。
答案:A11.加入下列哪种物质不能除去CuCl2溶液中的少量HCl的是( )
A.CuO B.Cu(OH)2
C.Cu2(OH)2CO3 D.Cu解析:Cu不与HCl反应,不能除去CuCl2溶液中的少量HCl。
答案:D考点三 合金材料14.下列关于合金说法不正确的是( )
A.合金材料是一种胶体分散系
B.合金的熔点比成分金属的熔点高
C.合金一般是由两种或两种以上金属熔合而成
D.青铜、不锈钢、18K金都是合金解析:合金的熔点一般均比成分金属的熔点低。
答案:AB15.下列物质不属于合金的是( )
A.生铁 B.不锈钢
C.黄铜 D.金属铝解析:生铁、不锈钢、黄铜都是合金。铝是金属单质,不属于合金。
答案:D16.下列物质中,属于合金的是( )
A.白银 B.紫铜
C.水银 D.18K解析:白银、紫铜、水银(汞)都是金属单质,不属于合金。18K是含金量75%的合金。
答案:D二、多选题
21.除去铁粉中的少量铝粉,不可以选取的溶液是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.浓氢氧化钠溶液解析:除去铁粉中的少量铝粉,只能选取浓氢氧化钠溶液,铝粉能溶解在浓氢氧化钠溶液,铁粉不能。不能选取浓盐酸、浓硝酸、浓硫酸。
答案:ABC22.为了除去用Fe2O3制备FeCl3溶液时加入的过量的盐酸,可选用下列哪种试剂( )
A.Fe(OH)3 B.CaCO3
C.Fe D.Fe2O3解析:加入过量Fe(OH)3、Fe2O3与盐酸反应后过滤不引入新杂质。选用CaCO3会引入CaCl2杂质。选用Fe会将FeCl3还原为FeCl2。
答案:AD23.古代人用青铜(铜锡合金)代替铜制成宝剑,可能的好处是( )
A.熔点低,便于铸造 B.硬度大,锋利无比
C.密度小,质量轻 D.抗腐蚀能力强解析:选项C不是铜制成宝剑的好处。铜、锡都是重金属元素,密度大,而不是密度小,质量轻。
答案:ABD感谢您的使用,退出请按ESC键本小节结束
1.铁单质
(1)物理性质:纯铁________色,密度大,熔沸点高,有较好的________性、________性、导热性,能被________吸引。铁属黑色金属。
(2)化学性质:
①常见化合价0价、+2价、+3价,Fe3+比Fe2+________。银白延展导电磁铁稳定②在常温干燥的空气中,纯铁________被腐蚀,潮湿空气中,铁________与O2和H2O共同反应生成________色疏松的铁锈(主要成分Fe2O3)。
③铁在冷浓硫酸、硝酸中发生________反应,表面生成致密的氧化物保护膜。
④Fe在与弱氧化剂反应被氧化为+2。如:
Fe+2HCl===____________;Fe+Cu2+===________;Fe+S ________;Fe+2Fe3+=________。
不易易棕褐钝化FeCl2+H2↑ Cu+Fe2+FeS3Fe2+⑤Fe与强氧化剂反应被氧化为+3。如:
2Fe+3Cl2 ________;Fe+4HNO3(稀)===Fe(NO3)3+2H2O+________。
2.铁的化合物
(1)铁的氧化物:FeO黑色、易氧化;Fe3O4黑色、有磁性、俗称磁铁;Fe2O3俗称________,可作颜料;都能与酸反应而溶解,均是炼铁原料。
(2)氢氧化物:
①Fe(OH)2在空气中易被氧化生成________的Fe(OH)3。
②Fe(OH)3不溶于水,受热分解生成红色______。2FeCl3NO↑铁红红褐色Fe2O3 (3)二价铁盐与三价铁盐:Fe2+(浅绿色)与Fe3+(棕黄色)之间的转化:
Ⅰ.Fe2+转变为Fe3+需加入氧化剂:Cl2、O2、HNO3、Na2O2、H2O2、酸性KMnO4等。如:
Cl2+2Fe2+===____________;4Fe2++O2+4H+===____________。
Ⅱ.Fe3+转变为Fe2+需加入还原剂Fe、Cu、SO2等。如:2Fe3++Cu===______________。
(4)Fe3+检验:Fe3+与KSCN反应Fe3++3SCN-===Fe(SCN)3,溶液为血红色。2Fe3++2Cl-4Fe3++2H2O2Fe2++Cu2+3.铁的冶炼
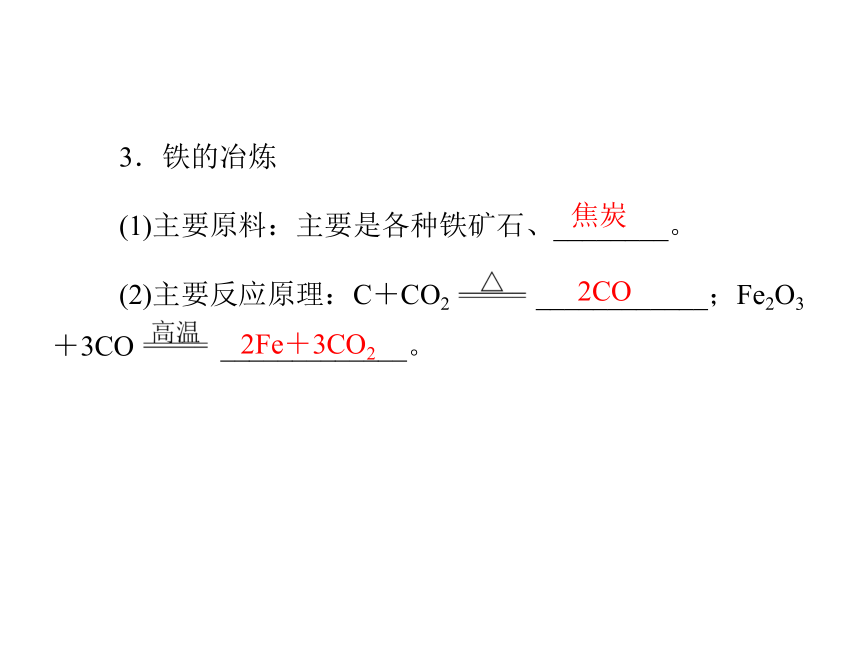
(1)主要原料:主要是各种铁矿石、________。
(2)主要反应原理:C+CO2 ____________;Fe2O3+3CO _____________。焦炭2CO2Fe+3CO2【例1】 下列操作中,溶液的颜色不发生变化的是( )
A.氯化铁溶液中加入足量铁粉,充分振荡
B.氯化铁溶液中滴加几滴硫氰化钾(KSCN)溶液
C.四氧化三铁固体加入稀盐酸中,完全溶解
D.氯化亚铁溶液中滴加几滴硫氰化钾(KSCN)溶液解析:A项,氯化铁与铁反应生成FeCl2,溶液的颜色由棕黄色转变为浅绿色;B项,氯化铁与硫氰化钾反应生成Fe(SCN)3,溶液的颜色由棕黄色转变为血红色;C项,四氧化三铁溶于盐酸生成FeCl2和FeCl3,溶液由无色盐酸溶液转变为有色的铁盐溶液;D项,氯化亚铁不与硫氰化钾生成血红色Fe(SCN)3,离子浓度无明显变化,溶液颜色不发生变化。
答案:D易错提醒:1.Fe与酸或不活泼金属阳离子在溶液中发生置换反应或与弱氧化剂(S、I2等)反应生成Fe2+。
2.Fe与强氧化剂Cl2、O2、稀硝酸、过氧化物、KMO4等反应生成Fe3+。Fe在冷、浓H2SO4和HNO3中钝化,在加热条件下溶解生成Fe3+。
3.Fe(OH)2在空气中受热分解得不到FeO,而是得到Fe2O3。
4.只含还原性的Fe2+溶液滴加KSCN溶液不变红色,滴加氯水、双氧水、硝酸等变红色。?课堂练习
1.(2012年广东学业水平考试)加入适量KSCN溶液后,变成血红色的是( )
A.AlCl3溶液 B.FeCl3溶液
C.NaCl溶液 D.Cu(NO3)2溶液解析:加入KSCN溶液后,变成血红色的是Fe3+的现象。
答案:B2.(2012年广东学业水平考试)向FeCl3溶液中加入过量铁粉,充分反应后再滴加KSCN溶液,不显红色的溶液中不存在的离子是( )
A.Fe2+ B.Cl-
C.Fe3+ D.K+解析:FeCl3与过量铁粉反应生成FeCl2,无Fe3+存在。
答案:C铜及其重要化合物?知识回顾
1.铜单质
(1)物理性质:铜单质呈________色,密度大,熔沸点高,有良好的导电性、导热性、延展性。
(2)化学性质:活泼性较差,在室温下铜难与氧或水作用。
①铜在________条件下易与非金属单质反应(如:O2、Cl2、S)生成+1价、+2价的化合物。如:2Cu+S
________;Cu+Cl2 ____________。
②铜与比铜不活泼金属的盐发生置换反应。如:Cu+2Ag+===________________。紫红加热Cu2S CuCl2Cu2++2Ag↓③铜在含有CO2的潮湿空气中,铜被氧化表面逐渐蒙上________的碱式碳酸铜(Cu2(OH)2CO3)铜锈。2Cu+CO2+H2O+O2===Cu2(OH)2CO3。
2.铜的化合物:铜元素在自然界以________存在,常见有孔雀石[Cu2(OH)2CO3]、辉铜矿(Cu2S)等。
(1)CuO:黑色粉末,不溶于水,溶于酸,具有氧化性。CuO在________条件下能被H2、C、CO等还原为铜单质,在高温下分解为暗________色Cu2O和O2。
如:CuO+H2 ________;2CuO+C ________;
CuO+CO ________;CuO+H2SO4===
____________;4CuO===________________。绿色化合态加热红Cu+H2O2Cu+CO2Cu+CO2CuSO4+H2O2Cu2O+O2(2)Cu(OH)2:淡蓝色固体,不溶于水,溶于酸,加热分解生成氧化铜,用________的氢氧化铜可鉴别________(C6H12O6)等物质。氢氧化铜可以作为陶瓷的釉质材料。
(3)CuCl2:铜在氯气中燃烧生成氯化铜。
(4)碱式碳酸铜:绿色、孔雀石的主要成分,加热分解。Cu2(OH)2CO3 ________+H2O+CO2↑。
(5)胆矾(CuSO4·5H2O):蓝色晶体,完全脱水后变为________粉末CuSO4,也是一种饲料添加剂。新制 葡萄糖2CuO白色【例2】 在含有Fe3+和Cu2+的混合液中,加入一定量的铁粉,充分反应后有紫红色固体物质出现,溶液中存在的金属离子可能是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+解析:因为2Fe3++Fe===3Fe2+、2Fe3++Cu===Cu2++2Fe2+、Cu2++Fe===Cu+Fe2+,有紫红色Cu出现时,Fe3+反应完全,Cu2+不一定反应完全。
答案:AC?课堂练习
3.(2012年广东学业水平考试)在碱性、加热条件下能与新制Cu(OH)2反应生成砖红色沉淀的是( )
A.乙醇 B.氯化钠溶液
C.稀硫酸 D.淀粉完全水解的产物解析:淀粉完全水解生成的葡萄糖能与新制Cu(OH)2反应生成Cu2O砖红色沉淀。
答案:D4.制印刷电路时用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu===2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中( )
A.有铁无铜 B.有铜无铁
C.铁、铜都有 D.铁、铜都无解析:若有铁存在,必然发生Fe+CuCl2===FeCl2+Cu反应,即有铁必有铜。
答案:A合金材料?知识回顾
1.合金是指由两种或两种以上的金属(或金属与非金属)熔合而成的具有________特性的物质。通常合金的硬度较________,一般合金的________比主要成分金属的________,化学性质比主要成分金属________。金属大熔点低稳定2.生活中常见合金
①生铁和钢是含碳量不同的两种铁碳合金,生铁含碳量比钢高。钢和生铁性能有很大差异。生铁:在1200 ℃左右熔化,硬度大、抗压、性脆,可以铸造成型,主要用于制造机座、管道。钢:有良好的延展性,可以锻轧和铸造,主要用于制造机械和交通工具等。
②不锈钢的合金元素主要是铬和镍,空气中稳定存在,不易生锈,有很强抗腐蚀能力。
③硬铝:密度小、强度高,有较强抗腐蚀能力,用于制造门窗、航天器等。
④黄铜是铜和锌等形成的合金。【例3】 钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于制造船舶解析:钛熔点高,做保险丝材料需要低熔点金属,钛和钛合金做保险丝不切合实际。钛密度小,可塑性好、易于加工,可用于制造航天飞机、船舶。钛合金与人体有很好的“相容性”,可用来制造人造骨。
答案:A?课堂练习
5.(2012年广东学业水平考试)合金具有优良的机械性能,用途广泛。下列物质属于合金的是( )
A.铜 B.钢
C.金刚石 D.石英解析:钢是碳与铁的合金。
答案:B6.合金是一类用途广泛的金属材料。下列物质属于合金的是( )
A.石墨 B.锌
C.黄铜 D.黄金易错提醒:1.合金是混合物,不是纯净物或化合物,可看作胶体分散系。
2.由于金属晶体结构变化,其硬度、强度、耐腐蚀性比纯金属性能好。解析:铜是紫红色,黄铜主要是以铜为主的铜锌合金。
答案:C一、单选题考点一 铁及其重要化合物1.铁是一种应用广泛的金属。下列有关铁的说法错误的是( )
A.铁与盐酸反应生成氯化铁与氢气
B.常温下,铁在浓硫酸中会发生钝化
C.铁在氧气中燃烧生成四氧化三铁
D.铁是一种银白色金属解析:铁与盐酸反应生成氯化亚铁与氢气。
答案:A2.铁和铁合金是生活中常用的材料,下列说法不正确的是( )
A.不锈钢是铁合金,含有金属和非金属元素
B.一定条件下,铁粉与水蒸气反应生成氧化铁和H2
C.铁和铁合金均能与盐酸反应
D.纯铁在干燥空气中不易被腐蚀解析:氧化铁成分是Fe2O3,铁粉与水蒸气反应生成Fe3O4和H2。
答案:B3.关于铁及其化合物的叙述正确的是( )
A.铁是一种较活泼的金属
B.Fe2O3在常温下可以导电
C.Fe2O3溶于水生成Fe(OH)3
D.在常温下铁丝容易与水反应放出H2解析:A项正确。B、C、D三项错误,Fe2O3不导电也不与水反应。铁在高温条件下与水反应放出H2。
答案:A考点二 铜及其重要化合物9.将铝、铁、铜粉的混合物,投入少量的盐酸中,充分反应后过滤,滤液中一定含有的物质是( )
A.FeCl3 B.CuCl2
C.AlCl3 D.FeCl2解析:在铝、铁、铜三种金属中,铝还原性最强,优先被氧化生成AlCl3。只有当盐酸过剩时,铁与盐酸反应生成FeCl2,也不会生成FeCl3,铜不与盐酸反应。
答案:C10.某化学活动小组欲制备一定量的氢气,下列方法不能达到目的的是( )
A.Cu和稀硝酸反应 B.Zn和稀盐酸反应
C.Fe和稀硫酸反应 D.Al和稀盐酸反应解析:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O。
答案:A11.加入下列哪种物质不能除去CuCl2溶液中的少量HCl的是( )
A.CuO B.Cu(OH)2
C.Cu2(OH)2CO3 D.Cu解析:Cu不与HCl反应,不能除去CuCl2溶液中的少量HCl。
答案:D考点三 合金材料14.下列关于合金说法不正确的是( )
A.合金材料是一种胶体分散系
B.合金的熔点比成分金属的熔点高
C.合金一般是由两种或两种以上金属熔合而成
D.青铜、不锈钢、18K金都是合金解析:合金的熔点一般均比成分金属的熔点低。
答案:AB15.下列物质不属于合金的是( )
A.生铁 B.不锈钢
C.黄铜 D.金属铝解析:生铁、不锈钢、黄铜都是合金。铝是金属单质,不属于合金。
答案:D16.下列物质中,属于合金的是( )
A.白银 B.紫铜
C.水银 D.18K解析:白银、紫铜、水银(汞)都是金属单质,不属于合金。18K是含金量75%的合金。
答案:D二、多选题
21.除去铁粉中的少量铝粉,不可以选取的溶液是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.浓氢氧化钠溶液解析:除去铁粉中的少量铝粉,只能选取浓氢氧化钠溶液,铝粉能溶解在浓氢氧化钠溶液,铁粉不能。不能选取浓盐酸、浓硝酸、浓硫酸。
答案:ABC22.为了除去用Fe2O3制备FeCl3溶液时加入的过量的盐酸,可选用下列哪种试剂( )
A.Fe(OH)3 B.CaCO3
C.Fe D.Fe2O3解析:加入过量Fe(OH)3、Fe2O3与盐酸反应后过滤不引入新杂质。选用CaCO3会引入CaCl2杂质。选用Fe会将FeCl3还原为FeCl2。
答案:AD23.古代人用青铜(铜锡合金)代替铜制成宝剑,可能的好处是( )
A.熔点低,便于铸造 B.硬度大,锋利无比
C.密度小,质量轻 D.抗腐蚀能力强解析:选项C不是铜制成宝剑的好处。铜、锡都是重金属元素,密度大,而不是密度小,质量轻。
答案:ABD感谢您的使用,退出请按ESC键本小节结束
同课章节目录
