【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第十三讲 化学反应与能量、原电池 (46张ppt)
文档属性
| 名称 | 【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第十三讲 化学反应与能量、原电池 (46张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 797.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-15 00:00:00 | ||
图片预览










文档简介
课件46张PPT。第十三讲 化学反应与能量、原电池 ?知识回顾
1.化学反应能量变化
(1)化学键与能量转化:发生化学反应时,断开反应物中的化学键要________能量,形成生成物中的化学键要________能量,不同的化学键断裂吸收的能量与形成化学键释放的能量不相等,从而发生化学能与其他能量形式的转化。化学反应与能量吸收 放出(2)常见的能量转化形式。
①通常情况下,化学反应中的能量变化表现为________的变化,即为________热和________热。
②在一定条件下,化学反应中的能量变化还可以电能、光能等形式变化。
③在原电池反应中,化学能主要转化为________能;在电解过程中电能主要转化为化学能。热量 吸 放 电 2.放热反应与吸热反应
(1)放热反应:反应物的总能量________生成物的总能量的反应,或者说:旧化学键断裂时所需要吸收的能量________新化学键形成时所释放的能量的反应。反应对环境放热,一般表现温度________,化学能________。
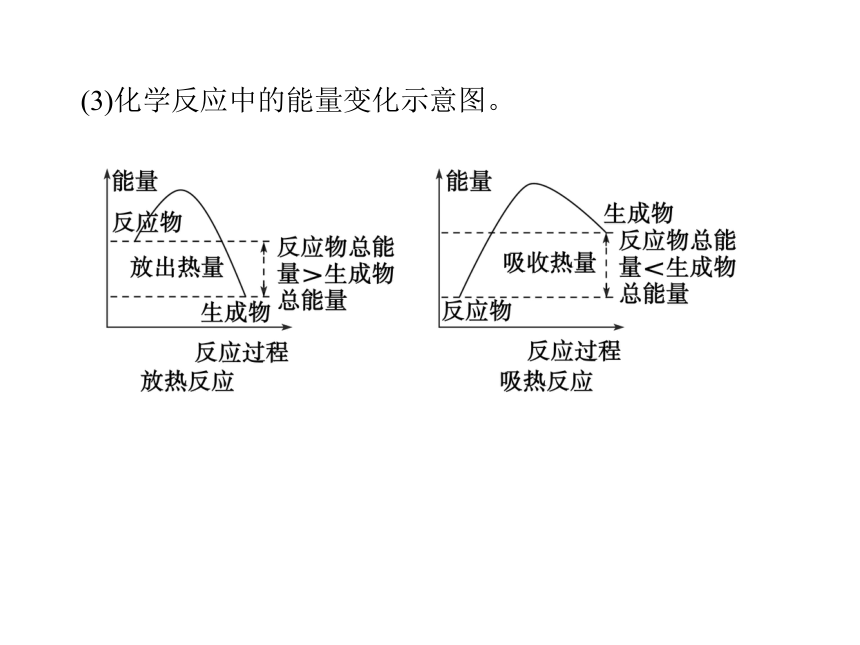
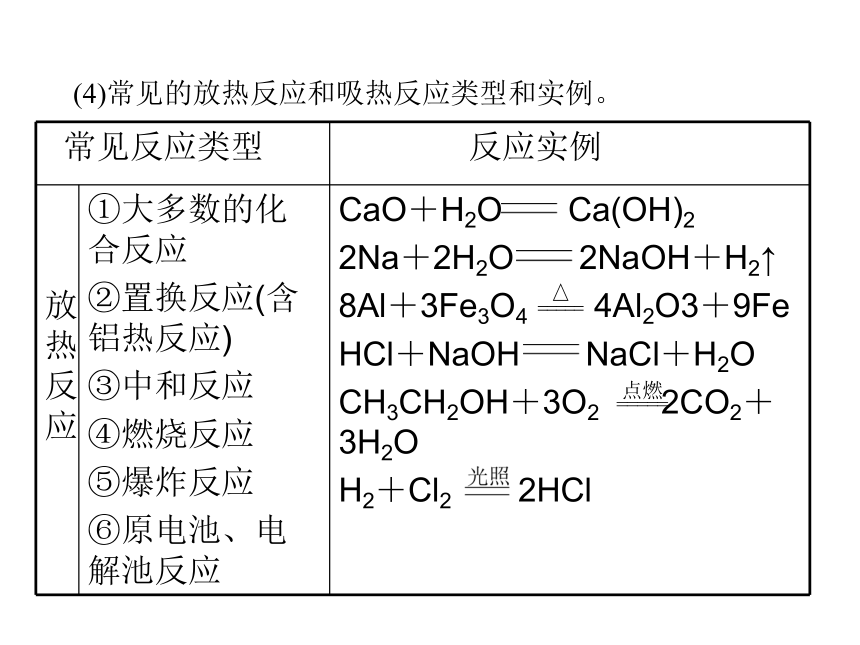
(2)吸热反应:反应物的总能量________生成物的总能量的反应,或者说:旧化学键断裂时所需要吸收的能量大于新化学键形成时所释放的能量的反应。反应从环境吸热,一般表现温度________,化学能________。> < 升高 减少 低于 降低 增加(3)化学反应中的能量变化示意图。(4)常见的放热反应和吸热反应类型和实例。①大多数的分解反应
②电离反应
③铵盐与碱反应
④结晶水合物失水反应
⑤大多数以H2、CO、C为还原剂需持续加热的氧化还原反应(燃烧反应除外)(5)注意问题。
①需要加热的反应不一定是吸热反应,不加热的反应不一定是放热反应。大多数反应发生时,开始都需要引发条件。判断反应热效应,应比较反应前后物质具有的总能量差异,不应只看反应初始条件。②燃料的燃烧、食物的腐败等放热反应的发生,有时也需加热,很多燃料需点燃方能燃烧。一旦发生反应,放出的热量足以维持反应必需的温度条件,不再需外界持续提供能量。【例1】 (2012年广东学业水平考试)化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是( )
A.该反应为吸热反应
B.该反应为放热反应
C.断裂H-H键吸收能量
D.生成H-O键吸收能量
解析:可燃物燃烧是化学能转化成热能,为放热反应,断裂化学键吸收能量,生成化学键释放能量。
答案:BC?课堂练习
1.(2012年广东学业水平考试)不同种类的能量可相互转化。下列说法不正确的是( )
A.硅材料可将太阳能转化为电能
B.水力发电可将势能转化为电能
C.原电池可将化学能转化为电能
D.燃烧反应可将热能转化为化学能解析:燃烧反应是可将化学能转化为热能。
答案:D2.(2011年广东学业水平考试)H2在O2中燃烧生成气态H2O的反应是一个放热反应,在反应过程中( )
A.核能转化成热能
B.化学能转化成热能
C.生成物的总能量等于反应物的总能量
D.生成物的总能量大于反应物的总能量解析:燃烧反应是化学能转化成热能,生成物的总能量小于反应物的总能量。
答案:B?知识回顾
1.定义:利用氧化还原反应将________能转化为________能的装置。
2.Zn─Cu原电池工作原理
(1)装置如图:原电池化学电(2)形成条件:①有两种活动性不同的金属(或一种是非金属导体或不活泼金属)作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)工作原理:铜片和锌片用导线连接,同时浸入稀硫酸,金属锌比铜活泼,锌原子容易________电子,锌片的电子通过________流向铜片,Zn被氧化生成________进入溶液,溶液中的H+从铜片获得电子被还原,生成________从铜片上逸出。失去 导线 Zn2+ H2 (4)电池反应。
①负极(活泼金属锌片):Zn-2e-===Zn2+(氧化反应)
②正极(不活泼金属或非金属导体铜片):2H++2e-===H2↑(还原反应)
③电池总反应式:Zn+H2SO4 ZnSO4+H2↑(氧化还原反应)
(5)电子与电流流动方向
电子:________极(锌片)→导线→________极(铜片)
电流:________极(铜片)→导线→________极(锌片)负 正 正 负3.常见化学电源种类
(1)不可充电电池(一次电池):如①普通干电池Zn(负极)-MnO2(C棒正极)-NH4Cl(电解质);②碱性干电池如:Zn(负极)-MnO2(C棒正极)-KOH(电解质);③微型纽扣电池如:Zn(负极)-Ag2O(碳粉正极)-KOH(电解质)。
(2)可充电电池(又称二次电池):如铅蓄电池Pb(负极)-PbO2(Pb正极)-H2SO4、锂离子电池等。(3)新型燃料电池:燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。如氢能燃料电池、甲烷燃料电池等。燃料电池中的氢氧电池由于具有能量转化率高、能长时间供电等优点,而应用于航天和军事领域。【例2】 (2012年广东学业水平考试)在铜锌原电池中,锌电极上发生的反应为Zn-2e-===Zn2+,则( )
A.锌电极为负极
B.锌电极为正极
C.反应中Zn被氧化
D.反应中Zn被还原
解析:Zn极电子流出为负极,发生氧化反应,反应中Zn被氧化。Cu极电子流入为正极,发生还原反应。
答案:AC?课堂练习
3.(2012年广东学业水平考试)下列各装置中,不能构成原电池的是(电解质都为稀硫酸)( )解析:D中的装置没有形成闭合电路,不能构成原电池。
答案:D4.(2011年广东学业水平考试)如图装置所示,
铜片上发生的反应为( )
A.Zn2++2e-===Zn
B.2H++2e-===H2↑
C.Zn-2e-===Zn2+
D.Cu2++2e-===Cu解析:铜片上发生的反应为2H++2e-===H2↑,锌片上发生的反应为Zn-2e-===Zn2+。
答案:B金属腐蚀与防护?知识回顾
1.金属腐蚀化学原理:金属的腐蚀是指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
其实质:金属原子失去电子被氧化:M-ne-===Mn+,越活泼的金属,越容易受到腐蚀,由于与金属接触的介质不同,发生腐蚀的化学原理也不同。2.金属的腐蚀分类:一般分为吸______腐蚀和析______腐蚀,其中的________腐蚀更普遍。
(1)化学腐蚀:指金属跟接触到的物质直接发生________反应而引起的腐蚀。如高温下,钢铁与氯气接触生成氯化铁、铜在加热条件下生成黑色的氧化铜,都属于化学腐蚀。化学 电化学 电化学 化学 (2)电化学腐蚀:指不纯的金属(或合金)跟电解质溶液接触时,发生________反应而引起的腐蚀。一般可分为吸________腐蚀和析________腐蚀,其中,吸氧腐蚀更普遍。例如钢铁的腐蚀以吸氧腐蚀为主,其中负极为铁。电极反应为:
负极:Fe-2e-===Fe2+;正极(碳):2H2O+O2+4e-===4OH-。原电池 氧 氢(3)常见防护措施:
①改变金属组织结构:选用不同的金属或非金属制成合金,如不锈钢。
②增加保护层:如喷油漆、涂油脂、电镀或用化学方法使其表面形成一层致密的氧化膜使其表面钝化等。
③采用电化学保护,如牺牲阳极的阴极保护法(原电池原理),外加电流的阴极保护法(电解池原理),防止金属腐蚀等。【例3】 下列有关金属材料的腐蚀与防护措施不能用原电池原理解释的是( )
A.海轮的水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保护
C.纯锌片与稀硫酸反应时,滴入少量氯化铜溶液后速率加快
D.镀锌铁比镀锡铁耐用解析:选项A,在海轮的水线以下船壳上加Zn块构成原电池的负极,从而保护正极铁不受腐蚀;选项B,铝片表面在空气中易形成致密不易再反应的氧化铝保护膜;选项C,由于发生Zn+Cu2+===Cu+Zn2+,生成的铜附着在锌表面构成原电池,加快纯锌与稀硫酸的反应速率;选项D,铁片表面的镀锌层和镀锡层受损后,分别形成Zn—Fe和Fe—Sn原电池,前者锌比铁活泼被氧化,能起到保护铁的作用,后者锡比铁不活泼,铁更易被氧化,所以镀锌铁比镀锡铁耐用。
答案:B?课堂练习
5.(2012年广东学业水平考试)在潮湿的空气中,最容易被腐蚀的是( )
A.金币 B.银元
C.铁锅 D.铜牌解析:铁锅是铁碳合金材料,在潮湿的空气中易发生电化学腐蚀。
答案:C6.(2011年广东学业水平考试)下列措施不能有效防止钢铁腐蚀的是( )
A.在钢铁中加入铬
B.把钢铁零件放在机油中保存
C.在较小钢铁制品的表面包裹塑料
D.在大型铁壳船表面喷涂油漆并铆上铜块解析:在大型铁壳船表面铆上铜块,加快钢铁腐蚀。
答案:D1.(2012年广东学业水平考试)对于反应H2(g)+Cl2(g)===2HCl(g)的能量变化描述正确的是( )
A.成键过程中吸收能量
B.断键过程中吸收能量,成键过程中释放能量
C.断键过程中释放能量
D.断键过程中释放能量,成键过程中吸收能量一、单选题考点一 化学反应与能量解析:化学反应过程是旧键断裂与新键形成的过程,断裂旧键需要吸收能量,形成新键释放能量。
答案:B2.天然气燃烧过程中的能量转化方式为( )
A.化学能转化为热能
B.化学能转化为电能
C.热能转化为化学能
D.化学能转化为机械能解析:天然气燃烧过程是化学反应过程,能量转化方式为化学能转化为热能。
答案:A3.化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,错误的是( )
A.该反应为吸热反应
B.该反应为放热反应
C.断裂H-H键吸收能量
D.生成H-O键放出能量解析:H2在O2中燃烧是放热反应,不是吸热反应。
答案:A考点二 原电池8.根据下列反应不能设计为原电池的是( )
A.Fe+2FeCl3 3FeCl2
B.CH4+2O2 CO2+2H2O
C.H2+Cl2 2HCl
D.H2SO4+2NaOH Na2SO4+2H2O解析:设计为原电池的反应,必须是氧化还原反应,D项是复分解反应,不能设计为原电池。
答案:D9.右图为某原电池示意图,下列说法正确的是( )
A.铜电极是负极
B.锌电极是正极
C.铜电极上发生氧化反应
D.锌电极上发生氧化反应解析:锌的金属性比铜强,该原电池中锌电极作负极,发生氧化反应:Zn-2e-===Zn2+。
答案:D10.在铜锌原电池中,稀硫酸作电解质溶液,锌电极上发生的反应为Zn-2e-===Zn2+,下列说法错误的是( )
A.锌电极为负极
B.铜电极为正极
C.反应中Zn被氧化
D.反应中铜被还原解析:反应中铜作电极材料,没有发生反应,溶液中的H+被还原生成H2。
答案:D考点三 金属腐蚀与防护15.实验室准备较快地制取氢气,可采用的方法是( )
A.用纯锌与稀硫酸反应
B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应
D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应解析:粗锌中一般含有比锌不活泼金属易发生原电池反应;用粗锌与稀硝酸反应生成NO;在CuSO4溶液中浸泡过的纯锌表面覆盖了一层铜单质。
答案:B16.关于金属腐蚀和防护的说法不正确的是( )
A.金属腐蚀过程中发生了化学反应
B.在铁表面镀锌可对铁起保护作用
C.在铁船壳上镶嵌铜块能减缓船体的腐蚀
D.铝制品在空气中不易被腐蚀,是因其表面形成了致密的氧化铝保护层解析:在铁船壳上镶嵌铜块将加快船体的腐蚀。
答案:C17.以下现象与电化腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜器不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质水管与铜质水龙头连接,在接触处易生铁锈
D.银制奖牌久置后表面变暗解析:银制奖牌久置后表面变暗是发生化学腐蚀。
答案:C21.(2012年广东学业水平考试)“瓦斯”爆炸会严重威胁煤矿安全,下列说法正确的是( )
A.“瓦斯”的主要成分为乙烯
B.爆炸过程放出大量热量
C.爆炸过程有氧气参与反应
D.爆炸过程吸收大量热量解析:“瓦斯”主要成分是甲烷,甲烷在空气中燃烧爆炸是放热反应。
答案:BC22.下列图中,表示正反应为吸热反应的是( )解析:从A、C图像中可以看出反应前反应物的总能量小于反应后生成物的总能量。
答案:AC23.下列物质加入水中其溶液温度有明显升高的是( )
A.浓硫酸 B.固体氢氧化钠
C.生石灰 D.硝酸铵晶体解析:浓硫酸、固体氢氧化钠溶于水和生石灰与水反应放出大量热,溶液温度有明显升高;硝酸铵晶体溶于水吸收大量热,溶液温度有明显降低。
答案:ABC感谢您的使用,退出请按ESC键本小节结束
1.化学反应能量变化
(1)化学键与能量转化:发生化学反应时,断开反应物中的化学键要________能量,形成生成物中的化学键要________能量,不同的化学键断裂吸收的能量与形成化学键释放的能量不相等,从而发生化学能与其他能量形式的转化。化学反应与能量吸收 放出(2)常见的能量转化形式。
①通常情况下,化学反应中的能量变化表现为________的变化,即为________热和________热。
②在一定条件下,化学反应中的能量变化还可以电能、光能等形式变化。
③在原电池反应中,化学能主要转化为________能;在电解过程中电能主要转化为化学能。热量 吸 放 电 2.放热反应与吸热反应
(1)放热反应:反应物的总能量________生成物的总能量的反应,或者说:旧化学键断裂时所需要吸收的能量________新化学键形成时所释放的能量的反应。反应对环境放热,一般表现温度________,化学能________。
(2)吸热反应:反应物的总能量________生成物的总能量的反应,或者说:旧化学键断裂时所需要吸收的能量大于新化学键形成时所释放的能量的反应。反应从环境吸热,一般表现温度________,化学能________。> < 升高 减少 低于 降低 增加(3)化学反应中的能量变化示意图。(4)常见的放热反应和吸热反应类型和实例。①大多数的分解反应
②电离反应
③铵盐与碱反应
④结晶水合物失水反应
⑤大多数以H2、CO、C为还原剂需持续加热的氧化还原反应(燃烧反应除外)(5)注意问题。
①需要加热的反应不一定是吸热反应,不加热的反应不一定是放热反应。大多数反应发生时,开始都需要引发条件。判断反应热效应,应比较反应前后物质具有的总能量差异,不应只看反应初始条件。②燃料的燃烧、食物的腐败等放热反应的发生,有时也需加热,很多燃料需点燃方能燃烧。一旦发生反应,放出的热量足以维持反应必需的温度条件,不再需外界持续提供能量。【例1】 (2012年广东学业水平考试)化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是( )
A.该反应为吸热反应
B.该反应为放热反应
C.断裂H-H键吸收能量
D.生成H-O键吸收能量
解析:可燃物燃烧是化学能转化成热能,为放热反应,断裂化学键吸收能量,生成化学键释放能量。
答案:BC?课堂练习
1.(2012年广东学业水平考试)不同种类的能量可相互转化。下列说法不正确的是( )
A.硅材料可将太阳能转化为电能
B.水力发电可将势能转化为电能
C.原电池可将化学能转化为电能
D.燃烧反应可将热能转化为化学能解析:燃烧反应是可将化学能转化为热能。
答案:D2.(2011年广东学业水平考试)H2在O2中燃烧生成气态H2O的反应是一个放热反应,在反应过程中( )
A.核能转化成热能
B.化学能转化成热能
C.生成物的总能量等于反应物的总能量
D.生成物的总能量大于反应物的总能量解析:燃烧反应是化学能转化成热能,生成物的总能量小于反应物的总能量。
答案:B?知识回顾
1.定义:利用氧化还原反应将________能转化为________能的装置。
2.Zn─Cu原电池工作原理
(1)装置如图:原电池化学电(2)形成条件:①有两种活动性不同的金属(或一种是非金属导体或不活泼金属)作电极。
②电极材料均插入电解质溶液中。
③两极相连形成闭合电路。
(3)工作原理:铜片和锌片用导线连接,同时浸入稀硫酸,金属锌比铜活泼,锌原子容易________电子,锌片的电子通过________流向铜片,Zn被氧化生成________进入溶液,溶液中的H+从铜片获得电子被还原,生成________从铜片上逸出。失去 导线 Zn2+ H2 (4)电池反应。
①负极(活泼金属锌片):Zn-2e-===Zn2+(氧化反应)
②正极(不活泼金属或非金属导体铜片):2H++2e-===H2↑(还原反应)
③电池总反应式:Zn+H2SO4 ZnSO4+H2↑(氧化还原反应)
(5)电子与电流流动方向
电子:________极(锌片)→导线→________极(铜片)
电流:________极(铜片)→导线→________极(锌片)负 正 正 负3.常见化学电源种类
(1)不可充电电池(一次电池):如①普通干电池Zn(负极)-MnO2(C棒正极)-NH4Cl(电解质);②碱性干电池如:Zn(负极)-MnO2(C棒正极)-KOH(电解质);③微型纽扣电池如:Zn(负极)-Ag2O(碳粉正极)-KOH(电解质)。
(2)可充电电池(又称二次电池):如铅蓄电池Pb(负极)-PbO2(Pb正极)-H2SO4、锂离子电池等。(3)新型燃料电池:燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。如氢能燃料电池、甲烷燃料电池等。燃料电池中的氢氧电池由于具有能量转化率高、能长时间供电等优点,而应用于航天和军事领域。【例2】 (2012年广东学业水平考试)在铜锌原电池中,锌电极上发生的反应为Zn-2e-===Zn2+,则( )
A.锌电极为负极
B.锌电极为正极
C.反应中Zn被氧化
D.反应中Zn被还原
解析:Zn极电子流出为负极,发生氧化反应,反应中Zn被氧化。Cu极电子流入为正极,发生还原反应。
答案:AC?课堂练习
3.(2012年广东学业水平考试)下列各装置中,不能构成原电池的是(电解质都为稀硫酸)( )解析:D中的装置没有形成闭合电路,不能构成原电池。
答案:D4.(2011年广东学业水平考试)如图装置所示,
铜片上发生的反应为( )
A.Zn2++2e-===Zn
B.2H++2e-===H2↑
C.Zn-2e-===Zn2+
D.Cu2++2e-===Cu解析:铜片上发生的反应为2H++2e-===H2↑,锌片上发生的反应为Zn-2e-===Zn2+。
答案:B金属腐蚀与防护?知识回顾
1.金属腐蚀化学原理:金属的腐蚀是指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
其实质:金属原子失去电子被氧化:M-ne-===Mn+,越活泼的金属,越容易受到腐蚀,由于与金属接触的介质不同,发生腐蚀的化学原理也不同。2.金属的腐蚀分类:一般分为吸______腐蚀和析______腐蚀,其中的________腐蚀更普遍。
(1)化学腐蚀:指金属跟接触到的物质直接发生________反应而引起的腐蚀。如高温下,钢铁与氯气接触生成氯化铁、铜在加热条件下生成黑色的氧化铜,都属于化学腐蚀。化学 电化学 电化学 化学 (2)电化学腐蚀:指不纯的金属(或合金)跟电解质溶液接触时,发生________反应而引起的腐蚀。一般可分为吸________腐蚀和析________腐蚀,其中,吸氧腐蚀更普遍。例如钢铁的腐蚀以吸氧腐蚀为主,其中负极为铁。电极反应为:
负极:Fe-2e-===Fe2+;正极(碳):2H2O+O2+4e-===4OH-。原电池 氧 氢(3)常见防护措施:
①改变金属组织结构:选用不同的金属或非金属制成合金,如不锈钢。
②增加保护层:如喷油漆、涂油脂、电镀或用化学方法使其表面形成一层致密的氧化膜使其表面钝化等。
③采用电化学保护,如牺牲阳极的阴极保护法(原电池原理),外加电流的阴极保护法(电解池原理),防止金属腐蚀等。【例3】 下列有关金属材料的腐蚀与防护措施不能用原电池原理解释的是( )
A.海轮的水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保护
C.纯锌片与稀硫酸反应时,滴入少量氯化铜溶液后速率加快
D.镀锌铁比镀锡铁耐用解析:选项A,在海轮的水线以下船壳上加Zn块构成原电池的负极,从而保护正极铁不受腐蚀;选项B,铝片表面在空气中易形成致密不易再反应的氧化铝保护膜;选项C,由于发生Zn+Cu2+===Cu+Zn2+,生成的铜附着在锌表面构成原电池,加快纯锌与稀硫酸的反应速率;选项D,铁片表面的镀锌层和镀锡层受损后,分别形成Zn—Fe和Fe—Sn原电池,前者锌比铁活泼被氧化,能起到保护铁的作用,后者锡比铁不活泼,铁更易被氧化,所以镀锌铁比镀锡铁耐用。
答案:B?课堂练习
5.(2012年广东学业水平考试)在潮湿的空气中,最容易被腐蚀的是( )
A.金币 B.银元
C.铁锅 D.铜牌解析:铁锅是铁碳合金材料,在潮湿的空气中易发生电化学腐蚀。
答案:C6.(2011年广东学业水平考试)下列措施不能有效防止钢铁腐蚀的是( )
A.在钢铁中加入铬
B.把钢铁零件放在机油中保存
C.在较小钢铁制品的表面包裹塑料
D.在大型铁壳船表面喷涂油漆并铆上铜块解析:在大型铁壳船表面铆上铜块,加快钢铁腐蚀。
答案:D1.(2012年广东学业水平考试)对于反应H2(g)+Cl2(g)===2HCl(g)的能量变化描述正确的是( )
A.成键过程中吸收能量
B.断键过程中吸收能量,成键过程中释放能量
C.断键过程中释放能量
D.断键过程中释放能量,成键过程中吸收能量一、单选题考点一 化学反应与能量解析:化学反应过程是旧键断裂与新键形成的过程,断裂旧键需要吸收能量,形成新键释放能量。
答案:B2.天然气燃烧过程中的能量转化方式为( )
A.化学能转化为热能
B.化学能转化为电能
C.热能转化为化学能
D.化学能转化为机械能解析:天然气燃烧过程是化学反应过程,能量转化方式为化学能转化为热能。
答案:A3.化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,错误的是( )
A.该反应为吸热反应
B.该反应为放热反应
C.断裂H-H键吸收能量
D.生成H-O键放出能量解析:H2在O2中燃烧是放热反应,不是吸热反应。
答案:A考点二 原电池8.根据下列反应不能设计为原电池的是( )
A.Fe+2FeCl3 3FeCl2
B.CH4+2O2 CO2+2H2O
C.H2+Cl2 2HCl
D.H2SO4+2NaOH Na2SO4+2H2O解析:设计为原电池的反应,必须是氧化还原反应,D项是复分解反应,不能设计为原电池。
答案:D9.右图为某原电池示意图,下列说法正确的是( )
A.铜电极是负极
B.锌电极是正极
C.铜电极上发生氧化反应
D.锌电极上发生氧化反应解析:锌的金属性比铜强,该原电池中锌电极作负极,发生氧化反应:Zn-2e-===Zn2+。
答案:D10.在铜锌原电池中,稀硫酸作电解质溶液,锌电极上发生的反应为Zn-2e-===Zn2+,下列说法错误的是( )
A.锌电极为负极
B.铜电极为正极
C.反应中Zn被氧化
D.反应中铜被还原解析:反应中铜作电极材料,没有发生反应,溶液中的H+被还原生成H2。
答案:D考点三 金属腐蚀与防护15.实验室准备较快地制取氢气,可采用的方法是( )
A.用纯锌与稀硫酸反应
B.用粗锌与稀硫酸反应
C.用粗锌与稀硝酸反应
D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应解析:粗锌中一般含有比锌不活泼金属易发生原电池反应;用粗锌与稀硝酸反应生成NO;在CuSO4溶液中浸泡过的纯锌表面覆盖了一层铜单质。
答案:B16.关于金属腐蚀和防护的说法不正确的是( )
A.金属腐蚀过程中发生了化学反应
B.在铁表面镀锌可对铁起保护作用
C.在铁船壳上镶嵌铜块能减缓船体的腐蚀
D.铝制品在空气中不易被腐蚀,是因其表面形成了致密的氧化铝保护层解析:在铁船壳上镶嵌铜块将加快船体的腐蚀。
答案:C17.以下现象与电化腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜器不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质水管与铜质水龙头连接,在接触处易生铁锈
D.银制奖牌久置后表面变暗解析:银制奖牌久置后表面变暗是发生化学腐蚀。
答案:C21.(2012年广东学业水平考试)“瓦斯”爆炸会严重威胁煤矿安全,下列说法正确的是( )
A.“瓦斯”的主要成分为乙烯
B.爆炸过程放出大量热量
C.爆炸过程有氧气参与反应
D.爆炸过程吸收大量热量解析:“瓦斯”主要成分是甲烷,甲烷在空气中燃烧爆炸是放热反应。
答案:BC22.下列图中,表示正反应为吸热反应的是( )解析:从A、C图像中可以看出反应前反应物的总能量小于反应后生成物的总能量。
答案:AC23.下列物质加入水中其溶液温度有明显升高的是( )
A.浓硫酸 B.固体氢氧化钠
C.生石灰 D.硝酸铵晶体解析:浓硫酸、固体氢氧化钠溶于水和生石灰与水反应放出大量热,溶液温度有明显升高;硝酸铵晶体溶于水吸收大量热,溶液温度有明显降低。
答案:ABC感谢您的使用,退出请按ESC键本小节结束
同课章节目录
