【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第十四讲 化学反应速率和化学平衡(44张ppt)
文档属性
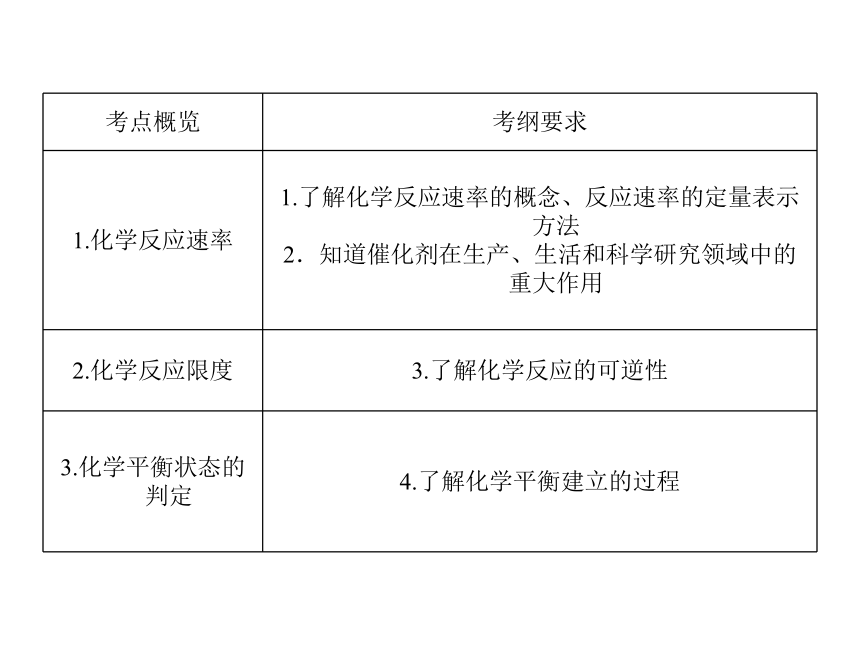
| 名称 | 【名师新编,备战2014高中学业水平考试】2013-2014高中化学名师专题指导(学业考纲+考点整合+水平达标):第十四讲 化学反应速率和化学平衡(44张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 602.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-02-15 00:00:00 | ||
图片预览











文档简介
课件44张PPT。第十四讲 化学反应速率和化学平衡化学反应速率?知识回顾
1.概念:化学反应速率是用来衡量化学反应进行________程度的物理量。
2.定量表示方法:化学反应速率通常用单位时间内反应物浓度的________或生成物浓度的________来表示。
①数学表达式:反应速率V(A)=Δc(A)/Δt;
②单位:Δc(A)—某物质的浓度变化量,常用mol·L-1;Δt-时间变化量,常用s、min;V(A)—常用单位为mol·(L·s)-1、mol·(L·min)-1。快慢 减少 增加 3.影响化学反应速率的因素
(1)内因:化学反应速率是由反应物的________决定的,它是决定化学反应速率的主要因素。
(2)外因:主要是指________、________、______、压强、固体表面积(颗粒大小)等其他因素。
①浓度:在其他条件不变时,增大反应物的浓度,化学反应速率________;减小反应物的浓度,化学反应速率________,与反应物的总量无关。性质 浓度 温度 催化剂 增大 减小 ②温度:升高温度,反应速率________。降低温度,反应速率________。
③压强:有气体参加反应,增大压强化学反应速率________,减小压强,化学反应速率________。
④催化剂:多数情况下,使用催化剂能________化学反应速率。催化剂反应前后的质量与组成不变。
⑤反应物接触面积:增大反应物接触面积,化学反应速率________。固体颗粒减小,固体跟气体或溶液的接触面积增大,反应速率增大。增大 减小 增大 减小 增大 增大 【例1】 (2012年广东学业水平考试)下列做法与化学反应速率有关的是( )
A.延长反应时间
B.使用合适的催化剂
C.增加反应物的浓度
D.改变反应的温度
解析:升高温度、使用催化剂、增大固体反应物面积均可以加快反应速率。而降低温度会减慢反应速率。
答案:BCD?课堂练习
1.(2012年广东学业水平考试)下列做法的目的与反应速率有关的是( )
A.用冰箱冷藏食物
B.在糖果制作过程中添加着色剂
C.向食盐中添加碘酸钾
D.在化学反应中加入合适的催化剂解析:用冰箱冷藏食物,可以降低温度,减慢食物腐败变质的反应速率;在化学反应中加入合适的催化剂可以加快反应速率。
答案:AD2.在日常生活中,与化学反应速率有关的做法是( )
A.用热水溶解蔗糖以加速溶解
B.把块状煤碾成粉状再燃烧
C.真空包装食品以延长保质期
D.低温冷藏使食品延缓变质解析:用热水溶解蔗糖,升高温度,加快蔗糖溶解速率,但蔗糖溶解属于物理变化,不是化学变化,故A错误;块状煤碾成粉状,增大反应物接触面积,加快燃烧反应速率;真空包袋装食品,减小O2浓度,减慢食品腐败变质的反应速率,可以延长保质期;低温冷藏使食品,减慢食物腐败变质的反应速率。
答案:BCD化学反应限度?知识回顾
1.可逆反应
(1)可逆反应概念:在同一条件下,既能向________方向(左往右)进行,同时又能向________方向(右往左)进行的反应,叫做可逆反应。如
2SO2+O2 2SO3逆反应 正反应(2)可逆反应的特点。
①正反应和逆反应发生条件相同。
②正反应和逆反应同时进行,且反应方向相反。
③各反应物、生成物同时存在,反应物不能全部转化为产物,反应________进行到底。
④能量转化关系,若正反应放热,则逆反应就________热,能量变化值相等。不能 吸(3)催化剂影响:使用适当催化剂,同等程度改变正、逆反应________,不改变反应进行________。
2.化学平衡状态:在一定条件下化学反应的正反应速率和逆反应速率达到________的状态。
3.化学平衡时间速率图象(下图)速率 方向 相等(1)反应开始:v正>v逆,反应向正方向进行。
(2)反应过程:v正减小,v逆增大,有逆反应发生。
(3)反应平衡(t1时刻起):v正=v逆。【例2】 (2011年广东学业水平考试)一定条件下的某可逆反应,其正反应速率v正和逆反应速率v逆随时间的变化如图所示,下列判断正确的是( )
A.t1时刻,v正<v逆
B.t2时刻,v正>v逆
C.t3时刻,v正=v逆
D.t4时刻,v正=v逆
解析:未出现平衡前,v正>v逆;出现平衡后,v正=v逆。
答案:BD?课堂练习
3.(2011年广东学业水平考试)设v正和v逆分别表示可逆反应的正反应速率和逆反应速率。在一定温度下逆反应N2+3H2高温、高压催化剂2NH3达到平衡时( )
A.v逆>v正
B.v逆<v正
C.v逆=v正,正逆反应停止
D.v逆=v正,正逆反应仍进行解析:对于可逆反应,当正反应速率和逆反应速率相等且不为0时,化学反应达到平衡。
答案:D4.对N2+3H2高温、高压催化剂2NH3可逆反应,使用催化剂的作用是( )
A.可以提高反应限度
B.可以同等程度改变正、逆反应速率
C.增大正反应速率,降低逆反应速率
D.改变平衡混合物的组成解析:对于工业合成氨,使用催化剂可以同等程度的加快正、逆反应速率,不能提高反应限度和改变平衡混合物的组成。
答案:B化学平衡状态判定:当反应达到化学平
衡状态时,有如下特征:?知识回顾
1.同一物质的消耗速率和生成速率________状态。即:v正=v逆。
2.反应体系中各组分的质量、百分含量、物质的浓度不随时间发生变化,保持________状态。
3.对于有颜色物质参加或生成的可逆反应,混合物的________不随时间发生变化的状态。相等 不变 颜色 4.对于隔热体系的吸热或放热反应的温度保持________状态。
5.浓度、温度、压强等改变,会影响化学平衡状态的________,催化剂的使用________改变化学平衡状态。不变 改变 不【例3】 (2012年广东学业水平考试)一定温度下,在一定体积的密闭容器内,可逆反应2NO(g)+Br2(g)??2NOBr(g)中,Br2的物质的量n(Br2)随时间变化的实验数据如下表:根据表中数据,该反应达到平衡状态所需的时间是( )
A.5 min B.10 min
C.15 min D.20 min解析:从图表可以看出,当反应进行到15 min时,Br2的物质的量仍在改变,反应速率在不断减慢,而进行到20 min后,Br2的物质的量不再发生变化,可判定该反应达到平衡状态所需的时间为20 min。
答案:D?课堂练习
5.(2012年广东学业水平考试)化学反应处于平衡状态时,下列说法正确的是( )
A.反应不再进行
B.反应物浓度等于生成物浓度
C.反应物质量等于生成物质量
D.各组分浓度不再随时间而变化解析:化学反应处于平衡状态时,各组分浓度不再随时间而变化。
答案:D6.(2011年广东学业水平考试)在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g)?? 2NO2(g)体系中,n(NO)随时间的变化如下表:该反应达到平衡状态的时间是( )
A.3 min B.1 min
C.2 min D.0 min一、单选题考点一 化学反应速率1.下列关于化学反应速率的说法中,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用生成或消耗某物质的物质的量的浓度多少来表示
C.在同一化学反应中,各物质的反应速率不一定相等
D.催化剂的使用可以改变反应速率解析:化学反应速率通常用单位时间内生成或消耗某物质的物质的量的浓度多少来表示。
答案:B2.把下列金属分别投入0.1 mol·L-1硫酸中,能发生反应且反应速率最大的是( )
A.Mg B.Al
C.Fe D.Cu解析:反应物性质对反应的快慢起决定作用。Mg金属活泼性最强,所以Mg和硫酸反应最剧烈,反应速率最大。
答案:A3.下列方法可以加快锌和稀硫酸反应速率的是( )
A.加热 B.加水
C.降温 D.加入NaOH固体解析:加热升温,可以加快反应速率。
答案:A考点二 化学反应限度8.关于化学反应速率、反应限度的下列说法中错误的是( )
A.其他条件不变时,升高温度,化学反应速率加快
B.其他条件不变时,增大浓度,化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等解析:A、B、D三项正确。C项错误,化学反应达到反应限度时,反应物的浓度与生成物的浓度不一定相等。
答案:C9.对于某可逆反应,下列说法正确的是( )
A.反应达到限度时正逆反应不再进行
B.当反应物浓度等于生成物浓度时反应达到平衡
C.正反应速率随时间变化不断减小
D.正逆反应速率不随时间变化时,反应达到平衡状态解析:当正逆反应速率不随时间变化时,反应物和生成物的浓度也将保持不变状态,此时,正逆反应速率相等,反应达到平衡状态。
答案:D10.下列说法中正确的是( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.可逆反应只能从正反应开始
C.可逆反应只能从逆反应开始
D.使用催化剂,可逆反应的正反应速率和逆反应速率同等程度改变,反应限度不变解析:使用催化剂能使正、逆反应速率变化值相等,不会破坏化学平衡状态,反应限度不会发生变化。
答案:D考点三 化学用语14.关于化学平衡状态的说法错误的是( )
A.正逆反应速率相等
B.各物质的物质的量一定相等
C.动态平衡
D.平衡混合物中各物质百分含量一定解析:各物质的物质的量相等与否不能作为化学平衡状态的判定依据。
答案:B15.在一定条件下,对于密闭容器中进行的反应:N2(g)+3H2(g)??2NH3(g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A.正、逆反应速率都等于零
B.N2、H2、NH3的浓度均不再变化
C.N2、H2、NH3在容器中共存
D.N2、H2、NH3的浓度相等解析:A、C、D三项不能作为判定化学平衡状态的依据。化学反应达到平衡状态时,正、逆反应速率相等,不为零;无论反应是否达到平衡状态,N2、H2、NH3都可以在容器中共存;N2、H2、NH3的浓度不一定相等;B项可以作为判定化学平衡状态的依据,只有当N2、H2、NH3的浓度均不再变化时,可以判定反应达到平衡状态。
答案:B16.在一定温度下的容积不变的容器中进行反应:C(s)+CO2(g)??2CO(g),当下列物理量不再发生变化时,能表明可逆反应已达到平衡状态的是( )
A.混合气体的分子数
B.混合物的质量
C.CO2的物质的量浓度
D.单位时间消耗1 mol CO2同时生成1 mol CO解析:选项A、B、D不能作为判定平衡状态依据;A项,该可逆反应的反应物与生成物反应前后气体的分子系数相等,平衡达到与否,容器内气体分子数均不会改变;B项,由质量守恒定律分析,混合物的总质量总是不变的;D项,只描述了正反应速率;C项,能作为判定化学平衡的依据,反应达到平衡状态时,体系中各组分的百分含量、物质的浓度保持一定。
答案:C二、多选题
21.在下列四种溶液中,分别加入少量固体二氧化锰,不能产生气体的是( )
A.1 mol·L-1盐酸
B.1 mol·L-1 Na2SO3溶液
C.1 mol·L-1 KClO3溶液
D.3% H2O2溶液解析:A、B、C三项的三种溶液中加入少量固体二氧化锰,不能产生气体;D项的3%H2O2溶液加入二氧化锰起催化剂作用,可以加快H2O2的分解产生O2的反应速率。
答案:ABC22.纯净的CaCO3与稀HCl反应制取CO2,为了降低反应速率,欲向溶液中加入下列物质,不可行的( )
A.NaCl固体 B.NaCl溶液
C.同浓度的稀HCl D.浓HCl解析:A、C、D三项不可行,NaCl固体、同浓度的稀HCl加入不改变H+浓度,反应速率不改变,浓HCl加入H+浓度增大,反应速率加快;B项可行,加入NaCl溶液起到稀释作用,降低反应物氢离子浓度,可以使反应速率降低。
答案:ACD23.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)??N2(g)+2CO2(g),下列说法正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡解析:A项错,升温,无论是正反应,还是逆反应,速率均加快。B、C、D三项正确,催化剂可以加快化学反应速率,达到平衡后,各组分的反应速率保持不变;由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达到平衡。
答案:BCD感谢您的使用,退出请按ESC键本小节结束
1.概念:化学反应速率是用来衡量化学反应进行________程度的物理量。
2.定量表示方法:化学反应速率通常用单位时间内反应物浓度的________或生成物浓度的________来表示。
①数学表达式:反应速率V(A)=Δc(A)/Δt;
②单位:Δc(A)—某物质的浓度变化量,常用mol·L-1;Δt-时间变化量,常用s、min;V(A)—常用单位为mol·(L·s)-1、mol·(L·min)-1。快慢 减少 增加 3.影响化学反应速率的因素
(1)内因:化学反应速率是由反应物的________决定的,它是决定化学反应速率的主要因素。
(2)外因:主要是指________、________、______、压强、固体表面积(颗粒大小)等其他因素。
①浓度:在其他条件不变时,增大反应物的浓度,化学反应速率________;减小反应物的浓度,化学反应速率________,与反应物的总量无关。性质 浓度 温度 催化剂 增大 减小 ②温度:升高温度,反应速率________。降低温度,反应速率________。
③压强:有气体参加反应,增大压强化学反应速率________,减小压强,化学反应速率________。
④催化剂:多数情况下,使用催化剂能________化学反应速率。催化剂反应前后的质量与组成不变。
⑤反应物接触面积:增大反应物接触面积,化学反应速率________。固体颗粒减小,固体跟气体或溶液的接触面积增大,反应速率增大。增大 减小 增大 减小 增大 增大 【例1】 (2012年广东学业水平考试)下列做法与化学反应速率有关的是( )
A.延长反应时间
B.使用合适的催化剂
C.增加反应物的浓度
D.改变反应的温度
解析:升高温度、使用催化剂、增大固体反应物面积均可以加快反应速率。而降低温度会减慢反应速率。
答案:BCD?课堂练习
1.(2012年广东学业水平考试)下列做法的目的与反应速率有关的是( )
A.用冰箱冷藏食物
B.在糖果制作过程中添加着色剂
C.向食盐中添加碘酸钾
D.在化学反应中加入合适的催化剂解析:用冰箱冷藏食物,可以降低温度,减慢食物腐败变质的反应速率;在化学反应中加入合适的催化剂可以加快反应速率。
答案:AD2.在日常生活中,与化学反应速率有关的做法是( )
A.用热水溶解蔗糖以加速溶解
B.把块状煤碾成粉状再燃烧
C.真空包装食品以延长保质期
D.低温冷藏使食品延缓变质解析:用热水溶解蔗糖,升高温度,加快蔗糖溶解速率,但蔗糖溶解属于物理变化,不是化学变化,故A错误;块状煤碾成粉状,增大反应物接触面积,加快燃烧反应速率;真空包袋装食品,减小O2浓度,减慢食品腐败变质的反应速率,可以延长保质期;低温冷藏使食品,减慢食物腐败变质的反应速率。
答案:BCD化学反应限度?知识回顾
1.可逆反应
(1)可逆反应概念:在同一条件下,既能向________方向(左往右)进行,同时又能向________方向(右往左)进行的反应,叫做可逆反应。如
2SO2+O2 2SO3逆反应 正反应(2)可逆反应的特点。
①正反应和逆反应发生条件相同。
②正反应和逆反应同时进行,且反应方向相反。
③各反应物、生成物同时存在,反应物不能全部转化为产物,反应________进行到底。
④能量转化关系,若正反应放热,则逆反应就________热,能量变化值相等。不能 吸(3)催化剂影响:使用适当催化剂,同等程度改变正、逆反应________,不改变反应进行________。
2.化学平衡状态:在一定条件下化学反应的正反应速率和逆反应速率达到________的状态。
3.化学平衡时间速率图象(下图)速率 方向 相等(1)反应开始:v正>v逆,反应向正方向进行。
(2)反应过程:v正减小,v逆增大,有逆反应发生。
(3)反应平衡(t1时刻起):v正=v逆。【例2】 (2011年广东学业水平考试)一定条件下的某可逆反应,其正反应速率v正和逆反应速率v逆随时间的变化如图所示,下列判断正确的是( )
A.t1时刻,v正<v逆
B.t2时刻,v正>v逆
C.t3时刻,v正=v逆
D.t4时刻,v正=v逆
解析:未出现平衡前,v正>v逆;出现平衡后,v正=v逆。
答案:BD?课堂练习
3.(2011年广东学业水平考试)设v正和v逆分别表示可逆反应的正反应速率和逆反应速率。在一定温度下逆反应N2+3H2高温、高压催化剂2NH3达到平衡时( )
A.v逆>v正
B.v逆<v正
C.v逆=v正,正逆反应停止
D.v逆=v正,正逆反应仍进行解析:对于可逆反应,当正反应速率和逆反应速率相等且不为0时,化学反应达到平衡。
答案:D4.对N2+3H2高温、高压催化剂2NH3可逆反应,使用催化剂的作用是( )
A.可以提高反应限度
B.可以同等程度改变正、逆反应速率
C.增大正反应速率,降低逆反应速率
D.改变平衡混合物的组成解析:对于工业合成氨,使用催化剂可以同等程度的加快正、逆反应速率,不能提高反应限度和改变平衡混合物的组成。
答案:B化学平衡状态判定:当反应达到化学平
衡状态时,有如下特征:?知识回顾
1.同一物质的消耗速率和生成速率________状态。即:v正=v逆。
2.反应体系中各组分的质量、百分含量、物质的浓度不随时间发生变化,保持________状态。
3.对于有颜色物质参加或生成的可逆反应,混合物的________不随时间发生变化的状态。相等 不变 颜色 4.对于隔热体系的吸热或放热反应的温度保持________状态。
5.浓度、温度、压强等改变,会影响化学平衡状态的________,催化剂的使用________改变化学平衡状态。不变 改变 不【例3】 (2012年广东学业水平考试)一定温度下,在一定体积的密闭容器内,可逆反应2NO(g)+Br2(g)??2NOBr(g)中,Br2的物质的量n(Br2)随时间变化的实验数据如下表:根据表中数据,该反应达到平衡状态所需的时间是( )
A.5 min B.10 min
C.15 min D.20 min解析:从图表可以看出,当反应进行到15 min时,Br2的物质的量仍在改变,反应速率在不断减慢,而进行到20 min后,Br2的物质的量不再发生变化,可判定该反应达到平衡状态所需的时间为20 min。
答案:D?课堂练习
5.(2012年广东学业水平考试)化学反应处于平衡状态时,下列说法正确的是( )
A.反应不再进行
B.反应物浓度等于生成物浓度
C.反应物质量等于生成物质量
D.各组分浓度不再随时间而变化解析:化学反应处于平衡状态时,各组分浓度不再随时间而变化。
答案:D6.(2011年广东学业水平考试)在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g)?? 2NO2(g)体系中,n(NO)随时间的变化如下表:该反应达到平衡状态的时间是( )
A.3 min B.1 min
C.2 min D.0 min一、单选题考点一 化学反应速率1.下列关于化学反应速率的说法中,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用生成或消耗某物质的物质的量的浓度多少来表示
C.在同一化学反应中,各物质的反应速率不一定相等
D.催化剂的使用可以改变反应速率解析:化学反应速率通常用单位时间内生成或消耗某物质的物质的量的浓度多少来表示。
答案:B2.把下列金属分别投入0.1 mol·L-1硫酸中,能发生反应且反应速率最大的是( )
A.Mg B.Al
C.Fe D.Cu解析:反应物性质对反应的快慢起决定作用。Mg金属活泼性最强,所以Mg和硫酸反应最剧烈,反应速率最大。
答案:A3.下列方法可以加快锌和稀硫酸反应速率的是( )
A.加热 B.加水
C.降温 D.加入NaOH固体解析:加热升温,可以加快反应速率。
答案:A考点二 化学反应限度8.关于化学反应速率、反应限度的下列说法中错误的是( )
A.其他条件不变时,升高温度,化学反应速率加快
B.其他条件不变时,增大浓度,化学反应速率加快
C.化学反应达到反应限度时,反应物的浓度与生成物的浓度相等
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等解析:A、B、D三项正确。C项错误,化学反应达到反应限度时,反应物的浓度与生成物的浓度不一定相等。
答案:C9.对于某可逆反应,下列说法正确的是( )
A.反应达到限度时正逆反应不再进行
B.当反应物浓度等于生成物浓度时反应达到平衡
C.正反应速率随时间变化不断减小
D.正逆反应速率不随时间变化时,反应达到平衡状态解析:当正逆反应速率不随时间变化时,反应物和生成物的浓度也将保持不变状态,此时,正逆反应速率相等,反应达到平衡状态。
答案:D10.下列说法中正确的是( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.可逆反应只能从正反应开始
C.可逆反应只能从逆反应开始
D.使用催化剂,可逆反应的正反应速率和逆反应速率同等程度改变,反应限度不变解析:使用催化剂能使正、逆反应速率变化值相等,不会破坏化学平衡状态,反应限度不会发生变化。
答案:D考点三 化学用语14.关于化学平衡状态的说法错误的是( )
A.正逆反应速率相等
B.各物质的物质的量一定相等
C.动态平衡
D.平衡混合物中各物质百分含量一定解析:各物质的物质的量相等与否不能作为化学平衡状态的判定依据。
答案:B15.在一定条件下,对于密闭容器中进行的反应:N2(g)+3H2(g)??2NH3(g),下列说法能充分说明该反应已经达到化学平衡状态的是( )
A.正、逆反应速率都等于零
B.N2、H2、NH3的浓度均不再变化
C.N2、H2、NH3在容器中共存
D.N2、H2、NH3的浓度相等解析:A、C、D三项不能作为判定化学平衡状态的依据。化学反应达到平衡状态时,正、逆反应速率相等,不为零;无论反应是否达到平衡状态,N2、H2、NH3都可以在容器中共存;N2、H2、NH3的浓度不一定相等;B项可以作为判定化学平衡状态的依据,只有当N2、H2、NH3的浓度均不再变化时,可以判定反应达到平衡状态。
答案:B16.在一定温度下的容积不变的容器中进行反应:C(s)+CO2(g)??2CO(g),当下列物理量不再发生变化时,能表明可逆反应已达到平衡状态的是( )
A.混合气体的分子数
B.混合物的质量
C.CO2的物质的量浓度
D.单位时间消耗1 mol CO2同时生成1 mol CO解析:选项A、B、D不能作为判定平衡状态依据;A项,该可逆反应的反应物与生成物反应前后气体的分子系数相等,平衡达到与否,容器内气体分子数均不会改变;B项,由质量守恒定律分析,混合物的总质量总是不变的;D项,只描述了正反应速率;C项,能作为判定化学平衡的依据,反应达到平衡状态时,体系中各组分的百分含量、物质的浓度保持一定。
答案:C二、多选题
21.在下列四种溶液中,分别加入少量固体二氧化锰,不能产生气体的是( )
A.1 mol·L-1盐酸
B.1 mol·L-1 Na2SO3溶液
C.1 mol·L-1 KClO3溶液
D.3% H2O2溶液解析:A、B、C三项的三种溶液中加入少量固体二氧化锰,不能产生气体;D项的3%H2O2溶液加入二氧化锰起催化剂作用,可以加快H2O2的分解产生O2的反应速率。
答案:ABC22.纯净的CaCO3与稀HCl反应制取CO2,为了降低反应速率,欲向溶液中加入下列物质,不可行的( )
A.NaCl固体 B.NaCl溶液
C.同浓度的稀HCl D.浓HCl解析:A、C、D三项不可行,NaCl固体、同浓度的稀HCl加入不改变H+浓度,反应速率不改变,浓HCl加入H+浓度增大,反应速率加快;B项可行,加入NaCl溶液起到稀释作用,降低反应物氢离子浓度,可以使反应速率降低。
答案:ACD23.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)??N2(g)+2CO2(g),下列说法正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡解析:A项错,升温,无论是正反应,还是逆反应,速率均加快。B、C、D三项正确,催化剂可以加快化学反应速率,达到平衡后,各组分的反应速率保持不变;由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达到平衡。
答案:BCD感谢您的使用,退出请按ESC键本小节结束
同课章节目录
