苏教版(2019)必修 第一册专题2 研究物质的基本方法 离子反应(27张ppt)
文档属性
| 名称 | 苏教版(2019)必修 第一册专题2 研究物质的基本方法 离子反应(27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 13.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 11:44:58 | ||
图片预览








文档简介
(共27张PPT)
离子反应
高中化学
必修第一册
海水中有哪些离子?
如何分离出来加以利用?
工业废水中有哪些污染性离子?如何除去?
家用化学品如何安全合理使用?
课标要求
认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
能用离子方程式表示典型物质的主要化学性质。
能准确判断电解质的强弱,并书写电离方程式。
判断常见离子之间能否发生反应,即离子能否共存。
能判断离子方程式的正误。
会书写离子方程式。
理解基本概念
电解质和非电解质
电 解 质:化合物,能电离
强电解质:化合物,完全电离
弱电解质:化合物,不完全电离
非电解质:化合物,不电离
化合物
电解质
非电解质
弱电解质
强电解质
酸、碱、盐、水
强酸、强碱、大多数盐
弱酸、弱碱、少数盐、水
乙醇、葡萄糖、NH3、CO2……
思考:以下说法是否正确?
A. 氯化钠溶液能导电,所以氯化钠溶液是电解质
B. 固态氯化钠不导电,但氯化钠是电解质
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. 三氧化硫溶于水能导电,所以三氧化硫是电解质
E. 铜能导电,所以铜是电解质
F. BaSO4的水溶液不能导电,所以BaSO4是非电解质
溶液是混合物
SO3自身不能电离
铜是单质
难溶于水,但溶解的部分完全电离,是强电解质
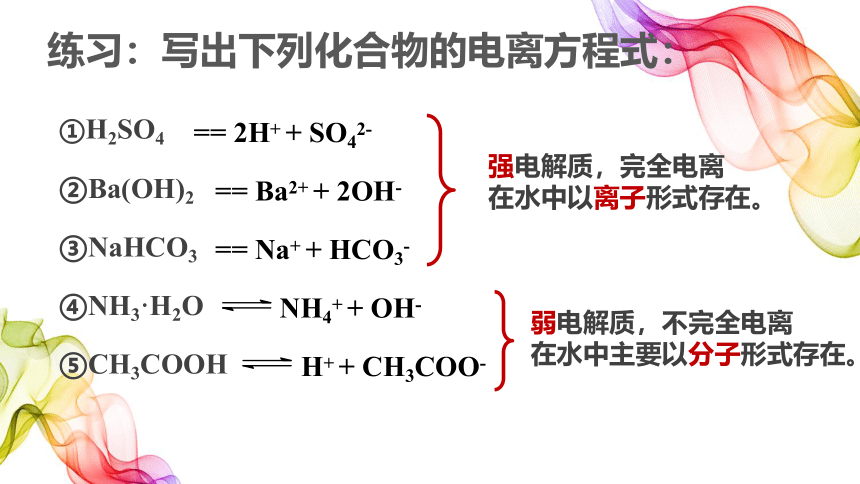
练习:写出下列化合物的电离方程式:
①H2SO4
②Ba(OH)2
③NaHCO3
④NH3·H2O
⑤CH3COOH
== 2H+ + SO42-
== Ba2+ + 2OH-
== Na+ + HCO3-
NH4+ + OH-
H+ + CH3COO-
强电解质,完全电离
在水中以离子形式存在。
弱电解质,不完全电离
在水中主要以分子形式存在。
认识离子之间的反应
离子之间为什么会发生反应?
Ca2+、CO32-
HCO3-、H+
CH3COO-、H+
NH4+、OH-
H+、OH-
HCO3-、OH-
Fe2+、MnO4-
Fe3+、SCN-
判断下列各组离子间是否发生反应,发生了哪种类型的反应,在溶液中能否大量共存。
生成CaCO3沉淀
生成CO2气体
生成弱酸
生成弱碱
生成水
生成水
氧化还原反应
络合反应
离子之间为什么会发生反应?
生成沉淀
生成气体
生成弱酸
生成弱碱
生成水
发生氧化还原反应
其它
如:SO42-与____;CO32-与_________;Cl-与____;
OH-与________________________;H+与______。
如:OH-与______;H+与____________________________。
如:H+与____________________________。
如:OH-与__________。
如:OH-与____。
Ba2+
Ca2+ Ba2+
Ag+
SiO32-
Mg2+、Al3+、Fe3+、Cu2+……
NH4+
CO32- HCO3- SO32- HSO3-
CH3COO- ClO- F- ……
H+
NH4+……
如:Cl-与____________; Cl-与__________
如: Fe3+与______。
H+、MnO4-
H+、ClO-
SCN-
练习
判断常温下,下列各组离子在指定溶液中能否大量共存。
A.0.1mol·L-1NaOH 溶液:K+、NH4+、SO42-、NO3-
B.0.1mol·L-1Na2CO3 溶液: K+、Ba2+、NO3- 、Cl-
C.0.1mol·L-1FeCl3 溶液: K+、NH4+ 、I-、NO3-
D.无色透明溶液中: Cu2+、Na+、Cl-、NO3-
常见的附加条件
无色透明溶液
滴加石蕊试剂显红色
滴加酚酞显红色
pH=1的溶液
辨析:Na+、NO3-、Cu2+、Cl- 无色透明溶液中
澄清透明溶液中
不可含有Cu2+、Fe3+、Fe2+、MnO4-
显酸性,含有大量H+
显碱性,含有大量OH-
显酸性,含有大量H+
正确表达离子间的反应
离子方程式书写的一般步骤
①写——根据客观事实,写出正确的________________。
②拆——把易_____且易_________的物质拆成离子。
③删——对方程式两边都有的相同离子, “按数”消掉。
④查——检查写出的离子方程式是否符合两个守恒
(_______守恒、_______守恒)
化学方程式
电离
溶
原子
电荷
练习:写出下列反应的离子方程式。
(1)水中通入氯气制氯水
(2)氯气的尾气处理反应
(3)小苏打中和胃酸
(4)氢氧化铝中和胃酸
(5)碳酸钠溶液中滴加少量盐酸
(6)碳酸氢钠溶液中加入氢氧化钠
(7)醋酸溶解水垢中的碳酸钙
Cl2 + 2OH- == Cl- + ClO- + H2O
HCO3- + H+ == CO2↑ + H2O
Al(OH)3 + 3H+ == Al3+ + 3H2O
2CH3COOH + CaCO3 == 2CH3COO- + Ca2+ + CO2↑ + H2O
CO32- + H+ == HCO3-
HCO3- + OH- == CO32- + H2O
Cl2 + H2O H+ + Cl- +HClO
离子反应方程式书写常常会出现的错误
①产物不对:产物不符合客观实际。
如:2Fe + 6H+ = 2Fe3+ + 3H2↑,应该生成______。
②拆分不当:只有可溶性强电解质才可以拆成离子。
如:盐酸与碳酸钙反应,CO32-+2H+==CO2↑+H2O,_________不应该拆成离子。
③没有配平:电荷守恒很重要。
如:Fe2+ + Cl2 = Fe3+ + 2Cl—,_______不守恒。
④比例失调:如Ba2++OH-+H++ SO42=== BaSO4↓+H2O中,_____和____
应该按1:2参加反应。
Fe3+
CaCO3
电荷
Ba2+ OH-
练习:指出以下离子方程式的错误之处。
A.铜与稀硝酸反应 Cu+2H+==Cu2++H2↑
B.碳酸钡与盐酸反应 CO32-+2H+==CO2↑+H2O
C.盐酸与氨水反应 H++ OH-==H2O
D.硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag↓
E.氯化铁溶液中加铁粉 Fe3+ + Fe = 2Fe2+
练习.判断下列离子方程式是否正确。
F.硫酸铜溶液中滴加氢氧化钡溶液
Ba2++SO42-==BaSO4↓
G.氢氧化钡溶液和稀硫酸
Ba2++OH-+H++SO42-=BaSO4↓+2H2O
H.NaOH溶液中通入足量CO2
CO2 + 2OH- = CO32-+ H2O
I.碳酸氢钠溶液中加入少量氢氧化钙
HCO3-+ OH-+Ca2+= CaCO3↓ + H2O
离子反应的应用
资料:海水中主要元素的含量
海水中
主要阴离子:
Cl-、SO42-
Br-……
主要阳离子:
Na+、Mg2+
Ca2+、K+
……
离子反应的应用——离子检验
沉淀法:
Cl-检验:取少量溶液,加入HNO3酸化的AgNO3溶液,有白色沉淀生成,说明原溶液中含有Cl- 。
SO42-检验:取少量溶液,加入少量HCl,无明显现象,再加入BaCl2溶液,有白色沉淀,说明原溶液中含有SO42- 。
氧化还原法:
Br-检验:取少量溶液,滴加少量氯水和CCl4振荡,下层呈橙红色, ,说明原溶液中含有Br- 。
离子反应的应用——工业废水的分析与处理
某河道两旁有甲乙两工厂,它们排放的工业废水中共含有
H+、K+、Ag+、Fe3+、Cl- 、OH- 、NO3-七种离子,试分析两厂排出废水的成分,如何除去废水中的有害离子?试分析两厂废水综合处理的可能性。
甲厂:H+
乙厂:
OH-
Ag+ Fe3+
Cl-
NO3-
K+
离子反应的应用——表示反应的实质
84消毒液与洁厕灵一起使用会引起Cl2中毒,可用离子方程式表示为:
ClO- + Cl- + 2H+==Cl2↑ + H2O
小苏打和氢氧化铝片都可以中和胃酸,可用离子方程式表示为:
HCO3- + H+==CO2↑ + H2O
Al(OH)3 + 3H+==Al3+ + 3H2O
用食醋可以去除水垢,可用离子方程式表示为:
2CH3COOH + CaCO3==2CH3COO- + Ca2+ + H2O + CO2↑
理解基本概念
认识离子之间的反应
正确表达离子间的反应
离子反应的应用
你学会了吗?
离子反应
离子反应
高中化学
必修第一册
海水中有哪些离子?
如何分离出来加以利用?
工业废水中有哪些污染性离子?如何除去?
家用化学品如何安全合理使用?
课标要求
认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
能用离子方程式表示典型物质的主要化学性质。
能准确判断电解质的强弱,并书写电离方程式。
判断常见离子之间能否发生反应,即离子能否共存。
能判断离子方程式的正误。
会书写离子方程式。
理解基本概念
电解质和非电解质
电 解 质:化合物,能电离
强电解质:化合物,完全电离
弱电解质:化合物,不完全电离
非电解质:化合物,不电离
化合物
电解质
非电解质
弱电解质
强电解质
酸、碱、盐、水
强酸、强碱、大多数盐
弱酸、弱碱、少数盐、水
乙醇、葡萄糖、NH3、CO2……
思考:以下说法是否正确?
A. 氯化钠溶液能导电,所以氯化钠溶液是电解质
B. 固态氯化钠不导电,但氯化钠是电解质
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. 三氧化硫溶于水能导电,所以三氧化硫是电解质
E. 铜能导电,所以铜是电解质
F. BaSO4的水溶液不能导电,所以BaSO4是非电解质
溶液是混合物
SO3自身不能电离
铜是单质
难溶于水,但溶解的部分完全电离,是强电解质
练习:写出下列化合物的电离方程式:
①H2SO4
②Ba(OH)2
③NaHCO3
④NH3·H2O
⑤CH3COOH
== 2H+ + SO42-
== Ba2+ + 2OH-
== Na+ + HCO3-
NH4+ + OH-
H+ + CH3COO-
强电解质,完全电离
在水中以离子形式存在。
弱电解质,不完全电离
在水中主要以分子形式存在。
认识离子之间的反应
离子之间为什么会发生反应?
Ca2+、CO32-
HCO3-、H+
CH3COO-、H+
NH4+、OH-
H+、OH-
HCO3-、OH-
Fe2+、MnO4-
Fe3+、SCN-
判断下列各组离子间是否发生反应,发生了哪种类型的反应,在溶液中能否大量共存。
生成CaCO3沉淀
生成CO2气体
生成弱酸
生成弱碱
生成水
生成水
氧化还原反应
络合反应
离子之间为什么会发生反应?
生成沉淀
生成气体
生成弱酸
生成弱碱
生成水
发生氧化还原反应
其它
如:SO42-与____;CO32-与_________;Cl-与____;
OH-与________________________;H+与______。
如:OH-与______;H+与____________________________。
如:H+与____________________________。
如:OH-与__________。
如:OH-与____。
Ba2+
Ca2+ Ba2+
Ag+
SiO32-
Mg2+、Al3+、Fe3+、Cu2+……
NH4+
CO32- HCO3- SO32- HSO3-
CH3COO- ClO- F- ……
H+
NH4+……
如:Cl-与____________; Cl-与__________
如: Fe3+与______。
H+、MnO4-
H+、ClO-
SCN-
练习
判断常温下,下列各组离子在指定溶液中能否大量共存。
A.0.1mol·L-1NaOH 溶液:K+、NH4+、SO42-、NO3-
B.0.1mol·L-1Na2CO3 溶液: K+、Ba2+、NO3- 、Cl-
C.0.1mol·L-1FeCl3 溶液: K+、NH4+ 、I-、NO3-
D.无色透明溶液中: Cu2+、Na+、Cl-、NO3-
常见的附加条件
无色透明溶液
滴加石蕊试剂显红色
滴加酚酞显红色
pH=1的溶液
辨析:Na+、NO3-、Cu2+、Cl- 无色透明溶液中
澄清透明溶液中
不可含有Cu2+、Fe3+、Fe2+、MnO4-
显酸性,含有大量H+
显碱性,含有大量OH-
显酸性,含有大量H+
正确表达离子间的反应
离子方程式书写的一般步骤
①写——根据客观事实,写出正确的________________。
②拆——把易_____且易_________的物质拆成离子。
③删——对方程式两边都有的相同离子, “按数”消掉。
④查——检查写出的离子方程式是否符合两个守恒
(_______守恒、_______守恒)
化学方程式
电离
溶
原子
电荷
练习:写出下列反应的离子方程式。
(1)水中通入氯气制氯水
(2)氯气的尾气处理反应
(3)小苏打中和胃酸
(4)氢氧化铝中和胃酸
(5)碳酸钠溶液中滴加少量盐酸
(6)碳酸氢钠溶液中加入氢氧化钠
(7)醋酸溶解水垢中的碳酸钙
Cl2 + 2OH- == Cl- + ClO- + H2O
HCO3- + H+ == CO2↑ + H2O
Al(OH)3 + 3H+ == Al3+ + 3H2O
2CH3COOH + CaCO3 == 2CH3COO- + Ca2+ + CO2↑ + H2O
CO32- + H+ == HCO3-
HCO3- + OH- == CO32- + H2O
Cl2 + H2O H+ + Cl- +HClO
离子反应方程式书写常常会出现的错误
①产物不对:产物不符合客观实际。
如:2Fe + 6H+ = 2Fe3+ + 3H2↑,应该生成______。
②拆分不当:只有可溶性强电解质才可以拆成离子。
如:盐酸与碳酸钙反应,CO32-+2H+==CO2↑+H2O,_________不应该拆成离子。
③没有配平:电荷守恒很重要。
如:Fe2+ + Cl2 = Fe3+ + 2Cl—,_______不守恒。
④比例失调:如Ba2++OH-+H++ SO42=== BaSO4↓+H2O中,_____和____
应该按1:2参加反应。
Fe3+
CaCO3
电荷
Ba2+ OH-
练习:指出以下离子方程式的错误之处。
A.铜与稀硝酸反应 Cu+2H+==Cu2++H2↑
B.碳酸钡与盐酸反应 CO32-+2H+==CO2↑+H2O
C.盐酸与氨水反应 H++ OH-==H2O
D.硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag↓
E.氯化铁溶液中加铁粉 Fe3+ + Fe = 2Fe2+
练习.判断下列离子方程式是否正确。
F.硫酸铜溶液中滴加氢氧化钡溶液
Ba2++SO42-==BaSO4↓
G.氢氧化钡溶液和稀硫酸
Ba2++OH-+H++SO42-=BaSO4↓+2H2O
H.NaOH溶液中通入足量CO2
CO2 + 2OH- = CO32-+ H2O
I.碳酸氢钠溶液中加入少量氢氧化钙
HCO3-+ OH-+Ca2+= CaCO3↓ + H2O
离子反应的应用
资料:海水中主要元素的含量
海水中
主要阴离子:
Cl-、SO42-
Br-……
主要阳离子:
Na+、Mg2+
Ca2+、K+
……
离子反应的应用——离子检验
沉淀法:
Cl-检验:取少量溶液,加入HNO3酸化的AgNO3溶液,有白色沉淀生成,说明原溶液中含有Cl- 。
SO42-检验:取少量溶液,加入少量HCl,无明显现象,再加入BaCl2溶液,有白色沉淀,说明原溶液中含有SO42- 。
氧化还原法:
Br-检验:取少量溶液,滴加少量氯水和CCl4振荡,下层呈橙红色, ,说明原溶液中含有Br- 。
离子反应的应用——工业废水的分析与处理
某河道两旁有甲乙两工厂,它们排放的工业废水中共含有
H+、K+、Ag+、Fe3+、Cl- 、OH- 、NO3-七种离子,试分析两厂排出废水的成分,如何除去废水中的有害离子?试分析两厂废水综合处理的可能性。
甲厂:H+
乙厂:
OH-
Ag+ Fe3+
Cl-
NO3-
K+
离子反应的应用——表示反应的实质
84消毒液与洁厕灵一起使用会引起Cl2中毒,可用离子方程式表示为:
ClO- + Cl- + 2H+==Cl2↑ + H2O
小苏打和氢氧化铝片都可以中和胃酸,可用离子方程式表示为:
HCO3- + H+==CO2↑ + H2O
Al(OH)3 + 3H+==Al3+ + 3H2O
用食醋可以去除水垢,可用离子方程式表示为:
2CH3COOH + CaCO3==2CH3COO- + Ca2+ + H2O + CO2↑
理解基本概念
认识离子之间的反应
正确表达离子间的反应
离子反应的应用
你学会了吗?
离子反应
