苏教版(2019) 必修 第一册 专题3 氯及其化合物(17张ppt)
文档属性
| 名称 | 苏教版(2019) 必修 第一册 专题3 氯及其化合物(17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 12:08:41 | ||
图片预览





文档简介
(共17张PPT)
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
目标预览
1.能基于物质类别、元素价态和原子结构对氯及其化合物的性质进行预测。
2.通过实验探究氯气的主要化学性质,初步掌握研究性质的实验方法。
3.认识含氯物质及其转化关系,建立物质的性质与用途之间的内在联系。
4.认识含氯物质在生产生活中的广泛应用,增强合理使用化学品的意识。
5.多角度认识氧化还原反应,初步形成氧化还原反应中的电子守恒思想。
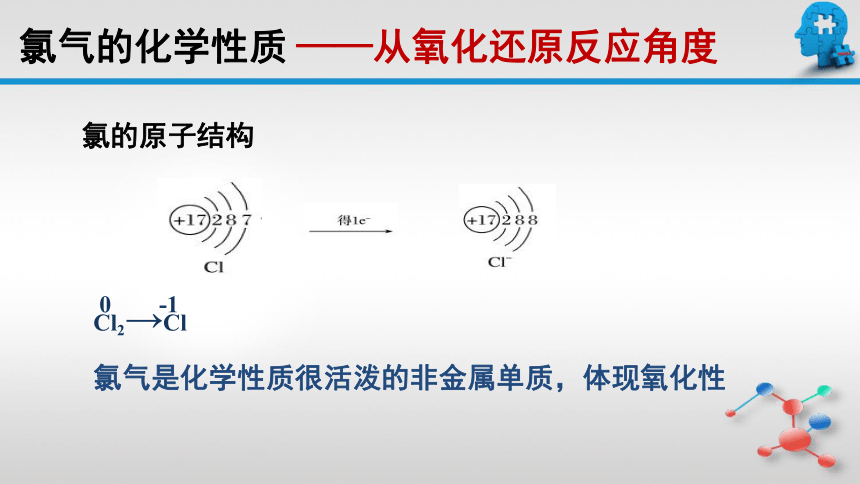
氯的原子结构
氯气是化学性质很活泼的非金属单质,体现氧化性
氯气的化学性质
——从氧化还原反应角度
0 -1
Cl2→Cl
1.与金属反应:
(1)与钠反应:
(2) 与铁反应:
(3) 与铜反应:
氯气的化学性质
2Na+Cl2 === 2NaCl
——从氧化还原反应角度
注意与变价金属反应生成高价态金属氯化物。
0 点燃 +3
2Fe+3Cl2 ===== 2FeCl3
0 点燃 +2
Cu+Cl2 ==== CuCl2
0 -1
Cl2→Cl
2. 与非金属反应
(工业上利用电解饱和食盐水得到的氢气和氯气制盐酸)
0 点燃 -1
与H2反应:H2 + Cl2 ==== 2HCl
或光照
-1 通电 0
2NaCl+2H2O===2NaOH+H2↑+Cl2↑
0 -1
Cl2→Cl
-1 0
Cl→Cl2
-1 加热 0
MnO2+4HCl(浓)==== MnCl2 +Cl2↑ +2H2O
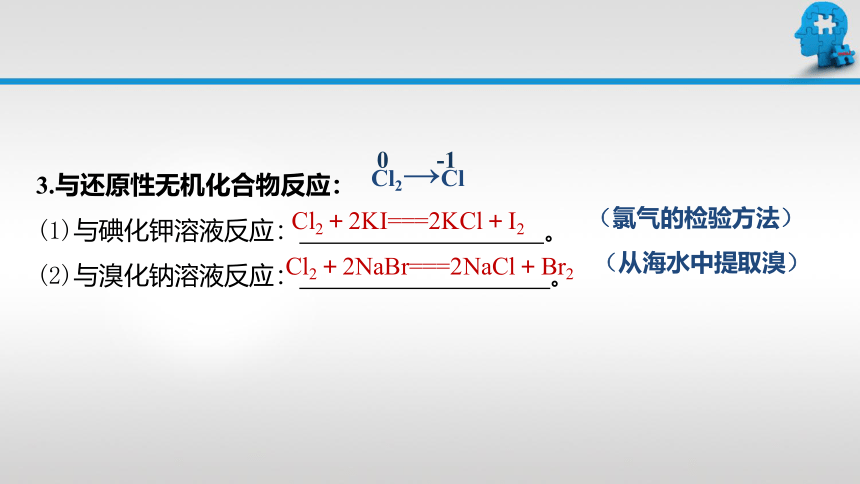
3.与还原性无机化合物反应:
(1)与碘化钾溶液反应: 。
(2)与溴化钠溶液反应: 。
Cl2+2KI===2KCl+I2
Cl2+2NaBr===2NaCl+Br2
(氯气的检验方法)
(从海水中提取溴)
0 -1
Cl2→Cl
4. 与水反应
5. 与碱反应
(1)与烧碱反应:
(2)与石灰乳反应:
漂白粉的主要成分是 , 有效成分是 。
歧化反应
0 -1 +1
Cl2+H2O HCl+HClO
0 -1 +1
Cl2+2NaOH===NaCl+NaClO+H2O
0 -1 +1
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2、CaCl2
Ca(ClO)2
Cl2与热的NaOH溶液反应制取NaClO3:
0 加热 -1 +5
3Cl2+6NaOH==5NaCl+NaClO3+3H2O
(用氯气给自来水消毒)
(工业制漂白液,氯气的尾气吸收)
(工业制漂白粉)
-1 0 +1
Cl←Cl2→Cl
新制得的氯水有哪些成分?
漂白粉的漂白原理:
Ca(ClO)2 + CO2 +H2O == CaCO3+2HClO
思考:漂白粉和洁厕剂为什么不能混合使用?
+1 -1 0
Ca(ClO)2+4HCl===CaCl2+Cl2↑+2H2O
归中反应
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
-1 0 +1
Cl → Cl2 ← Cl
“84”消毒液与硫酸反应可以制得氯气
+5
+7
+1
+4
HCl
NaCl
Cl2
HClO
NaClO
ClO2
KClO3
HClO4
0
-1
歧化反应
归中反应
小结:
氧化剂:体现氧化性,化合价降低,得到电子,发生还原反应(被还原)
还原剂:体现还原性,化合价升高,失去电子,发生氧化反应(被氧化)
NaClO2
+3
氯气是化学性质很活泼的非金属单质,体现氧化性
课堂巩固
1.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
C
2. “吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下。下列有关说法正确的是( )
A. 氧化1所用的氯气可通过电解饱和NaCl溶液制得
B. 吹出后剩余溶液中可能大量存在的离子有Na+、Mg2+、Cl-、Br-
C. 吸收过程发生反应的化学方程式:SO2+Br2+H2O===2HBr+H2SO3
D. 从氧化2所得溶液中分离出单质溴的方法是用酒精萃取
A
3. 已知NaClO溶液与CO2能发生如下反应:
NaClO+H2O+CO2===NaHCO3+HClO,下列叙述错误的是( )
A. HClO比H2CO3的酸性弱
B. 加入少量盐酸可增强NaClO溶液的漂白性
C. 通入少量Cl2可增加NaClO溶液的漂白性
D. “84”消毒液的有效成分是Ca(ClO)2,可用于消毒
D
4. 含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉[有效成分为Ca(ClO) 2 ]、“84”消毒液(有效成分为 NaClO)等。
(1)漂白粉和 84 消毒液具有杀菌消毒功能,主要是因为两者均含有 (填离子符号) 。
(2)以下实验能鉴别 Ca(ClO) 2 溶液和 NaClO 溶液的是(填字母序号) 。
a.焰色反应 b.加入 Na2CO 3 溶液 c.加入 NaCl 稀溶液
(3)①将“84”消毒液与洁厕剂(含有盐酸)混合,反应生成气体 (填化学式) ,能使人中毒。
②“84”消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是 O2 ,写出反应的化学方程式 。
ClO-
a、b
Cl2
NaClO+H2O2=NaCl+O2↑+H2O
5. “84”消毒液与硫酸溶液反应可以制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下图所示的实验装置。
(1)在该实验中,制取氯气的装置是____(填序号)。
②
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是____________________ ,请提出合理的改进方法________________________________ 。
(3)D中的现象是_______________ ,分离D中液体的方法是______。
(4)E中的现象是___________________。
(5)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________________________
___________________________________________________________________________。
Cl2中混有少量水蒸气
在A、B之间增加装有浓硫酸的洗气瓶
CCl4层呈紫红色
分液
取少量烧杯内吸收Cl2后的溶液于试管中,滴加足量的稀硝酸酸化,再滴加AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
溶液中产生气泡
谢 谢 收 看
思考:漂白粉和洁厕剂为什么不能混合使用?
+1 -1 0
Ca(ClO)2+4HCl===CaCl2+Cl2↑+2H2O
归中反应
“84”消毒液与硫酸反应可以制得氯气
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
-1 0 +1
Cl → Cl2 ← Cl
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
“84”消毒液与硫酸反应可以制得氯气
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
目标预览
1.能基于物质类别、元素价态和原子结构对氯及其化合物的性质进行预测。
2.通过实验探究氯气的主要化学性质,初步掌握研究性质的实验方法。
3.认识含氯物质及其转化关系,建立物质的性质与用途之间的内在联系。
4.认识含氯物质在生产生活中的广泛应用,增强合理使用化学品的意识。
5.多角度认识氧化还原反应,初步形成氧化还原反应中的电子守恒思想。
氯的原子结构
氯气是化学性质很活泼的非金属单质,体现氧化性
氯气的化学性质
——从氧化还原反应角度
0 -1
Cl2→Cl
1.与金属反应:
(1)与钠反应:
(2) 与铁反应:
(3) 与铜反应:
氯气的化学性质
2Na+Cl2 === 2NaCl
——从氧化还原反应角度
注意与变价金属反应生成高价态金属氯化物。
0 点燃 +3
2Fe+3Cl2 ===== 2FeCl3
0 点燃 +2
Cu+Cl2 ==== CuCl2
0 -1
Cl2→Cl
2. 与非金属反应
(工业上利用电解饱和食盐水得到的氢气和氯气制盐酸)
0 点燃 -1
与H2反应:H2 + Cl2 ==== 2HCl
或光照
-1 通电 0
2NaCl+2H2O===2NaOH+H2↑+Cl2↑
0 -1
Cl2→Cl
-1 0
Cl→Cl2
-1 加热 0
MnO2+4HCl(浓)==== MnCl2 +Cl2↑ +2H2O
3.与还原性无机化合物反应:
(1)与碘化钾溶液反应: 。
(2)与溴化钠溶液反应: 。
Cl2+2KI===2KCl+I2
Cl2+2NaBr===2NaCl+Br2
(氯气的检验方法)
(从海水中提取溴)
0 -1
Cl2→Cl
4. 与水反应
5. 与碱反应
(1)与烧碱反应:
(2)与石灰乳反应:
漂白粉的主要成分是 , 有效成分是 。
歧化反应
0 -1 +1
Cl2+H2O HCl+HClO
0 -1 +1
Cl2+2NaOH===NaCl+NaClO+H2O
0 -1 +1
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2、CaCl2
Ca(ClO)2
Cl2与热的NaOH溶液反应制取NaClO3:
0 加热 -1 +5
3Cl2+6NaOH==5NaCl+NaClO3+3H2O
(用氯气给自来水消毒)
(工业制漂白液,氯气的尾气吸收)
(工业制漂白粉)
-1 0 +1
Cl←Cl2→Cl
新制得的氯水有哪些成分?
漂白粉的漂白原理:
Ca(ClO)2 + CO2 +H2O == CaCO3+2HClO
思考:漂白粉和洁厕剂为什么不能混合使用?
+1 -1 0
Ca(ClO)2+4HCl===CaCl2+Cl2↑+2H2O
归中反应
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
-1 0 +1
Cl → Cl2 ← Cl
“84”消毒液与硫酸反应可以制得氯气
+5
+7
+1
+4
HCl
NaCl
Cl2
HClO
NaClO
ClO2
KClO3
HClO4
0
-1
歧化反应
归中反应
小结:
氧化剂:体现氧化性,化合价降低,得到电子,发生还原反应(被还原)
还原剂:体现还原性,化合价升高,失去电子,发生氧化反应(被氧化)
NaClO2
+3
氯气是化学性质很活泼的非金属单质,体现氧化性
课堂巩固
1.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
C
2. “吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下。下列有关说法正确的是( )
A. 氧化1所用的氯气可通过电解饱和NaCl溶液制得
B. 吹出后剩余溶液中可能大量存在的离子有Na+、Mg2+、Cl-、Br-
C. 吸收过程发生反应的化学方程式:SO2+Br2+H2O===2HBr+H2SO3
D. 从氧化2所得溶液中分离出单质溴的方法是用酒精萃取
A
3. 已知NaClO溶液与CO2能发生如下反应:
NaClO+H2O+CO2===NaHCO3+HClO,下列叙述错误的是( )
A. HClO比H2CO3的酸性弱
B. 加入少量盐酸可增强NaClO溶液的漂白性
C. 通入少量Cl2可增加NaClO溶液的漂白性
D. “84”消毒液的有效成分是Ca(ClO)2,可用于消毒
D
4. 含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉[有效成分为Ca(ClO) 2 ]、“84”消毒液(有效成分为 NaClO)等。
(1)漂白粉和 84 消毒液具有杀菌消毒功能,主要是因为两者均含有 (填离子符号) 。
(2)以下实验能鉴别 Ca(ClO) 2 溶液和 NaClO 溶液的是(填字母序号) 。
a.焰色反应 b.加入 Na2CO 3 溶液 c.加入 NaCl 稀溶液
(3)①将“84”消毒液与洁厕剂(含有盐酸)混合,反应生成气体 (填化学式) ,能使人中毒。
②“84”消毒液与双氧水溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是 O2 ,写出反应的化学方程式 。
ClO-
a、b
Cl2
NaClO+H2O2=NaCl+O2↑+H2O
5. “84”消毒液与硫酸溶液反应可以制取氯气,反应的化学方程式为NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下图所示的实验装置。
(1)在该实验中,制取氯气的装置是____(填序号)。
②
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是____________________ ,请提出合理的改进方法________________________________ 。
(3)D中的现象是_______________ ,分离D中液体的方法是______。
(4)E中的现象是___________________。
(5)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________________________
___________________________________________________________________________。
Cl2中混有少量水蒸气
在A、B之间增加装有浓硫酸的洗气瓶
CCl4层呈紫红色
分液
取少量烧杯内吸收Cl2后的溶液于试管中,滴加足量的稀硝酸酸化,再滴加AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
溶液中产生气泡
谢 谢 收 看
思考:漂白粉和洁厕剂为什么不能混合使用?
+1 -1 0
Ca(ClO)2+4HCl===CaCl2+Cl2↑+2H2O
归中反应
“84”消毒液与硫酸反应可以制得氯气
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
-1 0 +1
Cl → Cl2 ← Cl
+1 -1 0
NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O
“84”消毒液与硫酸反应可以制得氯气
