高中化学 苏教版(2019) 选择性必修1 专题2 化学反应速率、方向与限度(19张ppt)
文档属性
| 名称 | 高中化学 苏教版(2019) 选择性必修1 专题2 化学反应速率、方向与限度(19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 12:14:58 | ||
图片预览




文档简介
(共19张PPT)
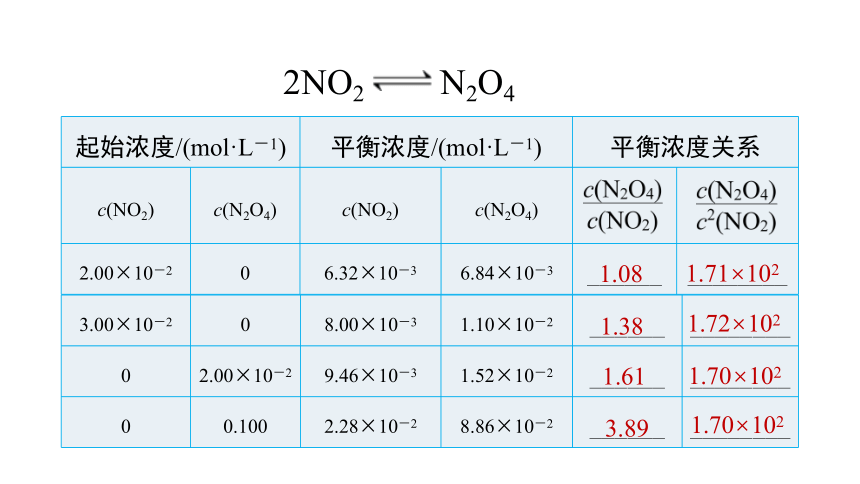
化 学 平 衡 常 数
起始浓度/(mol·L-1) 平衡浓度/(mol·L-1) 平衡浓度关系 c(NO2) c(N2O4) c(NO2) c(N2O4)
2.00×10-2 0 6.32×10-3 6.84×10-3 ______ ________
1.08
1.71×102
3.00×10-2 0 8.00×10-3 1.10×10-2 ______ ________
0 2.00×10-2 9.46×10-3 1.52×10-2 ______ ________
0 0.100 2.28×10-2 8.86×10-2 ______ ________
1.38
1.61
3.89
1.72×102
1.70×102
1.70×102
2NO2 N2O4
化学平衡常数: 一定温度下,可逆反应
aA(g)+bB(g) cC(g)+dD(g)
达平衡时,生成物浓度幂之积与反应物浓度幂之积的比值为一个常数,称为该反应的化学平衡常数,用符号K表示。
K=
化学方程式 平衡常数表达式
2NO2(g) N2O4(g) ________________
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) ___________________
Br2+H2O H++Br-+HBrO
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ___________________
化学平衡常数: 一定温度下,可逆反应
aA(g)+bB(g) cC(g)+dD(g)
注:固体、纯液体和稀的水溶液中的水不写入平衡常数表达式
K=
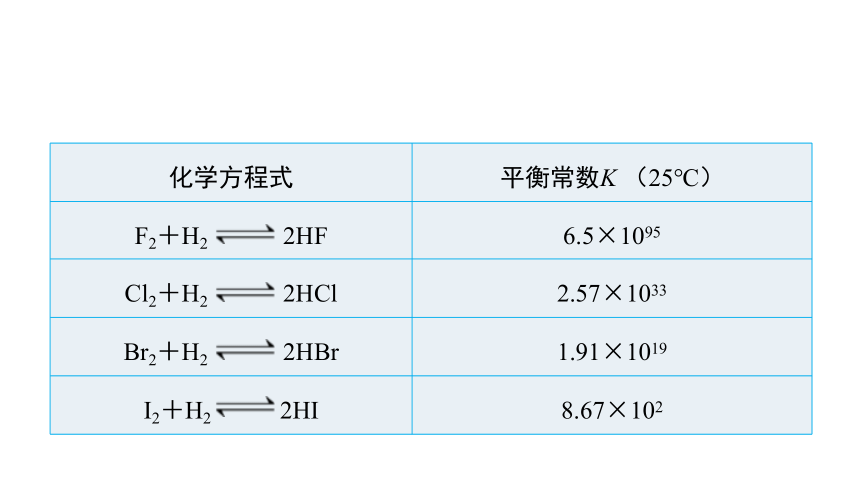
化学方程式 平衡常数K (25℃)
F2+H2 2HF 6.5×1095
Cl2+H2 2HCl 2.57×1033
Br2+H2 2HBr 1.91×1019
I2+H2 2HI 8.67×102
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
N2(g)+3H2(g) 2NH3(g) H=-92 kJ·mol-1
放热反应,温度升高,K值 ;
吸热反应,温度升高,K值 。
减小
增大
N2 +3H2 2NH3 K1 =
1/2N2 +3/2H2 NH3 K2 =
2NH3 N2 +3H2 K3 =
C(s) + CO2(g) 2CO(g) ΔH1 K1
CO(g) + H2O(g) CO2(g) + H2(g) ΔH2 K2
C(s) + H2O(g) CO(g) + H2(g) ΔH3 K3
平衡转化率:平衡时已转化了的某反应物的量(如物质的量、
物质的量浓度等)与该物质起始总量的比值。
思考:若反应开始时CO的浓度为0.200 mol·L-1,H2O的浓度为0.300 mol·L-1,求达到平衡时CO与H2O的转化率分别为多少?
(2)多种反应物参加反应时,可通过增加一种反应物的浓度来提高另一种反应物的平衡转化率,但其本身的平衡转化率会降低。
(1)在一定温度下,一个具体的化学反应,只有一个平衡常数,但不同反应物的平衡转化率可能不同。
浓度商: 一定温度下,反应
aA(g)+bB(g) cC(g)+dD(g)
在某时刻,生成物浓度幂之积与反应物浓度幂之积的比值称为浓度商,用符号QC表示。
QC =
K=
高炉反应FeO(s)+CO(g) Fe(s)+CO2(g) 在1100 ℃时,化学平衡常数K=0.263。
某时刻测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应______(填“正向”或“逆向”)进行。
若Qc>K:反应逆向进行;
若Qc=K:处于平衡状态;
若Qc<K:反应正向进行。
同学们再见!
化 学 平 衡 常 数
起始浓度/(mol·L-1) 平衡浓度/(mol·L-1) 平衡浓度关系 c(NO2) c(N2O4) c(NO2) c(N2O4)
2.00×10-2 0 6.32×10-3 6.84×10-3 ______ ________
1.08
1.71×102
3.00×10-2 0 8.00×10-3 1.10×10-2 ______ ________
0 2.00×10-2 9.46×10-3 1.52×10-2 ______ ________
0 0.100 2.28×10-2 8.86×10-2 ______ ________
1.38
1.61
3.89
1.72×102
1.70×102
1.70×102
2NO2 N2O4
化学平衡常数: 一定温度下,可逆反应
aA(g)+bB(g) cC(g)+dD(g)
达平衡时,生成物浓度幂之积与反应物浓度幂之积的比值为一个常数,称为该反应的化学平衡常数,用符号K表示。
K=
化学方程式 平衡常数表达式
2NO2(g) N2O4(g) ________________
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g) ___________________
Br2+H2O H++Br-+HBrO
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O ___________________
化学平衡常数: 一定温度下,可逆反应
aA(g)+bB(g) cC(g)+dD(g)
注:固体、纯液体和稀的水溶液中的水不写入平衡常数表达式
K=
化学方程式 平衡常数K (25℃)
F2+H2 2HF 6.5×1095
Cl2+H2 2HCl 2.57×1033
Br2+H2 2HBr 1.91×1019
I2+H2 2HI 8.67×102
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
N2(g)+3H2(g) 2NH3(g) H=-92 kJ·mol-1
放热反应,温度升高,K值 ;
吸热反应,温度升高,K值 。
减小
增大
N2 +3H2 2NH3 K1 =
1/2N2 +3/2H2 NH3 K2 =
2NH3 N2 +3H2 K3 =
C(s) + CO2(g) 2CO(g) ΔH1 K1
CO(g) + H2O(g) CO2(g) + H2(g) ΔH2 K2
C(s) + H2O(g) CO(g) + H2(g) ΔH3 K3
平衡转化率:平衡时已转化了的某反应物的量(如物质的量、
物质的量浓度等)与该物质起始总量的比值。
思考:若反应开始时CO的浓度为0.200 mol·L-1,H2O的浓度为0.300 mol·L-1,求达到平衡时CO与H2O的转化率分别为多少?
(2)多种反应物参加反应时,可通过增加一种反应物的浓度来提高另一种反应物的平衡转化率,但其本身的平衡转化率会降低。
(1)在一定温度下,一个具体的化学反应,只有一个平衡常数,但不同反应物的平衡转化率可能不同。
浓度商: 一定温度下,反应
aA(g)+bB(g) cC(g)+dD(g)
在某时刻,生成物浓度幂之积与反应物浓度幂之积的比值称为浓度商,用符号QC表示。
QC =
K=
高炉反应FeO(s)+CO(g) Fe(s)+CO2(g) 在1100 ℃时,化学平衡常数K=0.263。
某时刻测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应______(填“正向”或“逆向”)进行。
若Qc>K:反应逆向进行;
若Qc=K:处于平衡状态;
若Qc<K:反应正向进行。
同学们再见!
