高中化学 苏教版(2019) 选择性必修1 专题2 化学平衡(20张ppt)
文档属性
| 名称 | 高中化学 苏教版(2019) 选择性必修1 专题2 化学平衡(20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 12:17:57 | ||
图片预览






文档简介
(共20张PPT)
速率平衡图像分析
几张经典“速率、平衡图像”
实际生产中的图像
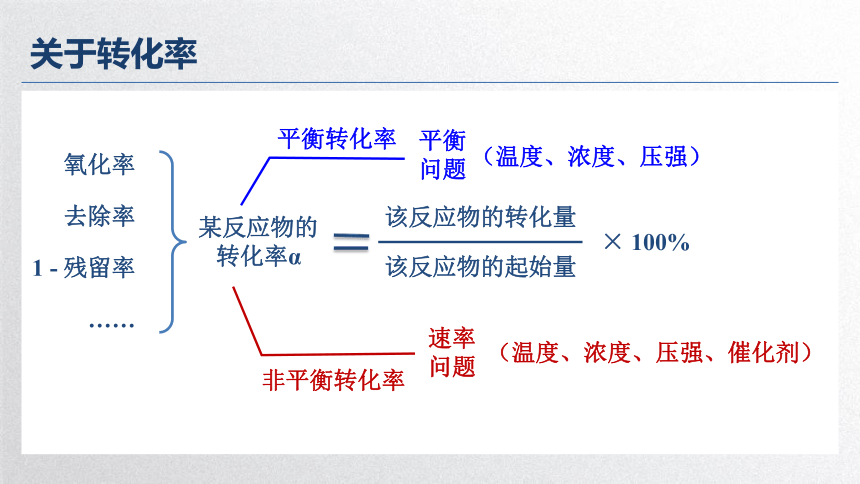
关于转化率
某反应物的
转化率α
该反应物的转化量
该反应物的起始量
× 100%
氧化率
去除率
1 - 残留率
……
平衡转化率
平衡
问题
非平衡转化率
速率
问题
(温度、浓度、压强、催化剂)
(温度、浓度、压强)
速 率问题还是平衡问题?
与哪个影响因素有关?
如何正确表达?
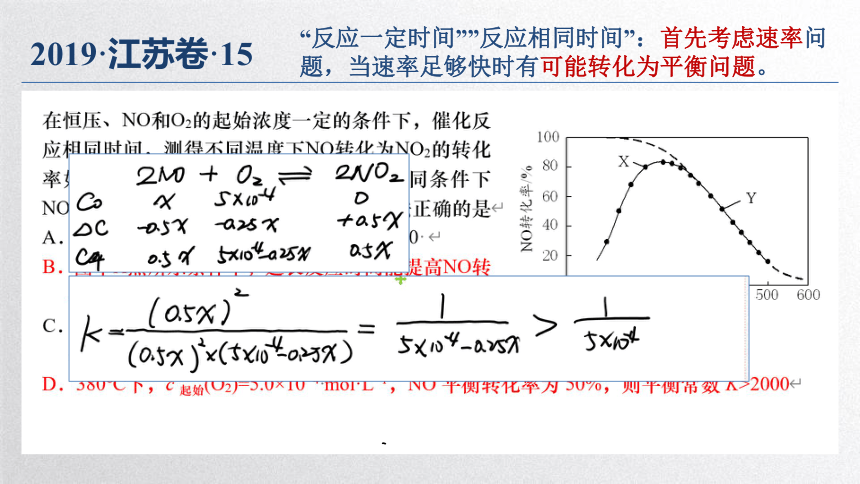
2019·江苏卷·15
“反应一定时间””反应相同时间”:首先考虑速率问题,当速率足够快时有可能转化为平衡问题。
2018·江苏卷·20
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图 1)。反应相同时间NOx的去除率随反应温度的变化曲线如图 2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
敞口容器:一般是速率问题。
转化率迅速上升或下降多半与催化剂有关。
迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;
上升缓慢段主要是温度升高引起的NOx去除反应速率增大。
催化剂活性下降;NH3与O2反应生成了NOx
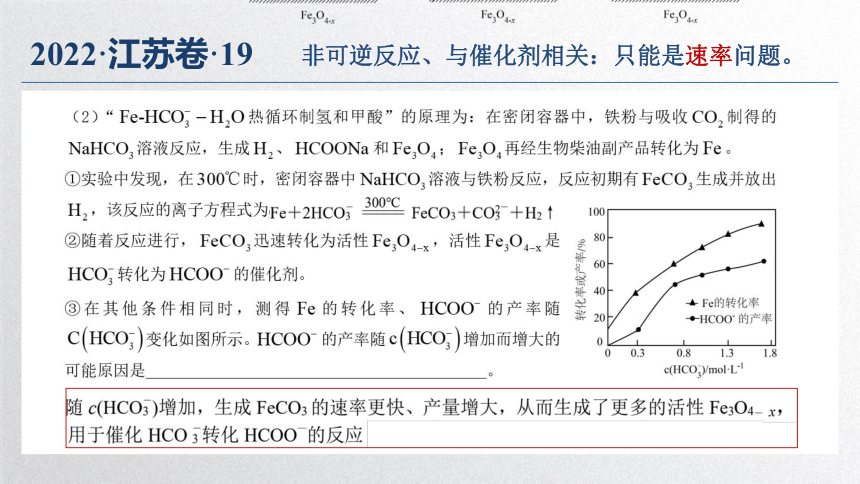
2022·江苏卷·19
非可逆反应、与催化剂相关:只能是速率问题。
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 , 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
小结:
敞口容器 或 非可逆反应
反应一定时间、相同时间
平衡转化率
速率问题
平衡问题
平 衡问题的分析和解答
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
2021·江苏卷·18
CH4与CO2重整的主要反应的热化学方程式为
反应I : CH4(g) + CO2(g)= 2CO(g) + 2H2(g) A ΔH = 246.5 kJ·mol-1
反应II: H2(g) + CO2(g)=CO(g) +H2O(g) ΔH = 41.2 kJ·mol-1
反应III: 2CO(g)= CO2(g) + C(s) ΔH = - 172.5 kJ·mol-1
②1.01 ×105Pa下,将n起始(CO2) ∶n起始(CH4)=1 ∶ 1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如题18图-1所示。800°C下CO2平衡转化率远大于600°C下CO2平衡转化率,其原因是: ________________________________________。
反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小
平衡问题的表达
平衡问题的表达中一般不出现“平衡向……个方向移动”的表述。
常用的表达:
“有(或不)利于某反应向……个方向进行”
“有(或不)利于提高某反应转化率”
“反应向正向(或逆向)进行的程度增大(或减小)”
2022·江苏卷·13
如何理解选择性
乙醇
未转化
转化
转化为CO2的百分比——CO2的选择性
转化为 CO的百分比——CO2的选择性
苏州模拟卷
反应B的ΔH>0,温度升高,CO2转化率增大;
反应A的ΔH<0,温度升高,CO2转化率减小;
且前者增大幅度大于后者减小幅度。
苏州模拟卷
增大压强;使用对反应A、C催化活性更高的催化剂
THANKS
希望能对你有所帮助!
速率平衡图像分析
几张经典“速率、平衡图像”
实际生产中的图像
关于转化率
某反应物的
转化率α
该反应物的转化量
该反应物的起始量
× 100%
氧化率
去除率
1 - 残留率
……
平衡转化率
平衡
问题
非平衡转化率
速率
问题
(温度、浓度、压强、催化剂)
(温度、浓度、压强)
速 率问题还是平衡问题?
与哪个影响因素有关?
如何正确表达?
2019·江苏卷·15
“反应一定时间””反应相同时间”:首先考虑速率问题,当速率足够快时有可能转化为平衡问题。
2018·江苏卷·20
将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图 1)。反应相同时间NOx的去除率随反应温度的变化曲线如图 2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
敞口容器:一般是速率问题。
转化率迅速上升或下降多半与催化剂有关。
迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;
上升缓慢段主要是温度升高引起的NOx去除反应速率增大。
催化剂活性下降;NH3与O2反应生成了NOx
2022·江苏卷·19
非可逆反应、与催化剂相关:只能是速率问题。
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 , 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
小结:
敞口容器 或 非可逆反应
反应一定时间、相同时间
平衡转化率
速率问题
平衡问题
平 衡问题的分析和解答
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
2020·江苏卷·15
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比 条件下,
CH4和CO2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800 K、n(CH4)∶n(CO2)=1∶1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
2021·江苏卷·18
CH4与CO2重整的主要反应的热化学方程式为
反应I : CH4(g) + CO2(g)= 2CO(g) + 2H2(g) A ΔH = 246.5 kJ·mol-1
反应II: H2(g) + CO2(g)=CO(g) +H2O(g) ΔH = 41.2 kJ·mol-1
反应III: 2CO(g)= CO2(g) + C(s) ΔH = - 172.5 kJ·mol-1
②1.01 ×105Pa下,将n起始(CO2) ∶n起始(CH4)=1 ∶ 1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如题18图-1所示。800°C下CO2平衡转化率远大于600°C下CO2平衡转化率,其原因是: ________________________________________。
反应Ⅰ和反应Ⅱ的ΔH>0,高温下反应的平衡常数大(反应正向进行程度大),CO2的消耗量大,反应Ⅲ的ΔH<0,高温下反应的平衡常数小(反应正向进行程度小),CO2的生成量小
平衡问题的表达
平衡问题的表达中一般不出现“平衡向……个方向移动”的表述。
常用的表达:
“有(或不)利于某反应向……个方向进行”
“有(或不)利于提高某反应转化率”
“反应向正向(或逆向)进行的程度增大(或减小)”
2022·江苏卷·13
如何理解选择性
乙醇
未转化
转化
转化为CO2的百分比——CO2的选择性
转化为 CO的百分比——CO2的选择性
苏州模拟卷
反应B的ΔH>0,温度升高,CO2转化率增大;
反应A的ΔH<0,温度升高,CO2转化率减小;
且前者增大幅度大于后者减小幅度。
苏州模拟卷
增大压强;使用对反应A、C催化活性更高的催化剂
THANKS
希望能对你有所帮助!
