11.1 生活中常见的盐(教学课件40页)-九年级化学下册同步教学课件+课时练(人教版)
文档属性
| 名称 | 11.1 生活中常见的盐(教学课件40页)-九年级化学下册同步教学课件+课时练(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 40.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 23:37:10 | ||
图片预览









文档简介
(共40张PPT)
九年级化学下册同步(人教版)
第十一单元 盐 化肥 Salt Chemical fertilizer
课题1 生活中常见的盐
第一课时 盐的性质和用途
- Learning objectives -
第
1
课
时
1.
了解常见的盐的性质和用途
2.
知道复分解反应的特征
小苏打
碳酸钙
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:粗盐中难溶性杂质的去除
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:碳酸钠、碳酸氢钠和稀盐酸的反应
Video3:碳酸钠与氢氧化钙的反应
生活中的盐是指食盐,主要成分是NaCl。而化学中的盐,不仅仅是指食盐,而是指一类组成里含有 和 的化合物。
金属离子
酸根离子
小苏打
碳酸钙
NaCl
Na2CO3
KMnO4
NaHCO3
CaCO3
CuSO4
FeSO4
BaSO4
一、氯化钠(NaCl)
1.食盐主要成分________
2.工业用盐含有________而有毒。
物理性质 _____色固体,有_____味,_____溶于水
用途 1.调味品,腌制食品
2.维持生理活动,配制生理盐水(0.9%)
3.融雪剂(降低雪的熔点)
4.农业选种(密度)、工业原料
制法 1.开采盐矿
2.海水晒盐,盐井、盐湖煮盐
白
咸
易
NaNO2
NaCl
视频:粗盐中难溶性杂质的去除
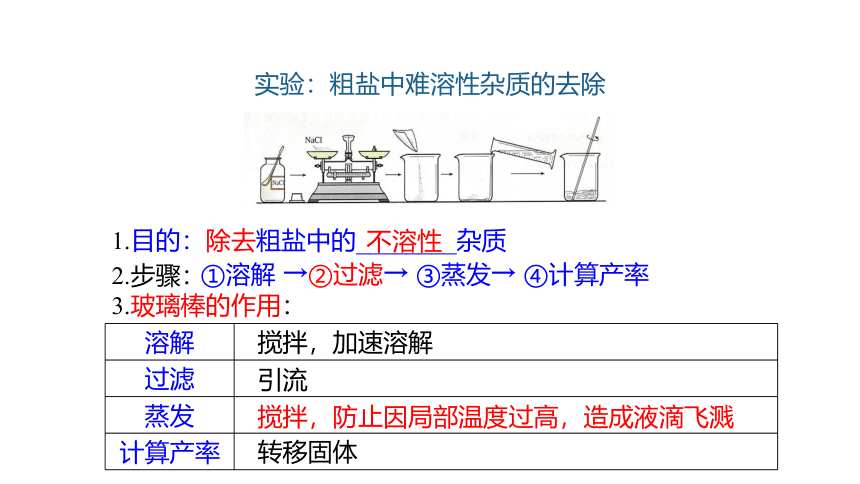
1.目的:除去粗盐中的________杂质
2.步骤:
3.玻璃棒的作用:
①溶解 →②过滤→ ③蒸发→ ④计算产率
不溶性
溶解
过滤
蒸发
计算产率
搅拌,加速溶解
引流
搅拌,防止因局部温度过高,造成液滴飞溅
转移固体
实验:粗盐中难溶性杂质的去除
1.蒸发时__________________________时停止加热。
目的:防止_____飞溅
2.停止加热后,用 取下蒸发皿,放在石棉网上
3.产率偏低的原因:
(1)粗盐未完全溶解
(2)溶解或蒸发时液滴飞溅;
(3)蒸发时晶体飞溅。
坩埚钳
待蒸发皿中出现较多固体时
晶体
二、碳酸钠、碳酸氢钠和碳酸钙
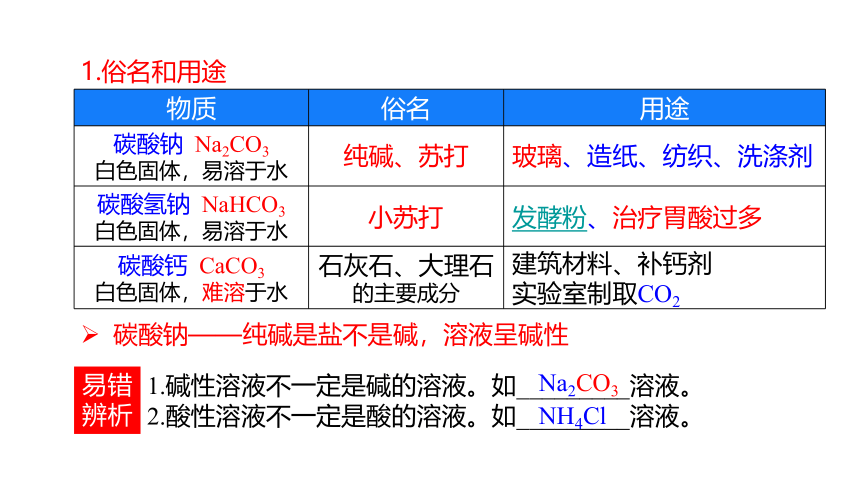
1.碱性溶液不一定是碱的溶液。如_________溶液。
2.酸性溶液不一定是酸的溶液。如_________溶液。
易错辨析
物质 俗名 用途
碳酸钠 Na2CO3 白色固体,易溶于水
碳酸氢钠 NaHCO3 白色固体,易溶于水
碳酸钙 CaCO3 白色固体,难溶于水 石灰石、大理石 的主要成分
纯碱、苏打
小苏打
玻璃、造纸、纺织、洗涤剂
发酵粉、治疗胃酸过多
建筑材料、补钙剂
实验室制取CO2
1.俗名和用途
Na2CO3
NH4Cl
碳酸钠——纯碱是盐不是碱,溶液呈碱性
1.小苏打(碳酸氢钠)受热易分解,可做发酵粉:
返回
2NaHCO3 Na2CO3+CO2↑+H2O
2.治疗胃酸过多
NaHCO3+HCl=NaCl+CO2↑+H2O
阅读教材P76“资料卡片”回答问题
1.我国化学家侯德榜用“联合制碱法”所制得的纯碱是_______。
A.碳酸钠 B.氢氧化钠
碳酸钠
侯德榜
Na2CO3、NaHCO3和CaCO3在组成上相似,都属于碳酸盐。它们是否也有类似的性质呢?
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
二、碳酸钠、碳酸氢钠和碳酸钙
CaCO3+ HCl=
回顾:实验室制取CO2的化学方程式:
2 CaCl2+ H2CO3
2.化学性质
视频:碳酸钠、碳酸氢钠和稀盐酸的反应
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 产生大量_______,澄清石灰水__________ 分析 碳酸钠/碳酸氢钠与盐酸反应生成了_______气体 气泡
2 =2NaCl+CO2↑+H2O
治疗胃酸过多
变浑浊
CO2
=NaCl+CO2↑+H2O
2.盐的化学性质
(1):碳酸盐 + 酸 = 新盐+H2O+CO2↑
Na2CO3+ HCl
NaHCO3+HCl
CaCO3+2HCl= CaCl2+ CO2 ↑ +H2O
碳酸盐(CO32- 、HCO3-)的检验方法
操 作 现 象 结 论
①取少量样品向其 中加入_______ 有_______产生
②将产生的气体 通入澄清石灰水 石灰水_________ 稀盐酸
该样品是碳酸盐
(溶液中存在CO32- 、HCO3-)
变浑浊
气泡
逻辑推理:活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属( )
视频:碳酸钠与氢氧化钙的反应
现 象 溶液中出现____色沉淀
分 析 二者反应生成一种____溶于水的物质
难
白
Na2CO3+Ca(OH)2=CaCO3↓ +2NaOH
纯碱制烧碱
2.盐的化学性质(2):盐+ 碱= 新盐 + 新碱
Fe + CuSO4 = FeSO4 + Cu
Cu+2AgNO3 = Cu(NO3)2 +2Ag
二、碳酸钠、碳酸氢钠和碳酸钙
盐的化学性质(3):盐+ 金属= 新盐 + 新金属
1.由两种化合物互相__________,生成另外两种化合物的反应。
2.表达式:AB + CD =___________
3.特征:_______________
Na2CO3 + 2HCl= 2NaCl+ H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
AD + CB
两交换,价不变
交换成分
H2CO3
三、复分解反应(基本反应类型)
CaCO3 + 2HCl =CaCl2 + H2O + CO2 ↑
四种基本反应类型中
一定有化合价变化的反应类型是 ;
一定没有化合价变化的反应类型是 。
置换反应
复分解反应
复分解反应
1.酸+碱→盐+水(中和反应)
2.酸+金属氧化物→盐+水
3.碱+盐→新碱+新盐
4.盐+盐→新盐+新盐
5.酸+盐→新盐+新酸
NaOH + HCl =H2O + NaCl
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CaCO3 + 2HCl =CaCl2 + H2O + CO2 ↑
碱+非金属氧化物→盐+水
不属于复分解反应
Ca(OH)2+CO2=CaCO3↓+H2O
一、常见的盐
1.Na2CO3俗称______、______。溶液呈____性。
用途:____________________________。
2.NaHCO3俗称________。用途:______________________。
3.CaCO3是________、__________的主要成分。
用途:___________________________________。
二、盐的化学性质
1.盐+酸=新盐+新酸 碳酸盐+酸=新盐+CO2+H2O
2.盐+碱=新盐+新碱
3.盐+金属=新盐+新金属
Na2CO3+2HCl=2NaCl+ CO2↑+H2O
NaHCO3+HCl=NaCl+ CO2↑+H2O
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Fe+CuSO4 = FeSO4 +Cu
CaCO3+2HCl=CaCl2+ CO2↑ +H2O
纯碱
小苏打
玻璃、造纸、纺织、洗涤剂
发酵粉、治疗胃酸过多
建筑材料、补钙剂、实验室制取CO2
苏打
碱
石灰石
大理石
1.由两种化合物互相__________,生成另外两种化合物的反应。
2.表达式:AB + CD =___________
3.特征:_______________
AD + CB
两交换,价不变
交换成分
三、复分解反应
1.下列属于复分解反应的是( )
A.2NaOH+CO2=Na2CO3+H2O
B.Zn+H2SO4=ZnSO4+H2↑
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O
D.CaCO3 CaO+CO2↑
C
- Learning objectives -
第
2
课
时
1.
了解复分解反应发生的条件
2.
能够利用离子对解决一些问题
=
+
+
本课件内嵌2个视频,即点即播,使用方便(此页可删除)。
Video1:氢氧化钠、氯化钡与硫酸铜溶液的反应
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:某些酸、碱、盐之间能否发生反应
视频:氢氧化钠、氯化钡与硫酸铜溶液的反应
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象 产生____色沉淀 产生____色沉淀
方程式
探究复分解反应发生的条件
蓝
白
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=BaSO4↓+CuCl2
盐的化学性质(4):盐 + 盐 →新盐1 + 新盐2
视频:某些酸、碱、盐之间能否发生反应
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=BaSO4↓+CuCl2
HCl + NaOH =NaCl + H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3+Ca(OH)2=CaCO3↓ +2NaOH
复分解反应发生的条件:生成______、______或____至少一种。
沉淀
气体
水
一、复分解反应发生的条件
某些酸、碱、盐之间能否发生反应
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
能
不能
能
能
生成水
不符合复分解反应发生条件
生成沉淀
生成气体和水
(2)实际参加反应的离子是__________________。
1.(2019.河南)如图是氢氧化钠与盐酸反应示意图。
Na+、Cl-
H++OH-=H2O
(1)反应前后没有发生变化的离子是__________。
反应方程式 反应实质
1 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
2 CuSO4+BaCl2=BaSO4↓+CuCl2
3 HCl + NaOH =NaCl + H2O
4 2NaOH + H2SO4=Na2SO4 + 2H2O 5 CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
6 NaHCO3 + HCl = NaCl + H2O + CO2↑
用离子方程式表示下列反应的实质
H+ + OH-= H2O
Cu2+ + 2OH- =Cu(OH)2↓
Ba2+ + SO42- =BaSO4↓
2H+ + CO32- = CO2↑+H2O
复分解反应发生的条件就是至少有一对离子能反应生成沉淀/气体/水。
2H++ HCO3- = CO2↑+H2O
H+ + OH- → H2O
H+ + CO32- → H2O +CO2↑
OH-+Mg2+→Mg(OH)2↓白
OH-+Cu2+ → Cu(OH)2↓蓝
OH-+Fe3+ → Fe(OH)3↓红褐
OH-+Fe2+ → Fe(OH)2↓白
OH-+Al3+ → Al(OH)3↓白
OH-+ NH4+ = NH3↑+H2O
Ba2+ +SO42- =BaSO4↓白
Ag+ + Cl- = AgCl↓白
Ba2++CO32- =BaCO3↓白
Ca2++CO32- =CaCO3↓白
能
溶
于
酸
不溶于酸
能溶于酸
H++HCO3- → H2O + CO2↑
酸 H+
碱OH-
盐
盐、碱的溶解性规律(P114)
K+、Na+、NH4+、NO3-都易溶;
氯化物中Ag+不溶;
硫酸盐中Ba2+不溶;
碳酸盐只溶K+、Na+、NH4+;
Mg2+、Al3+、Fe2+/3+、Cu2+碱不溶
二、不共存(能反应)离子对
应用一、判断复分解反应能否发生
(1)Cu(OH)2 + HCl _____________________
(2)Ba(OH)2 + NaCl_____________________
(3)NaNO3 + BaCO3_____________________
(4)NaCl + H2SO4_______________________
2 = CuCl2 + 2H2O
→ BaCl2 + NaOH
→ Na2CO3 + Ba(NO3)2
→ Na2SO4 + HCl
×
×
×
二、不共存(能反应)离子对
1.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cu2+、SO42- B.Na+、CO32-、NO3-、Cl-
C.K+、Cu2+、SO42-、HCO3- D.H+、Na+、Cl-、SO42-
2.在pH=4的溶液中能大量共存的是( )
A.Na2SO4 、Ba(OH)2、HCl B.CuSO4、H2SO4、HNO3
C.FeCl3、NaOH、Ca(OH)2 D.K2SO4 、Na2CO3、NaCl
B
B
二、不共存(能反应)离子对
应用二、离子共存问题
注意附加隐含条件:
⑴溶液无色透明,则一定不含有色离子:
Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄)、MnO4 +(紫)
⑵酸性溶液、pH<7:存在H+;
碱性溶液、pH>7:存在OH-
物质
纯净物
单质
金属
非金属
化合物
氧化物
酸
碱
盐
混合物
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
初中化学物质的分类
阅读P77资料卡片“石笋和钟乳石的形成”,回答以下问题:
1.钟乳石的“生长”属于_____(化学/物理)变化;
2.发生反应的化学方程式:
(1)_____________________________
(2)_____________________________
化学
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ca(HCO3)2 =CaCO3↓ + H2O + CO2↑
指示剂
盐
金属氧化物
H+ + OH- = H2O
中和反应
盐
碱
非金属氧化物
金属
544
酸、碱盐的化学性质
酸
九年级化学下册同步(人教版)
第十一单元 盐 化肥 Salt Chemical fertilizer
课题1 生活中常见的盐
第一课时 盐的性质和用途
- Learning objectives -
第
1
课
时
1.
了解常见的盐的性质和用途
2.
知道复分解反应的特征
小苏打
碳酸钙
本课件内嵌3个视频,即点即播,使用方便(此页可删除)。
Video1:粗盐中难溶性杂质的去除
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:碳酸钠、碳酸氢钠和稀盐酸的反应
Video3:碳酸钠与氢氧化钙的反应
生活中的盐是指食盐,主要成分是NaCl。而化学中的盐,不仅仅是指食盐,而是指一类组成里含有 和 的化合物。
金属离子
酸根离子
小苏打
碳酸钙
NaCl
Na2CO3
KMnO4
NaHCO3
CaCO3
CuSO4
FeSO4
BaSO4
一、氯化钠(NaCl)
1.食盐主要成分________
2.工业用盐含有________而有毒。
物理性质 _____色固体,有_____味,_____溶于水
用途 1.调味品,腌制食品
2.维持生理活动,配制生理盐水(0.9%)
3.融雪剂(降低雪的熔点)
4.农业选种(密度)、工业原料
制法 1.开采盐矿
2.海水晒盐,盐井、盐湖煮盐
白
咸
易
NaNO2
NaCl
视频:粗盐中难溶性杂质的去除
1.目的:除去粗盐中的________杂质
2.步骤:
3.玻璃棒的作用:
①溶解 →②过滤→ ③蒸发→ ④计算产率
不溶性
溶解
过滤
蒸发
计算产率
搅拌,加速溶解
引流
搅拌,防止因局部温度过高,造成液滴飞溅
转移固体
实验:粗盐中难溶性杂质的去除
1.蒸发时__________________________时停止加热。
目的:防止_____飞溅
2.停止加热后,用 取下蒸发皿,放在石棉网上
3.产率偏低的原因:
(1)粗盐未完全溶解
(2)溶解或蒸发时液滴飞溅;
(3)蒸发时晶体飞溅。
坩埚钳
待蒸发皿中出现较多固体时
晶体
二、碳酸钠、碳酸氢钠和碳酸钙
1.碱性溶液不一定是碱的溶液。如_________溶液。
2.酸性溶液不一定是酸的溶液。如_________溶液。
易错辨析
物质 俗名 用途
碳酸钠 Na2CO3 白色固体,易溶于水
碳酸氢钠 NaHCO3 白色固体,易溶于水
碳酸钙 CaCO3 白色固体,难溶于水 石灰石、大理石 的主要成分
纯碱、苏打
小苏打
玻璃、造纸、纺织、洗涤剂
发酵粉、治疗胃酸过多
建筑材料、补钙剂
实验室制取CO2
1.俗名和用途
Na2CO3
NH4Cl
碳酸钠——纯碱是盐不是碱,溶液呈碱性
1.小苏打(碳酸氢钠)受热易分解,可做发酵粉:
返回
2NaHCO3 Na2CO3+CO2↑+H2O
2.治疗胃酸过多
NaHCO3+HCl=NaCl+CO2↑+H2O
阅读教材P76“资料卡片”回答问题
1.我国化学家侯德榜用“联合制碱法”所制得的纯碱是_______。
A.碳酸钠 B.氢氧化钠
碳酸钠
侯德榜
Na2CO3、NaHCO3和CaCO3在组成上相似,都属于碳酸盐。它们是否也有类似的性质呢?
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
二、碳酸钠、碳酸氢钠和碳酸钙
CaCO3+ HCl=
回顾:实验室制取CO2的化学方程式:
2 CaCl2+ H2CO3
2.化学性质
视频:碳酸钠、碳酸氢钠和稀盐酸的反应
碳酸钠+盐酸 碳酸氢钠+盐酸
现象 产生大量_______,澄清石灰水__________ 分析 碳酸钠/碳酸氢钠与盐酸反应生成了_______气体 气泡
2 =2NaCl+CO2↑+H2O
治疗胃酸过多
变浑浊
CO2
=NaCl+CO2↑+H2O
2.盐的化学性质
(1):碳酸盐 + 酸 = 新盐+H2O+CO2↑
Na2CO3+ HCl
NaHCO3+HCl
CaCO3+2HCl= CaCl2+ CO2 ↑ +H2O
碳酸盐(CO32- 、HCO3-)的检验方法
操 作 现 象 结 论
①取少量样品向其 中加入_______ 有_______产生
②将产生的气体 通入澄清石灰水 石灰水_________ 稀盐酸
该样品是碳酸盐
(溶液中存在CO32- 、HCO3-)
变浑浊
气泡
逻辑推理:活泼金属与酸反应有气体产生,则与酸反应产生气体的一定是活泼金属( )
视频:碳酸钠与氢氧化钙的反应
现 象 溶液中出现____色沉淀
分 析 二者反应生成一种____溶于水的物质
难
白
Na2CO3+Ca(OH)2=CaCO3↓ +2NaOH
纯碱制烧碱
2.盐的化学性质(2):盐+ 碱= 新盐 + 新碱
Fe + CuSO4 = FeSO4 + Cu
Cu+2AgNO3 = Cu(NO3)2 +2Ag
二、碳酸钠、碳酸氢钠和碳酸钙
盐的化学性质(3):盐+ 金属= 新盐 + 新金属
1.由两种化合物互相__________,生成另外两种化合物的反应。
2.表达式:AB + CD =___________
3.特征:_______________
Na2CO3 + 2HCl= 2NaCl+ H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
AD + CB
两交换,价不变
交换成分
H2CO3
三、复分解反应(基本反应类型)
CaCO3 + 2HCl =CaCl2 + H2O + CO2 ↑
四种基本反应类型中
一定有化合价变化的反应类型是 ;
一定没有化合价变化的反应类型是 。
置换反应
复分解反应
复分解反应
1.酸+碱→盐+水(中和反应)
2.酸+金属氧化物→盐+水
3.碱+盐→新碱+新盐
4.盐+盐→新盐+新盐
5.酸+盐→新盐+新酸
NaOH + HCl =H2O + NaCl
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CaCO3 + 2HCl =CaCl2 + H2O + CO2 ↑
碱+非金属氧化物→盐+水
不属于复分解反应
Ca(OH)2+CO2=CaCO3↓+H2O
一、常见的盐
1.Na2CO3俗称______、______。溶液呈____性。
用途:____________________________。
2.NaHCO3俗称________。用途:______________________。
3.CaCO3是________、__________的主要成分。
用途:___________________________________。
二、盐的化学性质
1.盐+酸=新盐+新酸 碳酸盐+酸=新盐+CO2+H2O
2.盐+碱=新盐+新碱
3.盐+金属=新盐+新金属
Na2CO3+2HCl=2NaCl+ CO2↑+H2O
NaHCO3+HCl=NaCl+ CO2↑+H2O
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Fe+CuSO4 = FeSO4 +Cu
CaCO3+2HCl=CaCl2+ CO2↑ +H2O
纯碱
小苏打
玻璃、造纸、纺织、洗涤剂
发酵粉、治疗胃酸过多
建筑材料、补钙剂、实验室制取CO2
苏打
碱
石灰石
大理石
1.由两种化合物互相__________,生成另外两种化合物的反应。
2.表达式:AB + CD =___________
3.特征:_______________
AD + CB
两交换,价不变
交换成分
三、复分解反应
1.下列属于复分解反应的是( )
A.2NaOH+CO2=Na2CO3+H2O
B.Zn+H2SO4=ZnSO4+H2↑
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O
D.CaCO3 CaO+CO2↑
C
- Learning objectives -
第
2
课
时
1.
了解复分解反应发生的条件
2.
能够利用离子对解决一些问题
=
+
+
本课件内嵌2个视频,即点即播,使用方便(此页可删除)。
Video1:氢氧化钠、氯化钡与硫酸铜溶液的反应
说明:本课件使用WPS制作,使用WPS体验更佳效果。
Video2:某些酸、碱、盐之间能否发生反应
视频:氢氧化钠、氯化钡与硫酸铜溶液的反应
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象 产生____色沉淀 产生____色沉淀
方程式
探究复分解反应发生的条件
蓝
白
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=BaSO4↓+CuCl2
盐的化学性质(4):盐 + 盐 →新盐1 + 新盐2
视频:某些酸、碱、盐之间能否发生反应
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+BaCl2=BaSO4↓+CuCl2
HCl + NaOH =NaCl + H2O
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3+Ca(OH)2=CaCO3↓ +2NaOH
复分解反应发生的条件:生成______、______或____至少一种。
沉淀
气体
水
一、复分解反应发生的条件
某些酸、碱、盐之间能否发生反应
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
能
不能
能
能
生成水
不符合复分解反应发生条件
生成沉淀
生成气体和水
(2)实际参加反应的离子是__________________。
1.(2019.河南)如图是氢氧化钠与盐酸反应示意图。
Na+、Cl-
H++OH-=H2O
(1)反应前后没有发生变化的离子是__________。
反应方程式 反应实质
1 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
2 CuSO4+BaCl2=BaSO4↓+CuCl2
3 HCl + NaOH =NaCl + H2O
4 2NaOH + H2SO4=Na2SO4 + 2H2O 5 CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
6 NaHCO3 + HCl = NaCl + H2O + CO2↑
用离子方程式表示下列反应的实质
H+ + OH-= H2O
Cu2+ + 2OH- =Cu(OH)2↓
Ba2+ + SO42- =BaSO4↓
2H+ + CO32- = CO2↑+H2O
复分解反应发生的条件就是至少有一对离子能反应生成沉淀/气体/水。
2H++ HCO3- = CO2↑+H2O
H+ + OH- → H2O
H+ + CO32- → H2O +CO2↑
OH-+Mg2+→Mg(OH)2↓白
OH-+Cu2+ → Cu(OH)2↓蓝
OH-+Fe3+ → Fe(OH)3↓红褐
OH-+Fe2+ → Fe(OH)2↓白
OH-+Al3+ → Al(OH)3↓白
OH-+ NH4+ = NH3↑+H2O
Ba2+ +SO42- =BaSO4↓白
Ag+ + Cl- = AgCl↓白
Ba2++CO32- =BaCO3↓白
Ca2++CO32- =CaCO3↓白
能
溶
于
酸
不溶于酸
能溶于酸
H++HCO3- → H2O + CO2↑
酸 H+
碱OH-
盐
盐、碱的溶解性规律(P114)
K+、Na+、NH4+、NO3-都易溶;
氯化物中Ag+不溶;
硫酸盐中Ba2+不溶;
碳酸盐只溶K+、Na+、NH4+;
Mg2+、Al3+、Fe2+/3+、Cu2+碱不溶
二、不共存(能反应)离子对
应用一、判断复分解反应能否发生
(1)Cu(OH)2 + HCl _____________________
(2)Ba(OH)2 + NaCl_____________________
(3)NaNO3 + BaCO3_____________________
(4)NaCl + H2SO4_______________________
2 = CuCl2 + 2H2O
→ BaCl2 + NaOH
→ Na2CO3 + Ba(NO3)2
→ Na2SO4 + HCl
×
×
×
二、不共存(能反应)离子对
1.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cu2+、SO42- B.Na+、CO32-、NO3-、Cl-
C.K+、Cu2+、SO42-、HCO3- D.H+、Na+、Cl-、SO42-
2.在pH=4的溶液中能大量共存的是( )
A.Na2SO4 、Ba(OH)2、HCl B.CuSO4、H2SO4、HNO3
C.FeCl3、NaOH、Ca(OH)2 D.K2SO4 、Na2CO3、NaCl
B
B
二、不共存(能反应)离子对
应用二、离子共存问题
注意附加隐含条件:
⑴溶液无色透明,则一定不含有色离子:
Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄)、MnO4 +(紫)
⑵酸性溶液、pH<7:存在H+;
碱性溶液、pH>7:存在OH-
物质
纯净物
单质
金属
非金属
化合物
氧化物
酸
碱
盐
混合物
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
初中化学物质的分类
阅读P77资料卡片“石笋和钟乳石的形成”,回答以下问题:
1.钟乳石的“生长”属于_____(化学/物理)变化;
2.发生反应的化学方程式:
(1)_____________________________
(2)_____________________________
化学
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ca(HCO3)2 =CaCO3↓ + H2O + CO2↑
指示剂
盐
金属氧化物
H+ + OH- = H2O
中和反应
盐
碱
非金属氧化物
金属
544
酸、碱盐的化学性质
酸
同课章节目录
