第九单元课题2课时 饱和溶液与不饱和溶液(优质课件23页)-九年级化学下册同步高效课堂优质课件+限时训练(人教版)
文档属性
| 名称 | 第九单元课题2课时 饱和溶液与不饱和溶液(优质课件23页)-九年级化学下册同步高效课堂优质课件+限时训练(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 23:40:00 | ||
图片预览





文档简介
(共23张PPT)
第九单元 课题2 溶解度
课时1 饱和溶液与不饱和溶液
情景导入
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道这是为什么吗?
学习目标
1.了解饱和溶液与不饱和溶液的含义和转化关系;
2.知道饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系;
3.了解结晶的方法。
授课
一、饱和溶液与不饱和溶液
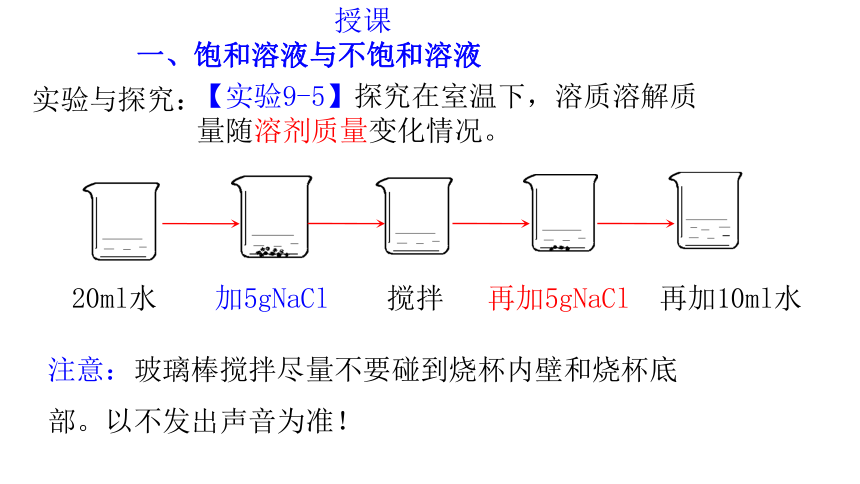
实验与探究:
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
20ml水 加5gNaCl 搅拌 再加5gNaCl 再加10ml水
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
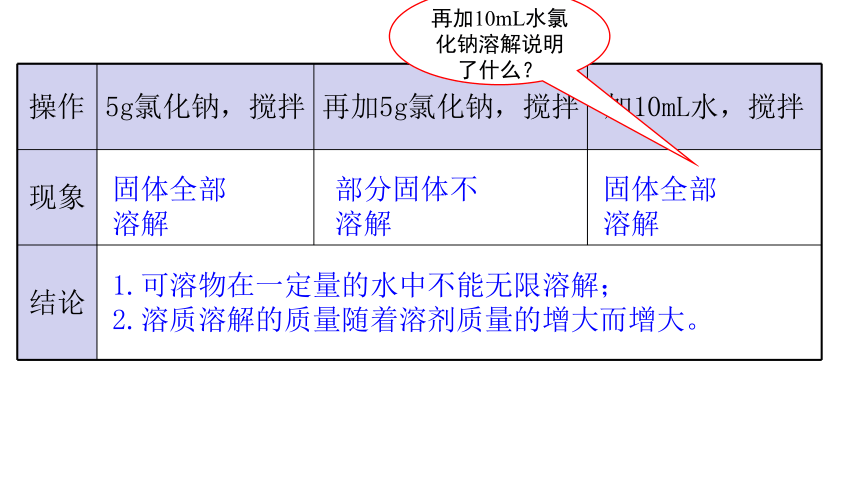
操作 5g氯化钠,搅拌 再加5g氯化钠,搅拌 加10mL水,搅拌
现象
结论 固体全部溶解
部分固体不溶解
固体全部溶解
1.可溶物在一定量的水中不能无限溶解;
2.溶质溶解的质量随着溶剂质量的增大而增大。
再加10mL水氯化钠溶解说明了什么?
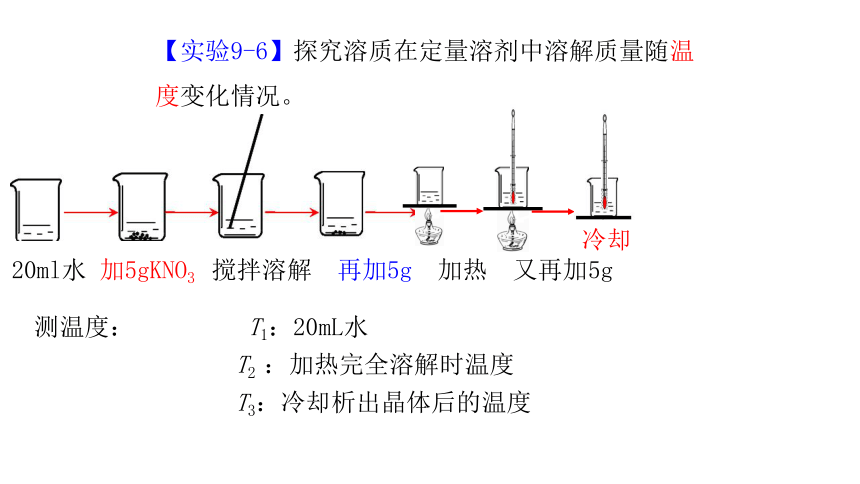
【实验9-6】探究溶质在定量溶剂中溶解质量随温度变化情况。
冷却
20ml水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g
测温度: T1:20mL水
T2 :加热完全溶解时温度
T3:冷却析出晶体后的温度
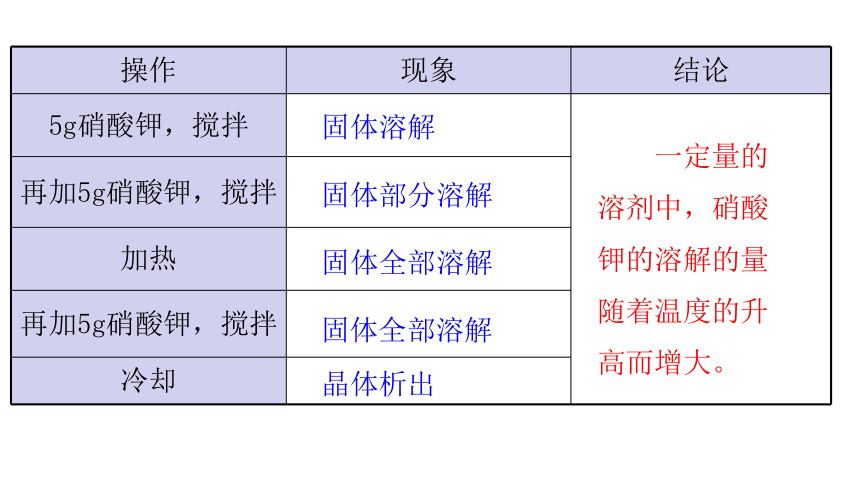
操作 现象 结论
5g硝酸钾,搅拌
再加5g硝酸钾,搅拌 加热 再加5g硝酸钾,搅拌 冷却 固体溶解
固体部分溶解
固体全部溶解
固体全部溶解
晶体析出
一定量的溶剂中,硝酸钾的溶解的量随着温度的升高而增大。
归纳与小结:
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2)不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
(3)判断某溶液是否饱和的方法是 __________________________________________。
再加入少量该溶质,搅拌,观察是否溶解
实验与探究:
是不是饱和溶液是不能再溶解任何物质?
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
加入少量
高锰酸钾
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液可以继续溶解硝酸钾。同理高锰酸钾也能溶于饱和硝酸钾溶液。
交流与讨论:
1.向饱和的硝酸钾溶液中加入硝酸钾固体,质量不变的是什么?
质量不变的是溶质、溶剂和溶液。
2.有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入硝酸钾、蒸发掉一些水、降低温度
加入溶质、蒸发溶剂、改变温度
3.将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
二、饱和溶液与不饱和溶液转化
归纳与小结:
2.饱和溶液和不饱和溶液之间的转化
不饱和溶液 饱和溶液
加入溶质、蒸发溶剂、改变温度
加溶剂、改变温度
蒸发
溶剂
冷却
结晶
注:以上为通常情况,不适合所有的物质。(1)对极少数在水中溶解能力随温度升高而减弱的物质[如Ca(OH)2],上述过程中温度的改变相反。
(2)若要获得晶体,先将不饱和溶液蒸发浓缩,得到饱和溶液,再进行冷却或蒸发得到晶体。
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
3.晶体的获得
(1)蒸发溶剂
(适用于溶解能力受温度影响较小的物质)
(2)降温结晶
(适用于溶解能力随温度的下降明显下降的物质)
4.海水晒盐的过程
海水晒盐过程中,使食盐晶体析出的方法叫____________。
蒸发结晶
海水
贮水池
蒸发池
结晶池
粗盐
提纯
氯化钠
母液
过 滤
氯化钠的饱和溶液
多种化工产品
三、饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
2克食盐
食盐溶解
食盐的不饱和溶液
浓度大
10毫升水
10毫升水
0.2克熟石灰
熟石灰不完全溶解
熟石灰的饱和溶液
浓度小
1.对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
2.对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
溶液在一定条件下可分为饱和溶液和不饱和溶液
浓溶液
稀溶液
饱和溶液
不饱和溶液
不给定条件可分为浓溶液和稀溶液。
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)蒸发溶剂结晶。(2)冷却热饱和溶液结晶。
课堂小结:
①加水②升温
饱和溶液 不饱和溶液
①加溶质②降温③蒸发溶剂
课堂检测
1.某温度下,将10 g氯化钠加入20 g水中,充分溶解后得到27.6 g氯化钠溶液,该溶液一定是( )
A.饱和溶液 B.不饱和溶液
C.稀溶液 D.无法判断
2.向一定量水中,逐渐加入KNO3固体,下列图象中符合溶液中溶质质量变化规律的是( )
A
A
3.t ℃时,欲使一接近饱和的溶液变为饱和溶液,分别采取下列措施,其中一定能达到目的的是( )
①降低温度 ②升高温度 ③加水 ④加入足量该溶质
A.① B.④ C.①③ D.②④
4.将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是( )
A.降温过程中硝酸钾逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,硝酸钾析出
C.硝酸钾以晶体的形式析出的过程叫结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
B
D
5.下列关于饱和溶液与不饱和溶液的叙述中,正确的是( )
A.稀溶液一定是不饱和溶液
B.浓溶液一定是饱和溶液
C.在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓
D.浓溶液不一定是饱和溶液,稀溶液一定是不饱和溶液
6.20 ℃时,分别将100 g和50 g的硝酸钾饱和溶液加热蒸发掉20 g水后,冷却到原来的温度,各析出了晶体a g和b g,则a和b的关系是( )
A.a=b B.a<b C.2a=b D.2b=a
C
A
直击中考
1.(2022揭阳一模)小明用50 ℃的水泡了一杯蔗糖水,充分搅拌后,发现杯子底部还有部分蔗糖不能溶解。已知蔗糖的溶解度随温度的升高而增大。下列能使杯底的蔗糖继续溶解的方法是( )
A.把蔗糖水放入冰箱 B.给蔗糖水加热
C.往蔗糖水里继续加蔗糖 D.把蔗糖水放在通风处
2.(2022辽宁营口)下列有关溶液的说法,正确的是( )
A. 溶质一定为固体
B. 饱和溶液不能再溶解任何物质
C. 溶液是均一、稳定的混合物
D. 稀溶液一定是不饱和溶液
B
C
3.(2022北京模拟)向一瓶接近饱和的硝酸钾溶液中逐渐加入硝酸钾晶体,下列图象中符合溶液中溶质的质量变化规律的是( )
4.(2020·北京延庆·初三一模)能将不饱和NaCl溶液变为饱和NaCl溶液的方法是( )
A.加水 B.升高温度 C.加入NaCl D.倒出部分溶液
D
C
D
5.(2022·山东济宁·中考真题)利用20℃时KNO3溶液(有少量未溶解的KNO3晶体)见图Ⅰ,进行下面实验:①加入NH4NO3固体后,实验结果见图Ⅱ;②加入NaOH固体后,实验结果见图Ⅲ。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
6. (2022 济宁)利用20℃时KNO3溶液(有少量未溶解的KNO3晶体)见图1,进行下列实验:①加入NH4NO3固体后,实验结果见图2;②加入NaOH固体后,实验结果见图3。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,
吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图1、图2中,硝酸钾溶液都是饱和溶液
D.图3中,硝酸钾溶液一定是不饱和溶液
D
第九单元 课题2 溶解度
课时1 饱和溶液与不饱和溶液
情景导入
我国北方有许多盐碱湖,湖水中溶有大量的食盐(NaCl)和纯碱(Na2CO3),那里的农民冬天捞碱,夏天晒盐,你知道这是为什么吗?
学习目标
1.了解饱和溶液与不饱和溶液的含义和转化关系;
2.知道饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系;
3.了解结晶的方法。
授课
一、饱和溶液与不饱和溶液
实验与探究:
【实验9-5】探究在室温下,溶质溶解质量随溶剂质量变化情况。
20ml水 加5gNaCl 搅拌 再加5gNaCl 再加10ml水
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
操作 5g氯化钠,搅拌 再加5g氯化钠,搅拌 加10mL水,搅拌
现象
结论 固体全部溶解
部分固体不溶解
固体全部溶解
1.可溶物在一定量的水中不能无限溶解;
2.溶质溶解的质量随着溶剂质量的增大而增大。
再加10mL水氯化钠溶解说明了什么?
【实验9-6】探究溶质在定量溶剂中溶解质量随温度变化情况。
冷却
20ml水 加5gKNO3 搅拌溶解 再加5g 加热 又再加5g
测温度: T1:20mL水
T2 :加热完全溶解时温度
T3:冷却析出晶体后的温度
操作 现象 结论
5g硝酸钾,搅拌
再加5g硝酸钾,搅拌 加热 再加5g硝酸钾,搅拌 冷却 固体溶解
固体部分溶解
固体全部溶解
固体全部溶解
晶体析出
一定量的溶剂中,硝酸钾的溶解的量随着温度的升高而增大。
归纳与小结:
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2)不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
(3)判断某溶液是否饱和的方法是 __________________________________________。
再加入少量该溶质,搅拌,观察是否溶解
实验与探究:
是不是饱和溶液是不能再溶解任何物质?
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
加入少量
高锰酸钾
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液可以继续溶解硝酸钾。同理高锰酸钾也能溶于饱和硝酸钾溶液。
交流与讨论:
1.向饱和的硝酸钾溶液中加入硝酸钾固体,质量不变的是什么?
质量不变的是溶质、溶剂和溶液。
2.有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入硝酸钾、蒸发掉一些水、降低温度
加入溶质、蒸发溶剂、改变温度
3.将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
二、饱和溶液与不饱和溶液转化
归纳与小结:
2.饱和溶液和不饱和溶液之间的转化
不饱和溶液 饱和溶液
加入溶质、蒸发溶剂、改变温度
加溶剂、改变温度
蒸发
溶剂
冷却
结晶
注:以上为通常情况,不适合所有的物质。(1)对极少数在水中溶解能力随温度升高而减弱的物质[如Ca(OH)2],上述过程中温度的改变相反。
(2)若要获得晶体,先将不饱和溶液蒸发浓缩,得到饱和溶液,再进行冷却或蒸发得到晶体。
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
3.晶体的获得
(1)蒸发溶剂
(适用于溶解能力受温度影响较小的物质)
(2)降温结晶
(适用于溶解能力随温度的下降明显下降的物质)
4.海水晒盐的过程
海水晒盐过程中,使食盐晶体析出的方法叫____________。
蒸发结晶
海水
贮水池
蒸发池
结晶池
粗盐
提纯
氯化钠
母液
过 滤
氯化钠的饱和溶液
多种化工产品
三、饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
2克食盐
食盐溶解
食盐的不饱和溶液
浓度大
10毫升水
10毫升水
0.2克熟石灰
熟石灰不完全溶解
熟石灰的饱和溶液
浓度小
1.对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
2.对于同种溶质来说:在一定温度时饱和溶液比不饱和溶液要浓。
溶液在一定条件下可分为饱和溶液和不饱和溶液
浓溶液
稀溶液
饱和溶液
不饱和溶液
不给定条件可分为浓溶液和稀溶液。
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)蒸发溶剂结晶。(2)冷却热饱和溶液结晶。
课堂小结:
①加水②升温
饱和溶液 不饱和溶液
①加溶质②降温③蒸发溶剂
课堂检测
1.某温度下,将10 g氯化钠加入20 g水中,充分溶解后得到27.6 g氯化钠溶液,该溶液一定是( )
A.饱和溶液 B.不饱和溶液
C.稀溶液 D.无法判断
2.向一定量水中,逐渐加入KNO3固体,下列图象中符合溶液中溶质质量变化规律的是( )
A
A
3.t ℃时,欲使一接近饱和的溶液变为饱和溶液,分别采取下列措施,其中一定能达到目的的是( )
①降低温度 ②升高温度 ③加水 ④加入足量该溶质
A.① B.④ C.①③ D.②④
4.将热的硝酸钾不饱和溶液降温至如图所示的状态。对该过程的描述错误的是( )
A.降温过程中硝酸钾逐渐达到饱和状态
B.饱和的硝酸钾溶液继续降温,硝酸钾析出
C.硝酸钾以晶体的形式析出的过程叫结晶
D.析出晶体后的硝酸钾溶液是不饱和溶液
B
D
5.下列关于饱和溶液与不饱和溶液的叙述中,正确的是( )
A.稀溶液一定是不饱和溶液
B.浓溶液一定是饱和溶液
C.在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓
D.浓溶液不一定是饱和溶液,稀溶液一定是不饱和溶液
6.20 ℃时,分别将100 g和50 g的硝酸钾饱和溶液加热蒸发掉20 g水后,冷却到原来的温度,各析出了晶体a g和b g,则a和b的关系是( )
A.a=b B.a<b C.2a=b D.2b=a
C
A
直击中考
1.(2022揭阳一模)小明用50 ℃的水泡了一杯蔗糖水,充分搅拌后,发现杯子底部还有部分蔗糖不能溶解。已知蔗糖的溶解度随温度的升高而增大。下列能使杯底的蔗糖继续溶解的方法是( )
A.把蔗糖水放入冰箱 B.给蔗糖水加热
C.往蔗糖水里继续加蔗糖 D.把蔗糖水放在通风处
2.(2022辽宁营口)下列有关溶液的说法,正确的是( )
A. 溶质一定为固体
B. 饱和溶液不能再溶解任何物质
C. 溶液是均一、稳定的混合物
D. 稀溶液一定是不饱和溶液
B
C
3.(2022北京模拟)向一瓶接近饱和的硝酸钾溶液中逐渐加入硝酸钾晶体,下列图象中符合溶液中溶质的质量变化规律的是( )
4.(2020·北京延庆·初三一模)能将不饱和NaCl溶液变为饱和NaCl溶液的方法是( )
A.加水 B.升高温度 C.加入NaCl D.倒出部分溶液
D
C
D
5.(2022·山东济宁·中考真题)利用20℃时KNO3溶液(有少量未溶解的KNO3晶体)见图Ⅰ,进行下面实验:①加入NH4NO3固体后,实验结果见图Ⅱ;②加入NaOH固体后,实验结果见图Ⅲ。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
6. (2022 济宁)利用20℃时KNO3溶液(有少量未溶解的KNO3晶体)见图1,进行下列实验:①加入NH4NO3固体后,实验结果见图2;②加入NaOH固体后,实验结果见图3。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,
吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图1、图2中,硝酸钾溶液都是饱和溶液
D.图3中,硝酸钾溶液一定是不饱和溶液
D
同课章节目录
