11.1生活中常见的盐(第4课时除杂和粗盐提纯)课件(共21张PPT)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 11.1生活中常见的盐(第4课时除杂和粗盐提纯)课件(共21张PPT)---2022-2023学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 308.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-04 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
第十一单元 盐 化肥
人教版九年级化学下册
课题1 生活中常见的盐(第4课时)
1.掌握除杂的原理和操作方法
2.了解粗盐提纯的具体操作方法。
学 习 目 标
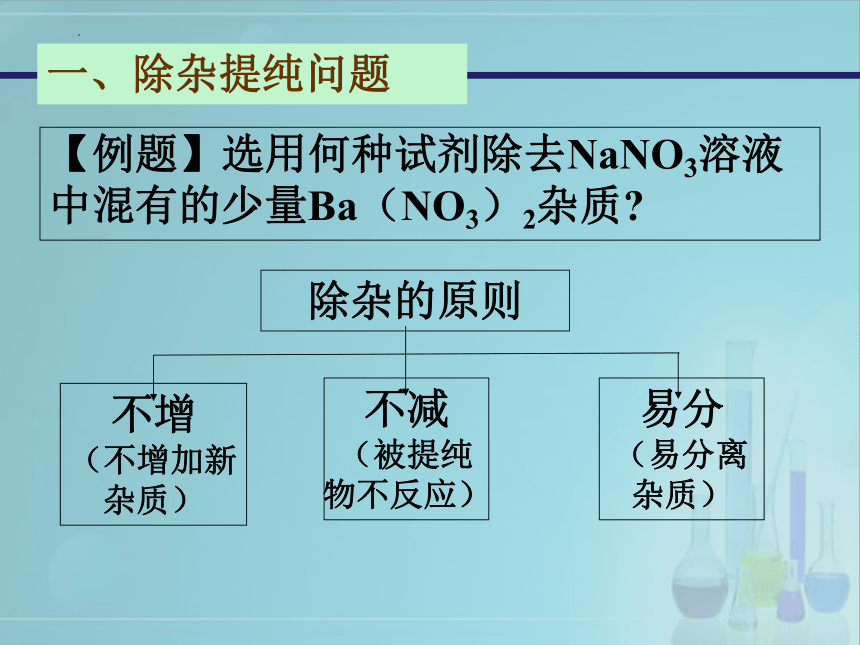
除杂的原则
不增
(不增加新杂质)
不减
(被提纯物不反应)
易分
(易分离杂质)
一、除杂提纯问题
【例题】选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
①A和C绝对不能发生反应。
如: Na2CO3 (Na2SO4),不可以用BaCl2除去,因为BaCl2与Na2CO3 会发生反应。
②B与C反应后不能出现新杂质D。
如: NaCl (Na2SO4),不可以用Ba(NO3)2除去,因为会产生NaNO3新杂质。
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
③A和C如果同状态,C不可以过量。
如: NaCl (Na2SO4),不可以用过量的BaCl2除去,因为剩余的BaCl2会成为新杂质。
但:CaCl2溶液 (HCl),可以用过量的CaCO3除去,因为剩余的CaCO3是固体,不会成为新杂质。
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
④注意处理方式的选择
KCl 和MnO2的混合固体
溶解
过滤
蒸发结晶
洗涤干燥
KCl 固体
MnO2固体
⑤任何气体的除杂,绝不能用“点燃”
【例题】选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质
碳酸钠或者硫酸钠。
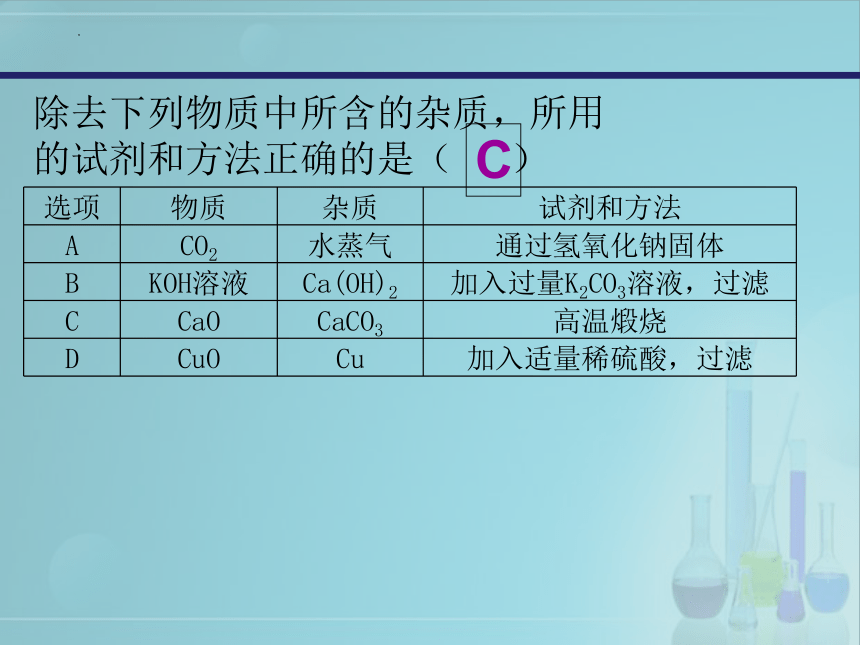
除去下列物质中所含的杂质,所用的试剂和方法正确的是( )
选项 物质 杂质 试剂和方法
A CO2 水蒸气 通过氢氧化钠固体
B KOH溶液 Ca(OH)2 加入过量K2CO3溶液,过滤
C CaO CaCO3 高温煅烧
D CuO Cu 加入适量稀硫酸,过滤
C
除去下列物质中少量杂质所选试剂和操作方法都正确的是( )
选 项 物 质 杂 质 所用试剂 操 作 方 法
A H2SO4溶液 HCl溶液 适量AgNO3溶液 过滤
B CO O2 CuO粉末 加热
C Ag粉 Cu粉 过量AgNO3溶液 过滤 、洗涤、干燥
D NH3 水蒸气 浓硫酸 干燥
D
D
下列实验操作中(括号内为待检验物质或杂质),不能达到实验目的的是( )
选项 物质 目的 主要实验操作
A CO和CO2 区分 将气体分别通入澄清石灰水中,观察现象
B MnO2和KCl 分离 溶解、过滤、洗涤固体并烘干;蒸发滤液
C O2(H2O) 检验 通入无水硫酸铜,观察现象
D HCl(H2SO4) 除杂 加入过量的BaCl2溶液,过滤
A
下列除去杂质的方法中正确的是( )
选项 物质 杂质 除杂质的方法
A KCl MnO2 加适量水溶解、过滤、蒸发
B CO2 CO 将气体通入足量氢氧化钠溶液
C 银粉 锌粉 加入过量硫酸亚铁溶液,过滤
D NaCl溶液 Na2CO3 加适量硝酸钙溶液,过滤
BaCl2
Ba2+
Mg2+ Ca2+ SO42-
Mg(OH)2↓
BaSO4↓
CaCO3↓
NaOH
Na2CO3
OH-
CO32-
NaCl
( MgCl2、CaCl2、Na2SO4 )
NaCl
NaCl溶液(MgCl2、CaCl2、Na2SO4)
初步提纯后的粗盐中,仍然存在一些可溶性杂质
(MgCl2、CaCl2、Na2SO4),如何除去杂质?
二、粗盐提纯问题
除杂步骤:
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、除去MgCl2(加过量的氢氧化钠)
方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
2、除去CaCl2(加过量的碳酸钠)
方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl
3、除去Na2SO4(加过量的氯化钡)
方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
过量的氯化钡怎么办?
除杂步骤:
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、除去MgCl2(加过量的氢氧化钠)
方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
3、除去CaCl2和BaCl2(加过量的碳酸钠)
方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
2、除去Na2SO4(加过量的氯化钡)
方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
可以得到4种沉淀!
4、过滤
得到Mg(OH)2↓ BaSO4↓ CaCO3↓ BaCO3↓
6、蒸发结晶,得到纯净的NaCl固体
5、除去过量的氢氧化钠和碳酸钠(加过量的稀盐酸)
方程式:NaOH+HCl=H2O+NaCl
Na2CO3+2HCl=H2O+CO2↑+2NaCl
问题分析:
1.每次加入的样品“过量”的原因?
答:彻底除去某某杂质。
2.最后得到的氯化钠的质量与原先粗盐中的氯化钠质量相比,
多了还是少了?
答:多了,反应生成了新的氯化钠。
3.最后过量的稀盐酸会不会成为新的杂质?
答:不会,蒸发结晶过程中,稀盐酸中的HCl会挥发逸散。
问题分析:
4.加入碳酸钠和氯化钡的顺序谁前谁后,能否颠倒?
答:氯化钡在前,碳酸钠在后,不能颠倒。(若颠倒,
无法除去过量的氯化钡)
5.氢氧化钠的顺序能否改变?
答:可以,氢氧化钠放在一二三步都可以。
6.氢氧化钠和氯化钡可以用别的药品代替吗?
答:可以用氢氧化钡代替,直接除去MgCl2和Na2SO4
两种杂质。
NaOH
溶液
BaCl2溶液
Na2CO3
溶液
Na+
Cl-
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
BaSO4↓
Na+
Cl-
Mg2+
CO32-
BaSO4↓
CaCO3↓
BaCO3↓
Na+
Cl-
CO32-
OH-
BaSO4↓
CaCO3↓
BaCO3↓
Mg(OH) 2↓
稀盐酸
(调pH)
Na+
Cl-
过滤
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、在试管内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )
A.用足量一氧化碳还原氧化铁后留下的物质
B.用足量氢气还原氧化铜后留下的红色物质
C.盛放石灰水后留下的白色固体
D.硫酸铜溶液与氢氧化钠溶液反应后留下的蓝色固体
当堂检测:
B
2、欲除去氮气中混有的少量水蒸气、氧气、二氧化碳气
体,应将混合气体先后通过( )
A.浓硫酸、灼热铜网、足量氢氧化钠溶液
B.灼热铜网、浓硫酸、足量氢氧化钠溶液
C.浓硫酸、足量氢氧化钠溶液、灼热铜网
D.灼热铜网、足量氢氧化钠溶液、浓硫酸
D
3、实验室用石灰石和稀盐酸反应制备纯净、干燥的CO2,
除杂装置如下图所示,气体与导管口连接的正确顺序是
A.1→2→4→3 B.2→1→3→4
C.4→3→1→2 D.3→4→2→1
4
3
2
1
浓H2SO4
饱和NaHCO3
溶液
C
除杂原则:
先除水,再去杂
第十一单元 盐 化肥
人教版九年级化学下册
课题1 生活中常见的盐(第4课时)
1.掌握除杂的原理和操作方法
2.了解粗盐提纯的具体操作方法。
学 习 目 标
除杂的原则
不增
(不增加新杂质)
不减
(被提纯物不反应)
易分
(易分离杂质)
一、除杂提纯问题
【例题】选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
①A和C绝对不能发生反应。
如: Na2CO3 (Na2SO4),不可以用BaCl2除去,因为BaCl2与Na2CO3 会发生反应。
②B与C反应后不能出现新杂质D。
如: NaCl (Na2SO4),不可以用Ba(NO3)2除去,因为会产生NaNO3新杂质。
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
③A和C如果同状态,C不可以过量。
如: NaCl (Na2SO4),不可以用过量的BaCl2除去,因为剩余的BaCl2会成为新杂质。
但:CaCl2溶液 (HCl),可以用过量的CaCO3除去,因为剩余的CaCO3是固体,不会成为新杂质。
A中混有B物质,如果想用C物质除去,需要满足以下几点:
规律总结
④注意处理方式的选择
KCl 和MnO2的混合固体
溶解
过滤
蒸发结晶
洗涤干燥
KCl 固体
MnO2固体
⑤任何气体的除杂,绝不能用“点燃”
【例题】选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质
碳酸钠或者硫酸钠。
除去下列物质中所含的杂质,所用的试剂和方法正确的是( )
选项 物质 杂质 试剂和方法
A CO2 水蒸气 通过氢氧化钠固体
B KOH溶液 Ca(OH)2 加入过量K2CO3溶液,过滤
C CaO CaCO3 高温煅烧
D CuO Cu 加入适量稀硫酸,过滤
C
除去下列物质中少量杂质所选试剂和操作方法都正确的是( )
选 项 物 质 杂 质 所用试剂 操 作 方 法
A H2SO4溶液 HCl溶液 适量AgNO3溶液 过滤
B CO O2 CuO粉末 加热
C Ag粉 Cu粉 过量AgNO3溶液 过滤 、洗涤、干燥
D NH3 水蒸气 浓硫酸 干燥
D
D
下列实验操作中(括号内为待检验物质或杂质),不能达到实验目的的是( )
选项 物质 目的 主要实验操作
A CO和CO2 区分 将气体分别通入澄清石灰水中,观察现象
B MnO2和KCl 分离 溶解、过滤、洗涤固体并烘干;蒸发滤液
C O2(H2O) 检验 通入无水硫酸铜,观察现象
D HCl(H2SO4) 除杂 加入过量的BaCl2溶液,过滤
A
下列除去杂质的方法中正确的是( )
选项 物质 杂质 除杂质的方法
A KCl MnO2 加适量水溶解、过滤、蒸发
B CO2 CO 将气体通入足量氢氧化钠溶液
C 银粉 锌粉 加入过量硫酸亚铁溶液,过滤
D NaCl溶液 Na2CO3 加适量硝酸钙溶液,过滤
BaCl2
Ba2+
Mg2+ Ca2+ SO42-
Mg(OH)2↓
BaSO4↓
CaCO3↓
NaOH
Na2CO3
OH-
CO32-
NaCl
( MgCl2、CaCl2、Na2SO4 )
NaCl
NaCl溶液(MgCl2、CaCl2、Na2SO4)
初步提纯后的粗盐中,仍然存在一些可溶性杂质
(MgCl2、CaCl2、Na2SO4),如何除去杂质?
二、粗盐提纯问题
除杂步骤:
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、除去MgCl2(加过量的氢氧化钠)
方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
2、除去CaCl2(加过量的碳酸钠)
方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl
3、除去Na2SO4(加过量的氯化钡)
方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
过量的氯化钡怎么办?
除杂步骤:
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、除去MgCl2(加过量的氢氧化钠)
方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
3、除去CaCl2和BaCl2(加过量的碳酸钠)
方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
2、除去Na2SO4(加过量的氯化钡)
方程式:BaCl2+Na2SO4=BaSO4↓+2NaCl
可以得到4种沉淀!
4、过滤
得到Mg(OH)2↓ BaSO4↓ CaCO3↓ BaCO3↓
6、蒸发结晶,得到纯净的NaCl固体
5、除去过量的氢氧化钠和碳酸钠(加过量的稀盐酸)
方程式:NaOH+HCl=H2O+NaCl
Na2CO3+2HCl=H2O+CO2↑+2NaCl
问题分析:
1.每次加入的样品“过量”的原因?
答:彻底除去某某杂质。
2.最后得到的氯化钠的质量与原先粗盐中的氯化钠质量相比,
多了还是少了?
答:多了,反应生成了新的氯化钠。
3.最后过量的稀盐酸会不会成为新的杂质?
答:不会,蒸发结晶过程中,稀盐酸中的HCl会挥发逸散。
问题分析:
4.加入碳酸钠和氯化钡的顺序谁前谁后,能否颠倒?
答:氯化钡在前,碳酸钠在后,不能颠倒。(若颠倒,
无法除去过量的氯化钡)
5.氢氧化钠的顺序能否改变?
答:可以,氢氧化钠放在一二三步都可以。
6.氢氧化钠和氯化钡可以用别的药品代替吗?
答:可以用氢氧化钡代替,直接除去MgCl2和Na2SO4
两种杂质。
NaOH
溶液
BaCl2溶液
Na2CO3
溶液
Na+
Cl-
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
BaSO4↓
Na+
Cl-
Mg2+
CO32-
BaSO4↓
CaCO3↓
BaCO3↓
Na+
Cl-
CO32-
OH-
BaSO4↓
CaCO3↓
BaCO3↓
Mg(OH) 2↓
稀盐酸
(调pH)
Na+
Cl-
过滤
NaCl溶液(MgCl2、CaCl2、Na2SO4)
1、在试管内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )
A.用足量一氧化碳还原氧化铁后留下的物质
B.用足量氢气还原氧化铜后留下的红色物质
C.盛放石灰水后留下的白色固体
D.硫酸铜溶液与氢氧化钠溶液反应后留下的蓝色固体
当堂检测:
B
2、欲除去氮气中混有的少量水蒸气、氧气、二氧化碳气
体,应将混合气体先后通过( )
A.浓硫酸、灼热铜网、足量氢氧化钠溶液
B.灼热铜网、浓硫酸、足量氢氧化钠溶液
C.浓硫酸、足量氢氧化钠溶液、灼热铜网
D.灼热铜网、足量氢氧化钠溶液、浓硫酸
D
3、实验室用石灰石和稀盐酸反应制备纯净、干燥的CO2,
除杂装置如下图所示,气体与导管口连接的正确顺序是
A.1→2→4→3 B.2→1→3→4
C.4→3→1→2 D.3→4→2→1
4
3
2
1
浓H2SO4
饱和NaHCO3
溶液
C
除杂原则:
先除水,再去杂
同课章节目录
