2022-2023学年人教版九年级化学下册 8.3金属资源的利用和保护(第1课时)导学案(含答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 8.3金属资源的利用和保护(第1课时)导学案(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 191.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-05 14:35:08 | ||
图片预览

文档简介
8.3金属资源的利用和保护(第一课时)
【课时目标】
1.知道一些常见金属如铁、铝、铜等的矿物,了解从铁矿石中将铁还原出来的方法。
2.会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
3.关注与化学有关的社会问题,初步形成主动参与社会决策的意识。
重点:铁的冶炼。
难点:有关化学方程式计算中的杂质问题计算。
【学习活动】
任务一 金属资源的存在形式及常见的矿石
1.请帮小明同学完成下面表格及填空:
矿石名称 赤铁矿 磁铁矿 菱铁矿 铝土矿
主要成分
(1)目前,人类每年从大自然提取大量金属,其中提取量最大的是_________。
(2)表中矿石的主要成分不属于氧化物的是_________。
2.下列金属在自然界中有单质形式存在的是( )
A.Na B.Zn C.Al D. Au
3.现有赤铁矿(主要成分Fe2O3)、②磁铁矿(主要成分Fe3O4)、③黄铁矿(主要成分FeS2),请你从经济效益和环境保护的角度分析三种矿石中哪种最不适合用来炼铁(填写代号)_________,理由是_________。
【变式1】《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山,一些矿石的主要成分及颜色如下表。
矿石 蓝铜矿 孔雀石 雌黄 赭石
主要成分 Cu3(OH)2(CO3)2 Cu2(OH)2CO3 As2S3 Fe2O3
颜色 蓝色 绿色 黄色 红棕色
(1)四种矿石主要成分中,属于氧化物的是_________。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相点是_________。
任务二 铁的冶炼
4.工业炼铁的主要设备是_________,原料是_________、空气、石灰石等。工业炼铁中,焦炭的作用是_________,炼铁高炉内发生的主要化学变化有(用化学方程式表示):
①_________;
②_________;
③_________。
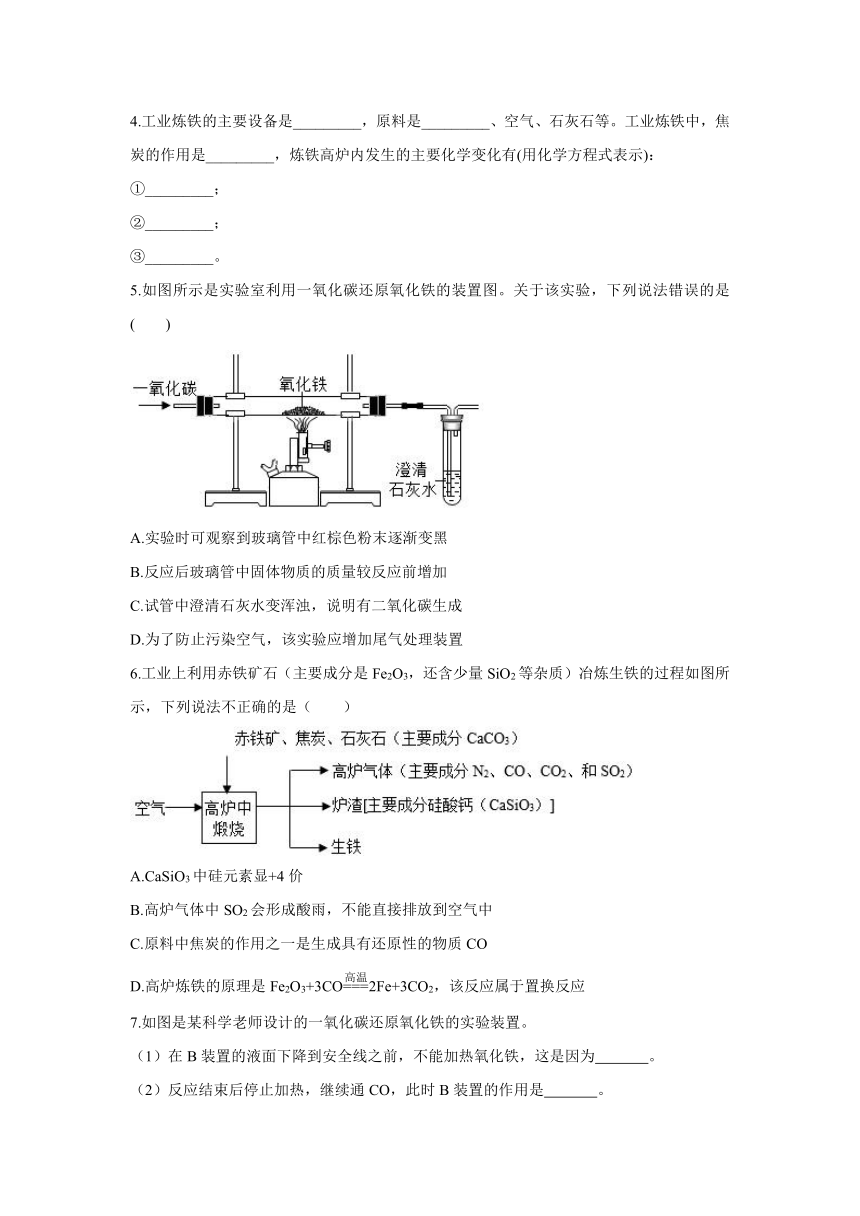
5.如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是( )
A.实验时可观察到玻璃管中红棕色粉末逐渐变黑
B.反应后玻璃管中固体物质的质量较反应前增加
C.试管中澄清石灰水变浑浊,说明有二氧化碳生成
D.为了防止污染空气,该实验应增加尾气处理装置
6.工业上利用赤铁矿石(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示,下列说法不正确的是( )
A.CaSiO3中硅元素显+4价
B.高炉气体中SO2会形成酸雨,不能直接排放到空气中
C.原料中焦炭的作用之一是生成具有还原性的物质CO
D.高炉炼铁的原理是Fe2O3+3CO2Fe+3CO2,该反应属于置换反应
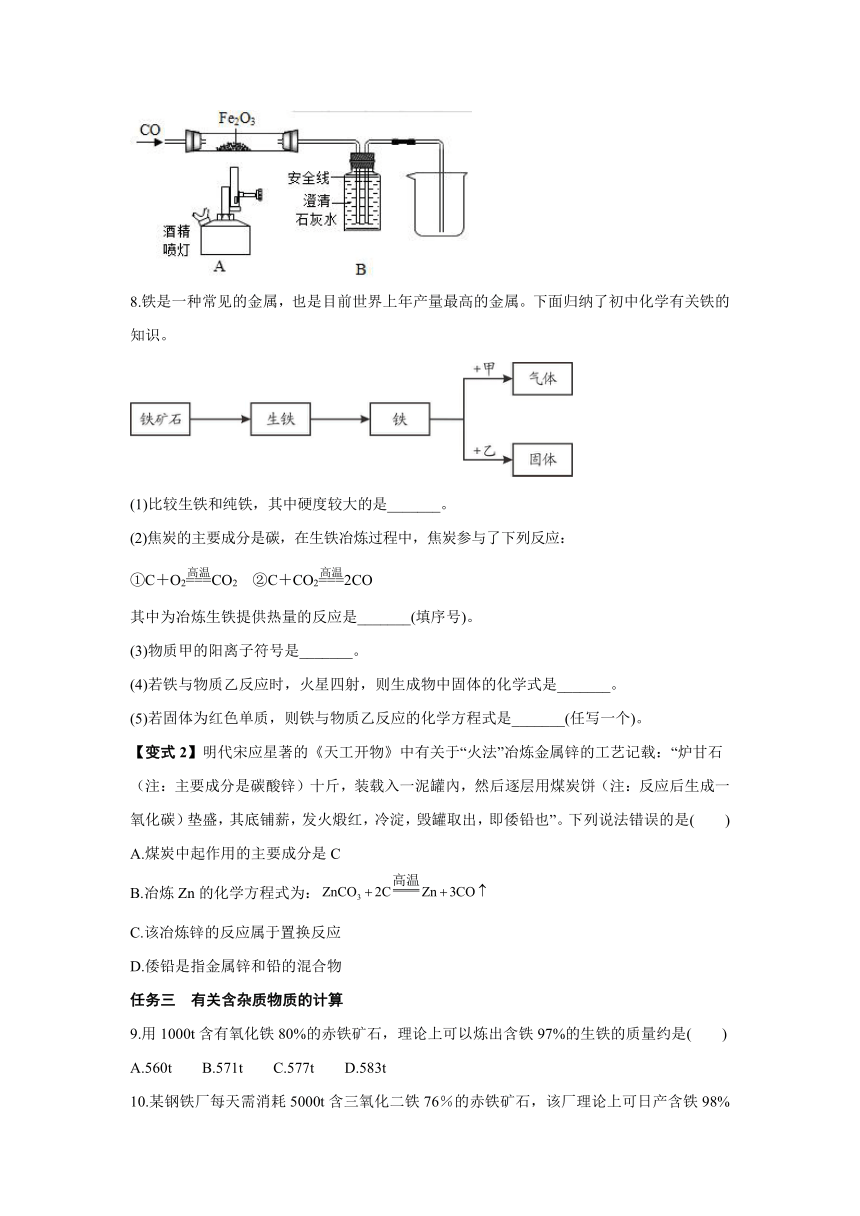
7.如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为 。
(2)反应结束后停止加热,继续通CO,此时B装置的作用是 。
8.铁是一种常见的金属,也是目前世界上年产量最高的金属。下面归纳了初中化学有关铁的知识。
(1)比较生铁和纯铁,其中硬度较大的是_______。
(2)焦炭的主要成分是碳,在生铁冶炼过程中,焦炭参与了下列反应:
①C+O2CO2 ②C+CO22CO
其中为冶炼生铁提供热量的反应是_______(填序号)。
(3)物质甲的阳离子符号是_______。
(4)若铁与物质乙反应时,火星四射,则生成物中固体的化学式是_______。
(5)若固体为红色单质,则铁与物质乙反应的化学方程式是_______(任写一个)。
【变式2】明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是( )
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
任务三 有关含杂质物质的计算
9.用1000t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是( )
A.560t B.571t C.577t D.583t
10.某钢铁厂每天需消耗5000t含三氧化二铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
11.改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿炼铁,若该厂日产含铁 1.4×104 t 的生铁,至少需要含 Fe2O3 80%的赤铁矿的质量是多少?(要求写出计算过程)
12.工业上冶炼1732t含铁97%的生铁,需要含杂质10%的磁铁矿石的质量是多少?(结果保留一位小数。)
【变式3】用足量的CO还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是( )
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
【课后作业】
1.用下列矿石炼金属时,排放的废气容易引起酸雨的是( )
A.辉铜矿(主要成分Cu2S) B.赤铁矿(主要成分Fe2O3)
C.磁铁矿(主要成分Fe3O4) D.铝土矿(主要成分Al2O3)
2.高炉炼铁的主反应为Fe2O3+3CO2Fe+3CO2。下列有关说法正确的是( )
A.该反应既是氧化还原反应又是置换反应
B.CO由焦炭和焦炭燃烧所得的CO2反应产生
C.所得产物为生铁,含碳量比钢低
D.高炉尾气对环境无影响,可直接排放
3.下列有关模拟工业炼铁的叙述不正确的是( )
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
4.已知:3CO+Fe2O3Fe+3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂 B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g D.参加反应的Fe2O3占原总质量的80%
5.如图为CO还原Fe2O3的微型装置图,则A处V型管内的固体粉末由_______色逐渐变黑; B处V型管内的溶液变浑浊,化学方程式为_______;将为其点燃,化学方程式为_______。
6.金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
物质 KMnO4 MnO2 MnSO4 Mn(OH)2 MnO(OH)2
颜色 暗紫色 黑色 白色 白色 棕色
溶解性 易溶 难溶 易溶 难溶 难溶
(1)KMnO4读作______________,广泛用作医药杀菌剂和防臭剂。
(2)将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:
①C + O2CO2;② _______________________;③ ________________________。
(3)已知:①MnSO4+2NaOH=Mn(OH)2↓+Na2SO4; ②2Mn(OH)2+O2=2MnO(OH)2 若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是__________。
7.生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:
回答下列问题:
(1)生铁属于______材料(填“合成”或“金属”)。“高炉气体”中的______(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一C+ CO22CO,该反应属于_______反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理________________________________。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为____________________________。
8.铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式________。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是________t(结果精确到0.1)。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.Fe2O3 Fe3O4 FeCO3 Al2O3 (1)Fe (2)FeCO3 2.D 3.③ 黄铁矿中铁的含量最低,且会生成SO2等有害气体,污染环境 【变式1】(1)Fe2O3 (2)都是由Cu、O、C、H四种元素组成 4.高炉 铁矿石、焦炭 提高炉温,生成还原剂CO ①C+O2CO2 ②CO2+C2CO ③Fe2O3+3CO2Fe+3CO2 5.B 6.D 7.(1)CO和空气混合,加热可能会发生爆炸 (2)收集CO,防止污染空气 8.(1)生铁 (2)① (3)H+ (4)Fe3O4 (5)Fe+CuSO4=FeSO4+Cu 【变式2】D 9.C 10.2714.3t
11.设需要赤铁矿的质量为m。
Fe2O3+3CO2Fe+3CO2
160 2×56
80% m 1.4×104t
m=2.5×104t
答:至少需要含 Fe2O3 80%的赤铁矿的质量2.5×104t。
12.2577.8t 【变式3】C
【课后作业】1.A 2.B 3.A 4.D 5.红棕 CO2+Ca(OH)2=CaCO3↓+H2O 2CO+O22CO2 6.(1)高锰酸钾 (2)C+CO22CO 2CO+MnO2Mn+2CO2 (3)产生白色沉淀,静置后,白色沉淀变棕色 7.(1)金属 SO2 (2)①化合 ②3CO+Fe2O32Fe+3CO2 ③CaCO3+SiO2CaSiO3+CO2↑ 8.(1)Fe2O3+3CO2Fe+3CO2 (2)1714.3
【课时目标】
1.知道一些常见金属如铁、铝、铜等的矿物,了解从铁矿石中将铁还原出来的方法。
2.会根据化学方程式对含有某些杂质的反应物或生成物进行有关计算。
3.关注与化学有关的社会问题,初步形成主动参与社会决策的意识。
重点:铁的冶炼。
难点:有关化学方程式计算中的杂质问题计算。
【学习活动】
任务一 金属资源的存在形式及常见的矿石
1.请帮小明同学完成下面表格及填空:
矿石名称 赤铁矿 磁铁矿 菱铁矿 铝土矿
主要成分
(1)目前,人类每年从大自然提取大量金属,其中提取量最大的是_________。
(2)表中矿石的主要成分不属于氧化物的是_________。
2.下列金属在自然界中有单质形式存在的是( )
A.Na B.Zn C.Al D. Au
3.现有赤铁矿(主要成分Fe2O3)、②磁铁矿(主要成分Fe3O4)、③黄铁矿(主要成分FeS2),请你从经济效益和环境保护的角度分析三种矿石中哪种最不适合用来炼铁(填写代号)_________,理由是_________。
【变式1】《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山,一些矿石的主要成分及颜色如下表。
矿石 蓝铜矿 孔雀石 雌黄 赭石
主要成分 Cu3(OH)2(CO3)2 Cu2(OH)2CO3 As2S3 Fe2O3
颜色 蓝色 绿色 黄色 红棕色
(1)四种矿石主要成分中,属于氧化物的是_________。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相点是_________。
任务二 铁的冶炼
4.工业炼铁的主要设备是_________,原料是_________、空气、石灰石等。工业炼铁中,焦炭的作用是_________,炼铁高炉内发生的主要化学变化有(用化学方程式表示):
①_________;
②_________;
③_________。
5.如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是( )
A.实验时可观察到玻璃管中红棕色粉末逐渐变黑
B.反应后玻璃管中固体物质的质量较反应前增加
C.试管中澄清石灰水变浑浊,说明有二氧化碳生成
D.为了防止污染空气,该实验应增加尾气处理装置
6.工业上利用赤铁矿石(主要成分是Fe2O3,还含少量SiO2等杂质)冶炼生铁的过程如图所示,下列说法不正确的是( )
A.CaSiO3中硅元素显+4价
B.高炉气体中SO2会形成酸雨,不能直接排放到空气中
C.原料中焦炭的作用之一是生成具有还原性的物质CO
D.高炉炼铁的原理是Fe2O3+3CO2Fe+3CO2,该反应属于置换反应
7.如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为 。
(2)反应结束后停止加热,继续通CO,此时B装置的作用是 。
8.铁是一种常见的金属,也是目前世界上年产量最高的金属。下面归纳了初中化学有关铁的知识。
(1)比较生铁和纯铁,其中硬度较大的是_______。
(2)焦炭的主要成分是碳,在生铁冶炼过程中,焦炭参与了下列反应:
①C+O2CO2 ②C+CO22CO
其中为冶炼生铁提供热量的反应是_______(填序号)。
(3)物质甲的阳离子符号是_______。
(4)若铁与物质乙反应时,火星四射,则生成物中固体的化学式是_______。
(5)若固体为红色单质,则铁与物质乙反应的化学方程式是_______(任写一个)。
【变式2】明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是( )
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
任务三 有关含杂质物质的计算
9.用1000t含有氧化铁80%的赤铁矿石,理论上可以炼出含铁97%的生铁的质量约是( )
A.560t B.571t C.577t D.583t
10.某钢铁厂每天需消耗5000t含三氧化二铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
11.改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。某钢铁厂采用赤铁矿炼铁,若该厂日产含铁 1.4×104 t 的生铁,至少需要含 Fe2O3 80%的赤铁矿的质量是多少?(要求写出计算过程)
12.工业上冶炼1732t含铁97%的生铁,需要含杂质10%的磁铁矿石的质量是多少?(结果保留一位小数。)
【变式3】用足量的CO还原8.0g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5g,则这种铁的氧化物可能是( )
A.FeO B.Fe2O3与Fe3O4的混合物
C.FeO与Fe3O4的混合物 D.Fe3O4
【课后作业】
1.用下列矿石炼金属时,排放的废气容易引起酸雨的是( )
A.辉铜矿(主要成分Cu2S) B.赤铁矿(主要成分Fe2O3)
C.磁铁矿(主要成分Fe3O4) D.铝土矿(主要成分Al2O3)
2.高炉炼铁的主反应为Fe2O3+3CO2Fe+3CO2。下列有关说法正确的是( )
A.该反应既是氧化还原反应又是置换反应
B.CO由焦炭和焦炭燃烧所得的CO2反应产生
C.所得产物为生铁,含碳量比钢低
D.高炉尾气对环境无影响,可直接排放
3.下列有关模拟工业炼铁的叙述不正确的是( )
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
4.已知:3CO+Fe2O3Fe+3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂 B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g D.参加反应的Fe2O3占原总质量的80%
5.如图为CO还原Fe2O3的微型装置图,则A处V型管内的固体粉末由_______色逐渐变黑; B处V型管内的溶液变浑浊,化学方程式为_______;将为其点燃,化学方程式为_______。
6.金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
物质 KMnO4 MnO2 MnSO4 Mn(OH)2 MnO(OH)2
颜色 暗紫色 黑色 白色 白色 棕色
溶解性 易溶 难溶 易溶 难溶 难溶
(1)KMnO4读作______________,广泛用作医药杀菌剂和防臭剂。
(2)将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:
①C + O2CO2;② _______________________;③ ________________________。
(3)已知:①MnSO4+2NaOH=Mn(OH)2↓+Na2SO4; ②2Mn(OH)2+O2=2MnO(OH)2 若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是__________。
7.生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:
回答下列问题:
(1)生铁属于______材料(填“合成”或“金属”)。“高炉气体”中的______(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成 CO 的反应之一C+ CO22CO,该反应属于_______反应(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理________________________________。
③CaCO3 和 SiO2 固体在高温条件下发生反应,生成 CO2 气体和 CaSiO3,该反应的化学方程式为____________________________。
8.铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
(1)写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式________。
(2)冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是________t(结果精确到0.1)。
【评价与反思】___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
参考答案
【学习活动】1.Fe2O3 Fe3O4 FeCO3 Al2O3 (1)Fe (2)FeCO3 2.D 3.③ 黄铁矿中铁的含量最低,且会生成SO2等有害气体,污染环境 【变式1】(1)Fe2O3 (2)都是由Cu、O、C、H四种元素组成 4.高炉 铁矿石、焦炭 提高炉温,生成还原剂CO ①C+O2CO2 ②CO2+C2CO ③Fe2O3+3CO2Fe+3CO2 5.B 6.D 7.(1)CO和空气混合,加热可能会发生爆炸 (2)收集CO,防止污染空气 8.(1)生铁 (2)① (3)H+ (4)Fe3O4 (5)Fe+CuSO4=FeSO4+Cu 【变式2】D 9.C 10.2714.3t
11.设需要赤铁矿的质量为m。
Fe2O3+3CO2Fe+3CO2
160 2×56
80% m 1.4×104t
m=2.5×104t
答:至少需要含 Fe2O3 80%的赤铁矿的质量2.5×104t。
12.2577.8t 【变式3】C
【课后作业】1.A 2.B 3.A 4.D 5.红棕 CO2+Ca(OH)2=CaCO3↓+H2O 2CO+O22CO2 6.(1)高锰酸钾 (2)C+CO22CO 2CO+MnO2Mn+2CO2 (3)产生白色沉淀,静置后,白色沉淀变棕色 7.(1)金属 SO2 (2)①化合 ②3CO+Fe2O32Fe+3CO2 ③CaCO3+SiO2CaSiO3+CO2↑ 8.(1)Fe2O3+3CO2Fe+3CO2 (2)1714.3
同课章节目录
