第十一单元课题1生活中常见的盐(第2课时复分解反应的概念和实质)课件(共20张PPT)—2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第十一单元课题1生活中常见的盐(第2课时复分解反应的概念和实质)课件(共20张PPT)—2022-2023学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 554.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-05 20:52:00 | ||
图片预览







文档简介
(共20张PPT)
第十一单元 盐 化肥
人教版九年级化学下册
课题1 生活中常见的盐(第2课时)
(复分解反应的概念和实质)
1.掌握复分解反应的概念。
2.理解复分解反应的发生条件。
3.总结盐的化学性质。
学 习 目 标
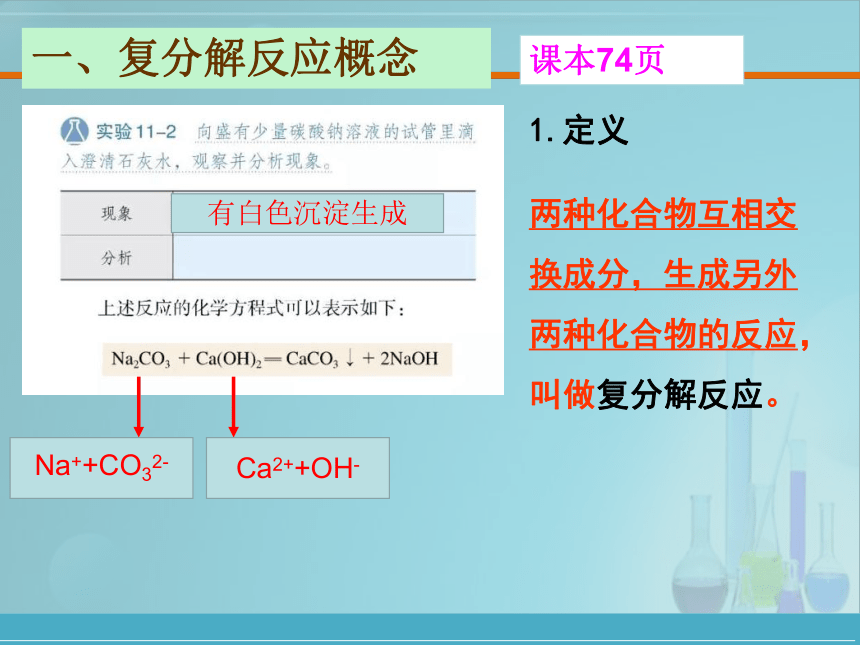
课本74页
一、复分解反应概念
Na++CO32-
Ca2++OH-
有白色沉淀生成
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
1.定义
AB + CD →
互相交换成分,化合价价不变。
AD
+ CB
基本反应类型
(1)通式:
(2)特点:
一、复分解反应概念
四大基本反应类型:
化合反应
分解反应
置换反应
复分解反应
二、复分解反应发生的条件
课本75页
(1)生成物的要求:
有沉淀或有气体或有水生成(至少一种)。
【1】水的生成:
H++OH-=H2O 只要有H+和OH- ,就可以生成H2O
二、复分解反应发生的条件
【2】气体的生成
H++ CO32-==H2O+ CO2↑
NH4++ OH-==H2O+ NH3↑
【3】那么沉淀是怎么产生的呢???
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
请认真阅读教材114页,附录 1 部分酸、碱和盐的溶解性表(室温),找找规律,便于记忆。
碳酸钾钠铵镁溶,碱溶钾钠铵钙钡。
③盐溶解性口诀:
钾钠铵盐硝酸盐,均能溶于水中间;
盐酸盐中银不溶,硫酸盐中钡不溶;
①酸都溶:
②溶碱有:KOH NaOH NH3.H2O Ba(OH)2 Ca(OH)2
【说明】常见沉淀有:
CaCO3、BaCO3、
BaSO4、 AgCl、
Mg(OH)2、 Al(OH)3 、 Zn(OH)2 、 Fe(OH)3、Cu(OH)2
(2)反应物的要求:
有酸时酸必须可溶,
无酸时两种反应物都得可溶。
二、复分解反应发生的条件
(1)NaCl+Ba(OH)2
(2)K2CO3+CaCl2
(3)H2SO4+Na2CO3
(4)Na2SO4+BaCl2
(5)BaSO4+Na2CO3
(6)Ba(OH)2+CuCl2
×
K2CO3+CaCl2=CaCO3↓+2KCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
×
Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2
这些物质间能否反应 能反应的写出化学方程式。
练一练
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
BaSO4难溶
(7)Ba(OH)2+CuCl2
(8)HCl+BaCO3
(9)H2SO4+Cu(OH)2
(10)AgNO3+KCl
Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2
2HCl+BaCO3=BaCl2+H2O+CO2↑
H2SO4+Cu(OH)2=CuSO4+2H2O
AgNO3+KCl=AgCl↓+KNO3
这些物质间能否反应 能反应的写出化学方程式。
练一练
我国制碱工业的先驱——侯德榜
侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
侯氏制碱法的反应原理:
①NaCl+NH3+CO2 +H2O =NaHCO3+NH4Cl
②2NaHCO3 ==Na2CO3 + H2O + CO2 ↑
△
硫酸钠(Na2SO4) 硫酸镁(MgSO4) 硫酸铜(CuSO4) 硫酸钡(BaSO4)…
碳酸钠(Na2CO3)碳酸镁(MgCO3) 碳酸铜(CuCO3) 碳酸钡(BaCO3)…
硝酸钠(NaNO3) 硝酸镁[Mg(NO3)2] 硝酸铜[Cu(NO3)2] 硝酸钡[Ba(NO3)2]
氯化钠(NaCl) 氯化镁(MgCl2) 氯化铜(CuCl2) 氯化钡(BaCl2)
以上这些都属于盐,我们应如何对它进行分类?
我们知道盐是由金属离子与酸根离子构成的化合物。
提示
按酸根分类,可分为硫酸盐、碳酸盐、硝酸盐、盐酸盐……
还可按金属元素分类,可分为钠盐、镁盐、铜盐、钡盐……
三、盐的分类
1、金属 + 盐 →
新盐 + 新金属
四、盐的化学性质
Fe + CuSO4 = FeSO4 + Cu
Cu + AgNO3 =
Cu(NO3)2 + Ag
2
2
条件:
盐可溶,前换后。
反应类型:
置换反应
2、盐 + 酸 →
新盐 + 新酸
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
检验CO32- 反应
AgNO3+HCl =
Ba(NO3)2+H2SO4=
条件:
生成物中有沉淀或气体。
AgCl↓+HNO3
BaSO4↓+ HNO3
2
【注意】
AgCl、 BaSO4 这两个沉淀既不溶于水,也不溶于酸。
3、盐 + 碱 →
新盐 + 新碱
Na2CO3+ Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4 + NaOH =
Na2SO4 + Cu(OH)2↓
2
FeCl3 + NaOH =
3
NaCl + Fe(OH)3↓
3
红褐色
蓝色
条件:
反应物都可溶,生成物有沉淀或气体。
NH4Cl+ Ca(OH)2 =
CaCl2 + NH3↑+ H2O
2
2
2
4、盐 + 盐 →
新盐 + 新盐
NaCl + AgNO3 =
AgCl↓+ NaNO3
BaCl2+Na2SO4=
BaSO4↓+2NaCl
反应物都可溶;生成物有沉淀。
条件:
前面学过的酸、碱、盐参与的反应中,哪些反应属于复分解反应?
五、复分解反应发生的类型
(1)酸 +金属氧化物 →盐 + 水
Fe2O3 + 6HCl =2FeCl3+ 3H2O
NaOH + HCl = NaCl +H2O
(2)酸 + 碱 →盐 + 水
CaCO3+2HCl=CaCl2 +H2O + CO2 ↑
(3)盐+酸→新盐+新酸
CuCl2+2NaOH= 2NaCl + Cu(OH)2↓
(4) 盐+碱→新盐+新碱
BaCl2+Na2SO4=BaSO4↓+2NaCl
(5) 盐+盐→新盐+新盐
一定注意:
碱+非金属氧化物→盐+水 不属于复分解反应
复分解反应的概念;
复分解反应的条件;
复分解反应的类型。
盐的化学性质;
小 结
第十一单元 盐 化肥
人教版九年级化学下册
课题1 生活中常见的盐(第2课时)
(复分解反应的概念和实质)
1.掌握复分解反应的概念。
2.理解复分解反应的发生条件。
3.总结盐的化学性质。
学 习 目 标
课本74页
一、复分解反应概念
Na++CO32-
Ca2++OH-
有白色沉淀生成
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
1.定义
AB + CD →
互相交换成分,化合价价不变。
AD
+ CB
基本反应类型
(1)通式:
(2)特点:
一、复分解反应概念
四大基本反应类型:
化合反应
分解反应
置换反应
复分解反应
二、复分解反应发生的条件
课本75页
(1)生成物的要求:
有沉淀或有气体或有水生成(至少一种)。
【1】水的生成:
H++OH-=H2O 只要有H+和OH- ,就可以生成H2O
二、复分解反应发生的条件
【2】气体的生成
H++ CO32-==H2O+ CO2↑
NH4++ OH-==H2O+ NH3↑
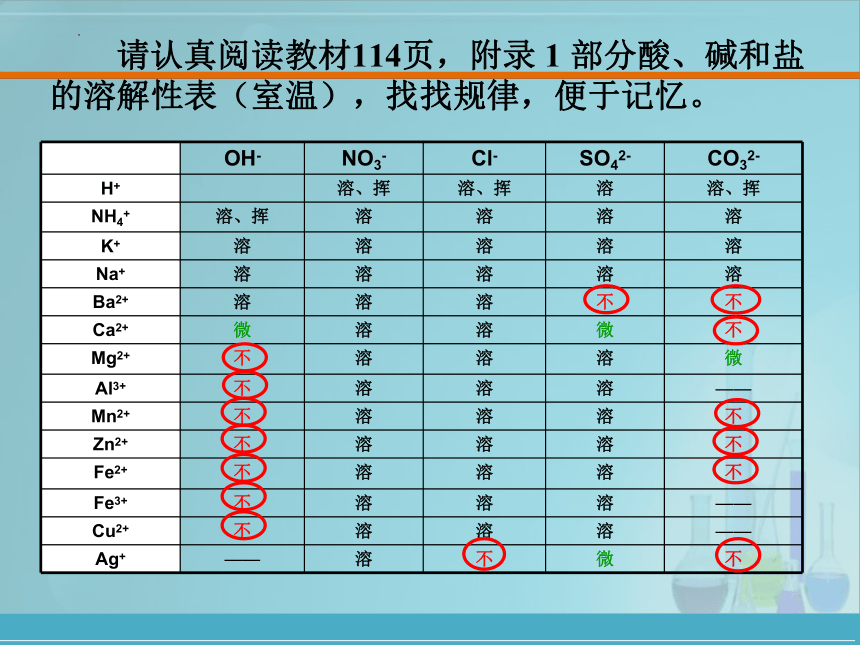
【3】那么沉淀是怎么产生的呢???
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
请认真阅读教材114页,附录 1 部分酸、碱和盐的溶解性表(室温),找找规律,便于记忆。
碳酸钾钠铵镁溶,碱溶钾钠铵钙钡。
③盐溶解性口诀:
钾钠铵盐硝酸盐,均能溶于水中间;
盐酸盐中银不溶,硫酸盐中钡不溶;
①酸都溶:
②溶碱有:KOH NaOH NH3.H2O Ba(OH)2 Ca(OH)2
【说明】常见沉淀有:
CaCO3、BaCO3、
BaSO4、 AgCl、
Mg(OH)2、 Al(OH)3 、 Zn(OH)2 、 Fe(OH)3、Cu(OH)2
(2)反应物的要求:
有酸时酸必须可溶,
无酸时两种反应物都得可溶。
二、复分解反应发生的条件
(1)NaCl+Ba(OH)2
(2)K2CO3+CaCl2
(3)H2SO4+Na2CO3
(4)Na2SO4+BaCl2
(5)BaSO4+Na2CO3
(6)Ba(OH)2+CuCl2
×
K2CO3+CaCl2=CaCO3↓+2KCl
Na2SO4+BaCl2=BaSO4↓+2NaCl
×
Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2
这些物质间能否反应 能反应的写出化学方程式。
练一练
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
BaSO4难溶
(7)Ba(OH)2+CuCl2
(8)HCl+BaCO3
(9)H2SO4+Cu(OH)2
(10)AgNO3+KCl
Ba(OH)2+CuCl2=Cu(OH)2↓+BaCl2
2HCl+BaCO3=BaCl2+H2O+CO2↑
H2SO4+Cu(OH)2=CuSO4+2H2O
AgNO3+KCl=AgCl↓+KNO3
这些物质间能否反应 能反应的写出化学方程式。
练一练
我国制碱工业的先驱——侯德榜
侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
侯氏制碱法的反应原理:
①NaCl+NH3+CO2 +H2O =NaHCO3+NH4Cl
②2NaHCO3 ==Na2CO3 + H2O + CO2 ↑
△
硫酸钠(Na2SO4) 硫酸镁(MgSO4) 硫酸铜(CuSO4) 硫酸钡(BaSO4)…
碳酸钠(Na2CO3)碳酸镁(MgCO3) 碳酸铜(CuCO3) 碳酸钡(BaCO3)…
硝酸钠(NaNO3) 硝酸镁[Mg(NO3)2] 硝酸铜[Cu(NO3)2] 硝酸钡[Ba(NO3)2]
氯化钠(NaCl) 氯化镁(MgCl2) 氯化铜(CuCl2) 氯化钡(BaCl2)
以上这些都属于盐,我们应如何对它进行分类?
我们知道盐是由金属离子与酸根离子构成的化合物。
提示
按酸根分类,可分为硫酸盐、碳酸盐、硝酸盐、盐酸盐……
还可按金属元素分类,可分为钠盐、镁盐、铜盐、钡盐……
三、盐的分类
1、金属 + 盐 →
新盐 + 新金属
四、盐的化学性质
Fe + CuSO4 = FeSO4 + Cu
Cu + AgNO3 =
Cu(NO3)2 + Ag
2
2
条件:
盐可溶,前换后。
反应类型:
置换反应
2、盐 + 酸 →
新盐 + 新酸
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
检验CO32- 反应
AgNO3+HCl =
Ba(NO3)2+H2SO4=
条件:
生成物中有沉淀或气体。
AgCl↓+HNO3
BaSO4↓+ HNO3
2
【注意】
AgCl、 BaSO4 这两个沉淀既不溶于水,也不溶于酸。
3、盐 + 碱 →
新盐 + 新碱
Na2CO3+ Ca(OH)2 = CaCO3↓+ 2NaOH
CuSO4 + NaOH =
Na2SO4 + Cu(OH)2↓
2
FeCl3 + NaOH =
3
NaCl + Fe(OH)3↓
3
红褐色
蓝色
条件:
反应物都可溶,生成物有沉淀或气体。
NH4Cl+ Ca(OH)2 =
CaCl2 + NH3↑+ H2O
2
2
2
4、盐 + 盐 →
新盐 + 新盐
NaCl + AgNO3 =
AgCl↓+ NaNO3
BaCl2+Na2SO4=
BaSO4↓+2NaCl
反应物都可溶;生成物有沉淀。
条件:
前面学过的酸、碱、盐参与的反应中,哪些反应属于复分解反应?
五、复分解反应发生的类型
(1)酸 +金属氧化物 →盐 + 水
Fe2O3 + 6HCl =2FeCl3+ 3H2O
NaOH + HCl = NaCl +H2O
(2)酸 + 碱 →盐 + 水
CaCO3+2HCl=CaCl2 +H2O + CO2 ↑
(3)盐+酸→新盐+新酸
CuCl2+2NaOH= 2NaCl + Cu(OH)2↓
(4) 盐+碱→新盐+新碱
BaCl2+Na2SO4=BaSO4↓+2NaCl
(5) 盐+盐→新盐+新盐
一定注意:
碱+非金属氧化物→盐+水 不属于复分解反应
复分解反应的概念;
复分解反应的条件;
复分解反应的类型。
盐的化学性质;
小 结
同课章节目录
