1001-3 酸的化学性质(PPT课件19页)2022-2023学年九年级下册化学同步精品课件讲义(人教版)
文档属性
| 名称 | 1001-3 酸的化学性质(PPT课件19页)2022-2023学年九年级下册化学同步精品课件讲义(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
课题1-3 酸的化学性质
回顾所学知识,酸可以发生哪些化学反应?
是否所有的酸,都有相同的化学性质?
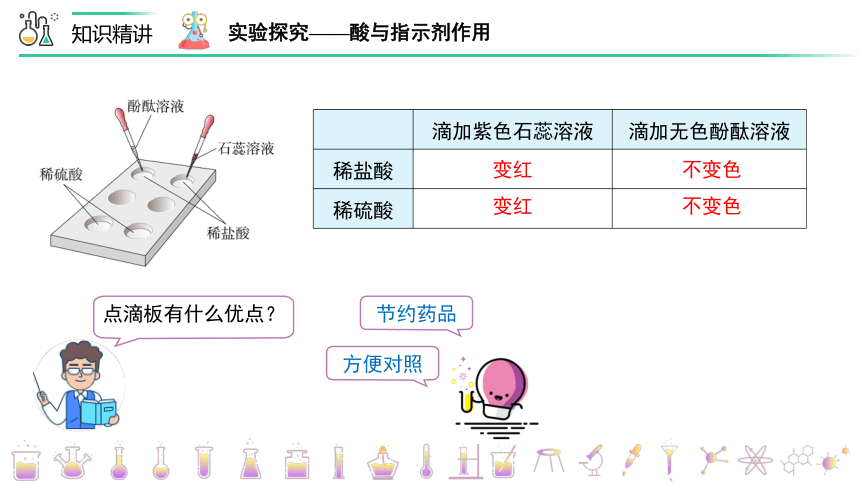
实验探究——酸与指示剂作用
滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
不变色
不变色
点滴板有什么优点?
节约药品
方便对照
二、与活泼金属反应
能与活泼金属反应放出H2
稀盐酸 稀硫酸
镁
锌
铁
铝
Mg + 2HCl === MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
Mg+H2SO4 === MgSO4+H2↑
Zn+H2SO4 === ZnSO4+ H2↑
Fe+H2SO4 === FeSO4+H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al + 3H2SO4 === Al2(SO4) 3 + 3H2↑
实验探究——铁锈与酸
实验现象 实验结论
稀盐酸
稀硫酸 铁锈溶解,
溶液由无色变为黄色
酸能与铁锈(Fe2O3)反应
除锈时能否将铁制品长时间浸在酸中?
三、与金属氧化物反应
酸能与金属氧化物反应,生成该金属的化合物(盐)和水。
稀盐酸 稀硫酸
氧化铁
氧化亚铁
氧化铜
氧化铝
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
CuO+2HCl === CuCl2+H2O
CuO+H2SO4 === CuSO4+H2O
FeO + 2HCl===FeCl2+H2O
FeO+H2SO4===FeSO4+H2O
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+3H2SO4=== Al2(SO4)3+3H2O
浅绿色
蓝色
四、与碱反应
酸能与碱反应,生成盐和水。
稀盐酸 稀硫酸
氢氧化钠
氢氧化钙
NaOH + HCl=== NaCl + H2O
2NaOH + H2SO4 === Na2SO4 + 2H2O
Ca(OH)2 + 2HCl=== CaCl2 + 2H2O
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
五、与某些盐反应
CaCO3+2HCl === CaCl2+H2O+CO2↑
实验室制取二氧化碳
归纳总结——酸的化学性质
1. 酸能使紫色石蕊试液变红,不能使无色酚酞溶液变色;
2. 酸能与活泼金属反应生成盐和氢气;
3. 酸能与某些金属氧化物反应生成盐和水;
4. 酸能与碱反应生成盐和水;
5. 酸能与某些盐反应。
知识点都掌握了吗?来做几道题检测下~
【例1】足量的盐酸除去铁钉上的铁锈,一段时间内可能观察到的实验现象是
①铁钉上的铁锈消失 ②铁钉上有气泡 ③溶液呈黄色
A.①② B.①②③ C.③ D.①③
B
酸的化学性质
【例2】下列各组物质充分反应后,溶液质量比反应前的溶液质量减小的是
A.铁片浸入稀硫酸中
B.铁片浸入硫酸铜溶液中
C.铜锌合金加入稀盐酸中
D.碳酸钠粉末加入稀盐酸中
B
酸的化学性质
【例4】柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸的通性,下列物质不能与柠檬酸反应的是
A.Fe2O3 B.CO2 C.CaCO3 D.Zn
B
酸的化学性质
【例6】如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )
A.a可能是紫色石蕊试液
B.b可能是氧化物
C.c可能是单质
D.d可能是单质
D
酸的化学性质
【例10】某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:
(1)能产生气泡的是______(填标号);
(2)写出溶液变为蓝色所发生反应的化学方程式______。
(3)能证明C中发生了反应的现象是______。
酸的化学性质
(1)BD
(2)CuO+H2SO4 === CuSO4+H2O
(3)酚酞试液由红色变为无色
课题1-3 酸的化学性质
回顾所学知识,酸可以发生哪些化学反应?
是否所有的酸,都有相同的化学性质?
实验探究——酸与指示剂作用
滴加紫色石蕊溶液 滴加无色酚酞溶液
稀盐酸
稀硫酸
变红
变红
不变色
不变色
点滴板有什么优点?
节约药品
方便对照
二、与活泼金属反应
能与活泼金属反应放出H2
稀盐酸 稀硫酸
镁
锌
铁
铝
Mg + 2HCl === MgCl2 + H2↑
Zn + 2HCl === ZnCl2 + H2↑
Fe + 2HCl === FeCl2 + H2↑
Mg+H2SO4 === MgSO4+H2↑
Zn+H2SO4 === ZnSO4+ H2↑
Fe+H2SO4 === FeSO4+H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al + 3H2SO4 === Al2(SO4) 3 + 3H2↑
实验探究——铁锈与酸
实验现象 实验结论
稀盐酸
稀硫酸 铁锈溶解,
溶液由无色变为黄色
酸能与铁锈(Fe2O3)反应
除锈时能否将铁制品长时间浸在酸中?
三、与金属氧化物反应
酸能与金属氧化物反应,生成该金属的化合物(盐)和水。
稀盐酸 稀硫酸
氧化铁
氧化亚铁
氧化铜
氧化铝
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
CuO+2HCl === CuCl2+H2O
CuO+H2SO4 === CuSO4+H2O
FeO + 2HCl===FeCl2+H2O
FeO+H2SO4===FeSO4+H2O
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+3H2SO4=== Al2(SO4)3+3H2O
浅绿色
蓝色
四、与碱反应
酸能与碱反应,生成盐和水。
稀盐酸 稀硫酸
氢氧化钠
氢氧化钙
NaOH + HCl=== NaCl + H2O
2NaOH + H2SO4 === Na2SO4 + 2H2O
Ca(OH)2 + 2HCl=== CaCl2 + 2H2O
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
五、与某些盐反应
CaCO3+2HCl === CaCl2+H2O+CO2↑
实验室制取二氧化碳
归纳总结——酸的化学性质
1. 酸能使紫色石蕊试液变红,不能使无色酚酞溶液变色;
2. 酸能与活泼金属反应生成盐和氢气;
3. 酸能与某些金属氧化物反应生成盐和水;
4. 酸能与碱反应生成盐和水;
5. 酸能与某些盐反应。
知识点都掌握了吗?来做几道题检测下~
【例1】足量的盐酸除去铁钉上的铁锈,一段时间内可能观察到的实验现象是
①铁钉上的铁锈消失 ②铁钉上有气泡 ③溶液呈黄色
A.①② B.①②③ C.③ D.①③
B
酸的化学性质
【例2】下列各组物质充分反应后,溶液质量比反应前的溶液质量减小的是
A.铁片浸入稀硫酸中
B.铁片浸入硫酸铜溶液中
C.铜锌合金加入稀盐酸中
D.碳酸钠粉末加入稀盐酸中
B
酸的化学性质
【例4】柠檬酸(C6H8O7)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸的通性,下列物质不能与柠檬酸反应的是
A.Fe2O3 B.CO2 C.CaCO3 D.Zn
B
酸的化学性质
【例6】如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )
A.a可能是紫色石蕊试液
B.b可能是氧化物
C.c可能是单质
D.d可能是单质
D
酸的化学性质
【例10】某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:
(1)能产生气泡的是______(填标号);
(2)写出溶液变为蓝色所发生反应的化学方程式______。
(3)能证明C中发生了反应的现象是______。
酸的化学性质
(1)BD
(2)CuO+H2SO4 === CuSO4+H2O
(3)酚酞试液由红色变为无色
同课章节目录
