1001-2 几种常见的酸(PPT课件24页)2022-2023学年九年级下册化学同步精品课件讲义(人教版)
文档属性
| 名称 | 1001-2 几种常见的酸(PPT课件24页)2022-2023学年九年级下册化学同步精品课件讲义(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 54.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 17:08:46 | ||
图片预览







文档简介
课题1-2 几种常见的酸
生活中常见的含有酸的物品
乳酸
醋酸
柠檬酸
盐酸
观察这些酸的化学式,你能发现什么规律吗?
盐酸——HCl
硫酸——H2SO4
硝酸——HNO3
碳酸——H2CO3
磷酸——H3PO4
氢溴酸——HBr
一、酸
1. 定义:解离时产生的阳离子______________的化合物。
2. 构成:酸可以看作是由 和 构成。
都是H+
盐酸——HCl
硫酸——H2SO4
硝酸——HNO3
碳酸——H2CO3
磷酸——H3PO4
氢溴酸——HBr
H+
酸根离子
含有氢元素的一定是酸吗?
酸在水中解离出的阴离子称为酸根离子,如Cl-、SO42?、NO3?、CO32?等
?
能使石蕊变红的一定是酸吗?
(1)观察盐酸、硫酸的颜色和状态;
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
实验探究
二、常见的酸
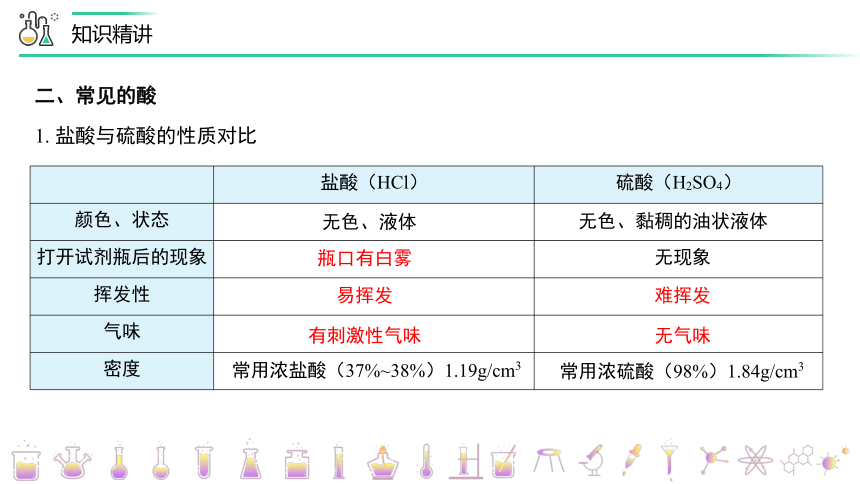
1. 盐酸与硫酸的性质对比
?
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
打开试剂瓶后的现象
?
挥发性
气味
密度
瓶口有白雾
无色、液体
无色、黏稠的油状液体
无现象
易挥发
难挥发
有刺激性气味
无气味
常用浓盐酸(37%~38%)1.19g/cm3
常用浓硫酸(98%)1.84g/cm3
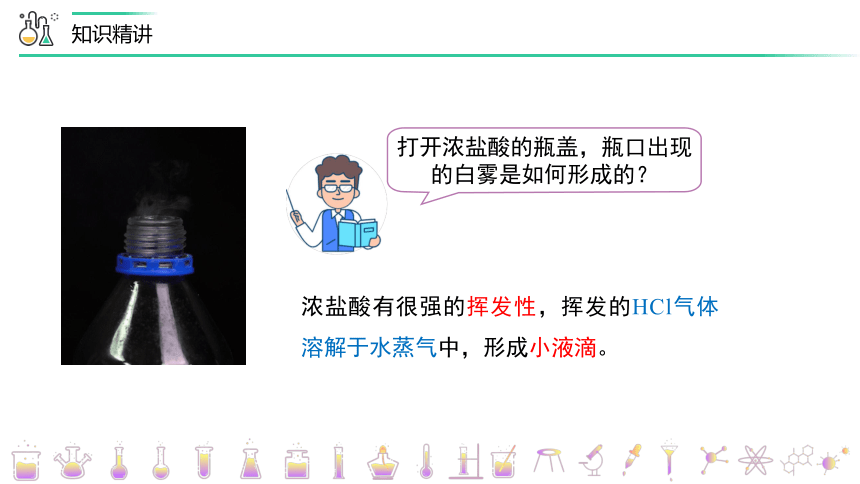
打开浓盐酸的瓶盖,瓶口出现的白雾是如何形成的?
浓盐酸有很强的挥发性,挥发的HCl气体溶解于水蒸气中,形成小液滴。
二、常见的酸
2. 盐酸与硫酸的用途
?
用途
盐酸
重要化工产品,用于金属表面________、制造药物等;
人体_______中含有盐酸,可____________。
硫酸
除锈
胃液
帮助消化
吸水
干燥剂
重要化工原料,用于生产化肥、农药、火药、染料以及
冶炼金属、精炼石油和金属除锈等。
浓硫酸有_______性,在实验室中常用它做__________。
二、常见的酸
3. 常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。
硝酸见光易分解,应保存在棕色瓶中
盐酸、浓硫酸如果长期敞口放置,溶质的质量分数是否发生变化?
保存盐酸、浓硫酸时需注意什么?
挥发性
吸水性
必须密封保存
{5940675A-B579-460E-94D1-54222C63F5DA}
溶质质量
溶剂质量
溶液质量
溶质质量分数
盐酸
浓硫酸
变小
不变
变小
变小
不变
变大
变大
变小
三、浓硫酸的特性
1. 吸水性
(1)浓硫酸具有吸水性,常用作干燥剂。
(2)浓硫酸会吸收空气中的水分而变稀,所以浓硫酸应密封保存。
(3)浓硫酸的吸水性,为物理性质。
气体长进短出
实验探究——浓硫酸的腐蚀性
实验操作
实验现象
用玻璃棒蘸取浓硫酸在纸上写字
纸上出现_____色字迹
用小木棍蘸少量浓硫酸
蘸有硫酸的部位_____
将浓硫酸滴到一块小布上
滴有浓硫酸的部位_____甚至形成洞
黑
变黑
变黑
2. 腐蚀性(脱水性)
(1)浓硫酸有强烈的腐蚀性(脱水性)。
夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。
(2)浓硫酸的腐蚀性为化学性质。
已知浓硫酸稀释时,会放出大量的热。如果要稀释浓硫酸,应该如何操作?
四、浓硫酸的稀释
把__________沿_______慢慢注入_____里,并用___________不断_______。
浓硫酸
杯壁
水
玻璃棒
搅拌
为什么要用玻璃棒搅拌?
使产生的热量迅速扩散
为什么不可把水注入浓硫酸里?
水的密度较小,会浮在浓硫酸上面,溶解时放出的热使水立刻沸腾,使硫酸液滴向四周飞溅。
“杯壁下流”
如果不慎将浓硫酸沾到皮肤或衣服上,应该如何处理?
立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液
知识点都掌握了吗?来做几道题检测下~
【变4-1】下列物质中,属于酸的是
A.O2 B.SO2 C.H2CO3 D.KClO3
C
题型二:酸的定义
【变5-1】下列关于盐酸、硫酸的叙述正确的是
A.打开浓盐酸试剂瓶瓶塞,瓶口冒白烟
B.浓盐酸敞口放置后,其溶质质量分数减小
C.浓硫酸具有脱水性,故能做干燥剂
D.浓硫酸溶于水时会吸热
B
题型三:常见的酸
【例8】盐酸和碳酸都是实验室中重要的化学试剂,也是重要的化工产品。
(1)实验室中打开盛浓盐酸和浓硫酸的试剂瓶,立即就能把它们区分开来,这是为什么?__________________________
(2)如图所示是某试剂瓶标签上的内容,要把10 g这种浓硫酸稀释为20%的稀硫酸,需要水的质量为 ________ g,稀释浓硫酸时,不可将水倒入浓硫酸中,请解释其原因 _______________________ 。
题型三:常见的酸
【例8】
题型三:常见的酸
【答案】浓盐酸具有挥发性,挥发出氯化氢气体,与空气中水蒸气结合形成白雾,所以打开瓶盖后有白雾产生的是浓盐酸,没有现象的是浓硫酸
39
水的密度小于浓硫酸的密度,将水倒入浓硫酸中,水会浮在浓硫酸的表面,且浓硫酸溶于水放出大量的热,使水沸腾,所以会使液体溅出伤人
生活中常见的含有酸的物品
乳酸
醋酸
柠檬酸
盐酸
观察这些酸的化学式,你能发现什么规律吗?
盐酸——HCl
硫酸——H2SO4
硝酸——HNO3
碳酸——H2CO3
磷酸——H3PO4
氢溴酸——HBr
一、酸
1. 定义:解离时产生的阳离子______________的化合物。
2. 构成:酸可以看作是由 和 构成。
都是H+
盐酸——HCl
硫酸——H2SO4
硝酸——HNO3
碳酸——H2CO3
磷酸——H3PO4
氢溴酸——HBr
H+
酸根离子
含有氢元素的一定是酸吗?
酸在水中解离出的阴离子称为酸根离子,如Cl-、SO42?、NO3?、CO32?等
?
能使石蕊变红的一定是酸吗?
(1)观察盐酸、硫酸的颜色和状态;
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
实验探究
二、常见的酸
1. 盐酸与硫酸的性质对比
?
盐酸(HCl)
硫酸(H2SO4)
颜色、状态
打开试剂瓶后的现象
?
挥发性
气味
密度
瓶口有白雾
无色、液体
无色、黏稠的油状液体
无现象
易挥发
难挥发
有刺激性气味
无气味
常用浓盐酸(37%~38%)1.19g/cm3
常用浓硫酸(98%)1.84g/cm3
打开浓盐酸的瓶盖,瓶口出现的白雾是如何形成的?
浓盐酸有很强的挥发性,挥发的HCl气体溶解于水蒸气中,形成小液滴。
二、常见的酸
2. 盐酸与硫酸的用途
?
用途
盐酸
重要化工产品,用于金属表面________、制造药物等;
人体_______中含有盐酸,可____________。
硫酸
除锈
胃液
帮助消化
吸水
干燥剂
重要化工原料,用于生产化肥、农药、火药、染料以及
冶炼金属、精炼石油和金属除锈等。
浓硫酸有_______性,在实验室中常用它做__________。
二、常见的酸
3. 常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。
硝酸见光易分解,应保存在棕色瓶中
盐酸、浓硫酸如果长期敞口放置,溶质的质量分数是否发生变化?
保存盐酸、浓硫酸时需注意什么?
挥发性
吸水性
必须密封保存
{5940675A-B579-460E-94D1-54222C63F5DA}
溶质质量
溶剂质量
溶液质量
溶质质量分数
盐酸
浓硫酸
变小
不变
变小
变小
不变
变大
变大
变小
三、浓硫酸的特性
1. 吸水性
(1)浓硫酸具有吸水性,常用作干燥剂。
(2)浓硫酸会吸收空气中的水分而变稀,所以浓硫酸应密封保存。
(3)浓硫酸的吸水性,为物理性质。
气体长进短出
实验探究——浓硫酸的腐蚀性
实验操作
实验现象
用玻璃棒蘸取浓硫酸在纸上写字
纸上出现_____色字迹
用小木棍蘸少量浓硫酸
蘸有硫酸的部位_____
将浓硫酸滴到一块小布上
滴有浓硫酸的部位_____甚至形成洞
黑
变黑
变黑
2. 腐蚀性(脱水性)
(1)浓硫酸有强烈的腐蚀性(脱水性)。
夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。
(2)浓硫酸的腐蚀性为化学性质。
已知浓硫酸稀释时,会放出大量的热。如果要稀释浓硫酸,应该如何操作?
四、浓硫酸的稀释
把__________沿_______慢慢注入_____里,并用___________不断_______。
浓硫酸
杯壁
水
玻璃棒
搅拌
为什么要用玻璃棒搅拌?
使产生的热量迅速扩散
为什么不可把水注入浓硫酸里?
水的密度较小,会浮在浓硫酸上面,溶解时放出的热使水立刻沸腾,使硫酸液滴向四周飞溅。
“杯壁下流”
如果不慎将浓硫酸沾到皮肤或衣服上,应该如何处理?
立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液
知识点都掌握了吗?来做几道题检测下~
【变4-1】下列物质中,属于酸的是
A.O2 B.SO2 C.H2CO3 D.KClO3
C
题型二:酸的定义
【变5-1】下列关于盐酸、硫酸的叙述正确的是
A.打开浓盐酸试剂瓶瓶塞,瓶口冒白烟
B.浓盐酸敞口放置后,其溶质质量分数减小
C.浓硫酸具有脱水性,故能做干燥剂
D.浓硫酸溶于水时会吸热
B
题型三:常见的酸
【例8】盐酸和碳酸都是实验室中重要的化学试剂,也是重要的化工产品。
(1)实验室中打开盛浓盐酸和浓硫酸的试剂瓶,立即就能把它们区分开来,这是为什么?__________________________
(2)如图所示是某试剂瓶标签上的内容,要把10 g这种浓硫酸稀释为20%的稀硫酸,需要水的质量为 ________ g,稀释浓硫酸时,不可将水倒入浓硫酸中,请解释其原因 _______________________ 。
题型三:常见的酸
【例8】
题型三:常见的酸
【答案】浓盐酸具有挥发性,挥发出氯化氢气体,与空气中水蒸气结合形成白雾,所以打开瓶盖后有白雾产生的是浓盐酸,没有现象的是浓硫酸
39
水的密度小于浓硫酸的密度,将水倒入浓硫酸中,水会浮在浓硫酸的表面,且浓硫酸溶于水放出大量的热,使水沸腾,所以会使液体溅出伤人
同课章节目录
