人教版化学九下 第十一单元 实验活动8 粗盐中难溶性杂质的去除 课件(共24张PPT)
文档属性
| 名称 | 人教版化学九下 第十一单元 实验活动8 粗盐中难溶性杂质的去除 课件(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
粗盐的提纯
体验固体混合物初步提纯的实验过程。
1
学习蒸发操作技能,巩固溶解、过滤操作技能。
2
掌握粗盐中可溶性杂质的去除。
3
学习目标
CONTENTS
粗盐中含有可溶性杂质(MgCl2,CaCl2 ,Na2SO4等)和不溶性杂质(泥沙)等,要将粗盐提纯为精盐,可以通过什么方法将杂质除去呢?
粗盐
精盐
海水晾晒
主要成分为氯化钠,
第一章节
PART ONE
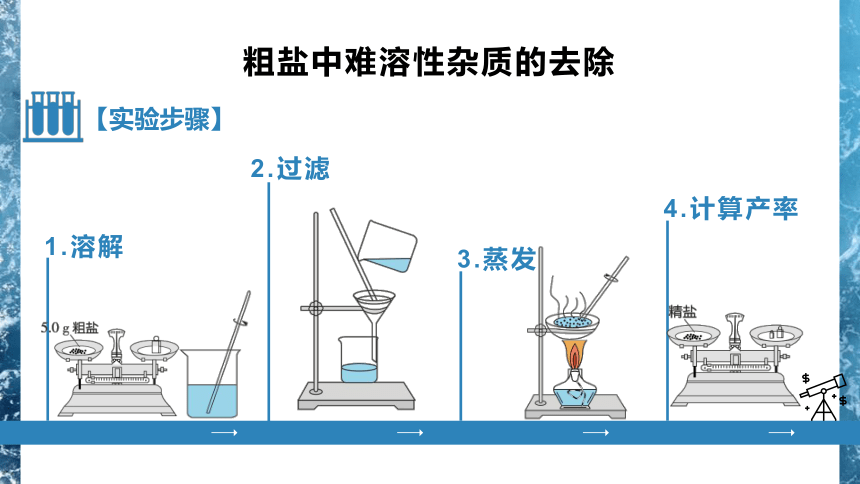
粗盐中难溶性杂质的去除
1.溶解
2.过滤
3.蒸发
4.计算产率
粗盐中难溶性杂质的去除
【实验步骤】
问题与交流
实验中 次用到玻璃棒,其作用分别是什么?
1.溶解
搅拌,
加快溶解
2.过滤
引流
3.蒸发
搅拌,防止因局部温度过高,造成液滴飞溅
4.计算产率
转移固体
4
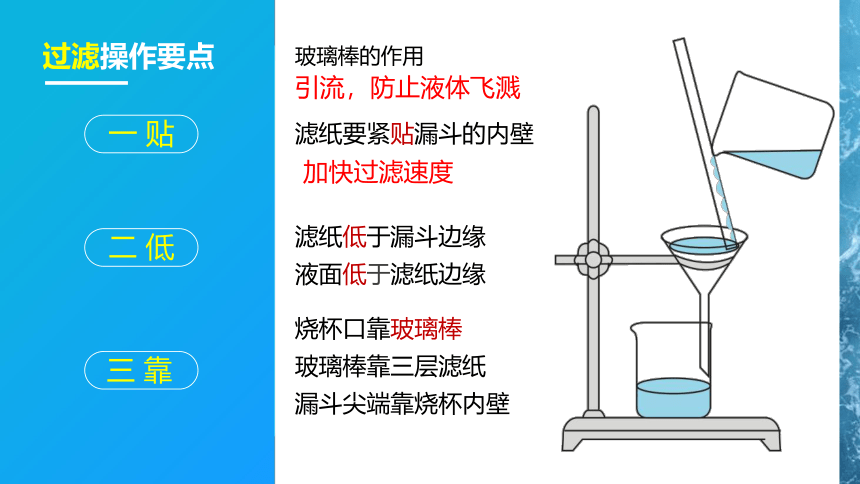
滤纸要紧贴漏斗的内壁
过滤操作要点
加快过滤速度
滤纸低于漏斗边缘
液面低于滤纸边缘
烧杯口靠玻璃棒
玻璃棒靠三层滤纸
漏斗尖端靠烧杯内壁
玻璃棒的作用
引流,防止液体飞溅
一 贴
二 低
三 靠
蒸发
仪器:
酒精灯、蒸发皿、玻璃棒
铁架台、坩埚钳、石棉网
1.蒸发皿中液体不超过 。
2.玻璃棒作用: .
3.当 时,停止加热,
利用余热将其蒸干。
4.蒸发皿用 夹持放在 上。
2/3
搅拌,使液体受热均匀,防止飞溅
出现较多固体
坩埚钳
石棉网
操作要点:
计算产率
产率=
精盐的质量
粗盐的质量
×100%
①滤纸有破损
①溶解搅拌时液滴溅出
(2)若得到的精盐产率偏低,试分析引起产率偏低的原因可能有哪些?
(1)若得到的精盐产率偏高,试分析引起产率偏高的原因可能有哪些?
③水没蒸发完
②滤液液面高于滤纸边缘
②粗盐未完全溶解
③蒸发时没有及时搅拌造成液滴飞溅
④停止加热太晚,造成液滴飞溅等。
问题与交流
1.制取粗盐时,晒盐和煮盐的目的都是通过蒸发盐溶液中的水分使之浓。想一想:能否采用降低温度的方法来达到同一目的 (提示:从氯化钠的溶解度曲线考虑)
氯化钠的溶解度受温度影响变化不大,其高温饱和溶液降温后,析出氯化钠晶体的量少,大部分还溶解在水中。所以,不能通过降低溶液温度的方法来达到使其溶液浓缩的目的。
问题与交流
问题与交流
否,还含有可溶性杂质(MgCl2,CaCl2 ,Na2SO4等)
2.本实验提取得到的精盐是否是纯净物,是否还可能含有其他杂质?说出你判断的理由。
粗盐
精盐
主要成分为氯化钠,
?
第二章节
PART ONE
粗盐中可溶性杂质的去除
1.粗盐中可溶性杂质的去除
粗盐
杂质
泥沙
可溶杂质
氯化钠
Na2SO4
MgCl2
CaCl2
Na2SO4
MgCl2
CaCl2
海水中离子的含量
溶解
过滤
蒸发结晶
物理方法
海水蒸发结晶
粗盐
食盐
2.除杂原则
不减
易分离
不增
除去杂质的同时
不能引入新的杂质
操作过程中尽量不使被提纯的物质损失
操作简便
易于分离
化学方法:通过加入合适的试剂,使杂质离子转化为沉淀、气体或水。
基本原则
Na+、Cl- 和Na+、OH-
1.确定溶液中的离子
3. 思路分析
试剂选择(以除去NaCl溶液中的NaOH为例)
杂质离子:OH-
2.确定杂质离子和非杂质离子
Cu2+
3.确定除杂离子(不共存)
HCl
4.确定除杂试剂
非杂质离子:Na+、Cl-
H+
4. 流程分析
NaCl溶液(Na2SO4 MgCl2 CaCl2 )
SO42- Mg2+ Ca2+
所含杂质 除去试剂 离子关系
Na2SO4
MgCl2
CaCl2
NaOH
Na2CO3
过量HCl
Na2CO3
SO42-→Ba2+
HCl
Mg2+→OH-
HCl
Ca2+→CO32-
蒸发
过量的NaOH和Na2CO3
OH-→H+—CO32-
→
请同学们暂停2 min,思考上述问题。
(1)Na2CO3在BaCl2之后,NaOH位置可以调整;(Na2CO3 要除去Ca2+和过量的Ba2+)
(3)过量的盐酸通过蒸发除去(盐酸有挥发性)。
(2)盐酸必须放在过滤之后(要除去Na2CO3和NaOH)
杂质离子
除杂试剂
过量试剂除去方法
过量
过量
Ba2+
BaCl2
过量
→CO32-
→H+
→H+
4. 流程分析
Cl-
SO42-
Na+
Ca2+
含杂质Mg2+、Ca2+ 、SO42-
Mg2+
4. 流程分析
Cl-
4
SO
2-
Na+
Ca2+
Ba2+
加入过量的BaCl2溶液
Mg2+
Ba2+
BaSO4
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
NaCl
BaSO4
MgCl2
CaCl2
BaSO4
第1步
BaCl2
4. 流程分析
Cl
-
Na+
Ca2+
OH-
OH-
OH-
OH-
2+
Mg
Mg(OH)2
Ba2+
过量
NaOH
BaSO4
Mg(OH)2
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
NaCl
BaSO4
Mg(OH)2
CaCl2
BaCl2
NaOH
4. 流程分析
Cl-
Na+
Ca
2+
2+
Ba
OH-
OH-
CO32-
CO32-
CO32-
CaCO3
BaCO3
CaCO3
BaCO3
BaSO4
Mg(OH)2
BaCO3
CaCO3
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
加入过量的Na2CO3溶液
第3步
过量
NaOH
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
BaSO4
Mg(OH)2
NaCl
NaOH
过量
Na2CO3
Na2CO3
过滤
4. 流程分析
Cl-
Na+
OH
-
OH
-
3
CO
2-
H+
H+
H+
H+
H2CO3
H2O
H2O
H2O
CO2
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
加入过量的Na2CO3溶液
第3步
加入过量的稀盐酸
第4步
NaCl
NaOH
Na2CO3
过量
稀盐酸
NaCl
HCl
蒸发结晶
NaCl
晶体
精盐
NaCl
①过量BaCl2溶液
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
②过滤
滤液
( Na+、Cl-、 CO32-、OH-)
③过量稀HCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
【小结】除杂可选用合适的试剂,将杂质转化为沉淀、气体或水而除去。
④加热浓缩、
蒸发结晶
【总结】粗盐的提纯
Na2SO4+BaCl2=BaSO4↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
Na2CO3溶液、
NaOH溶液
1. 除去食盐水中CaCl2和Na2SO4杂质的操作有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是(提示:BaSO4、BaCO3难溶于水) ( )
A. ③①②⑤④ B. ①⑤③②④ C. ①③⑤④② D. ①③②⑤④
2. 食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为_______________。
D
NaCl和Na2CO3
3.硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某Na2SO4粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:____________________________________、____________________________________。
(2)NaOH和Na2CO3如果添加过量了,可加入适量_________ 溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至___(填序号)
A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
Na2CO3+CaCl2=CaCO3↓+2NaCl
稀H2SO4
C
粗盐的提纯
体验固体混合物初步提纯的实验过程。
1
学习蒸发操作技能,巩固溶解、过滤操作技能。
2
掌握粗盐中可溶性杂质的去除。
3
学习目标
CONTENTS
粗盐中含有可溶性杂质(MgCl2,CaCl2 ,Na2SO4等)和不溶性杂质(泥沙)等,要将粗盐提纯为精盐,可以通过什么方法将杂质除去呢?
粗盐
精盐
海水晾晒
主要成分为氯化钠,
第一章节
PART ONE
粗盐中难溶性杂质的去除
1.溶解
2.过滤
3.蒸发
4.计算产率
粗盐中难溶性杂质的去除
【实验步骤】
问题与交流
实验中 次用到玻璃棒,其作用分别是什么?
1.溶解
搅拌,
加快溶解
2.过滤
引流
3.蒸发
搅拌,防止因局部温度过高,造成液滴飞溅
4.计算产率
转移固体
4
滤纸要紧贴漏斗的内壁
过滤操作要点
加快过滤速度
滤纸低于漏斗边缘
液面低于滤纸边缘
烧杯口靠玻璃棒
玻璃棒靠三层滤纸
漏斗尖端靠烧杯内壁
玻璃棒的作用
引流,防止液体飞溅
一 贴
二 低
三 靠
蒸发
仪器:
酒精灯、蒸发皿、玻璃棒
铁架台、坩埚钳、石棉网
1.蒸发皿中液体不超过 。
2.玻璃棒作用: .
3.当 时,停止加热,
利用余热将其蒸干。
4.蒸发皿用 夹持放在 上。
2/3
搅拌,使液体受热均匀,防止飞溅
出现较多固体
坩埚钳
石棉网
操作要点:
计算产率
产率=
精盐的质量
粗盐的质量
×100%
①滤纸有破损
①溶解搅拌时液滴溅出
(2)若得到的精盐产率偏低,试分析引起产率偏低的原因可能有哪些?
(1)若得到的精盐产率偏高,试分析引起产率偏高的原因可能有哪些?
③水没蒸发完
②滤液液面高于滤纸边缘
②粗盐未完全溶解
③蒸发时没有及时搅拌造成液滴飞溅
④停止加热太晚,造成液滴飞溅等。
问题与交流
1.制取粗盐时,晒盐和煮盐的目的都是通过蒸发盐溶液中的水分使之浓。想一想:能否采用降低温度的方法来达到同一目的 (提示:从氯化钠的溶解度曲线考虑)
氯化钠的溶解度受温度影响变化不大,其高温饱和溶液降温后,析出氯化钠晶体的量少,大部分还溶解在水中。所以,不能通过降低溶液温度的方法来达到使其溶液浓缩的目的。
问题与交流
问题与交流
否,还含有可溶性杂质(MgCl2,CaCl2 ,Na2SO4等)
2.本实验提取得到的精盐是否是纯净物,是否还可能含有其他杂质?说出你判断的理由。
粗盐
精盐
主要成分为氯化钠,
?
第二章节
PART ONE
粗盐中可溶性杂质的去除
1.粗盐中可溶性杂质的去除
粗盐
杂质
泥沙
可溶杂质
氯化钠
Na2SO4
MgCl2
CaCl2
Na2SO4
MgCl2
CaCl2
海水中离子的含量
溶解
过滤
蒸发结晶
物理方法
海水蒸发结晶
粗盐
食盐
2.除杂原则
不减
易分离
不增
除去杂质的同时
不能引入新的杂质
操作过程中尽量不使被提纯的物质损失
操作简便
易于分离
化学方法:通过加入合适的试剂,使杂质离子转化为沉淀、气体或水。
基本原则
Na+、Cl- 和Na+、OH-
1.确定溶液中的离子
3. 思路分析
试剂选择(以除去NaCl溶液中的NaOH为例)
杂质离子:OH-
2.确定杂质离子和非杂质离子
Cu2+
3.确定除杂离子(不共存)
HCl
4.确定除杂试剂
非杂质离子:Na+、Cl-
H+
4. 流程分析
NaCl溶液(Na2SO4 MgCl2 CaCl2 )
SO42- Mg2+ Ca2+
所含杂质 除去试剂 离子关系
Na2SO4
MgCl2
CaCl2
NaOH
Na2CO3
过量HCl
Na2CO3
SO42-→Ba2+
HCl
Mg2+→OH-
HCl
Ca2+→CO32-
蒸发
过量的NaOH和Na2CO3
OH-→H+—CO32-
→
请同学们暂停2 min,思考上述问题。
(1)Na2CO3在BaCl2之后,NaOH位置可以调整;(Na2CO3 要除去Ca2+和过量的Ba2+)
(3)过量的盐酸通过蒸发除去(盐酸有挥发性)。
(2)盐酸必须放在过滤之后(要除去Na2CO3和NaOH)
杂质离子
除杂试剂
过量试剂除去方法
过量
过量
Ba2+
BaCl2
过量
→CO32-
→H+
→H+
4. 流程分析
Cl-
SO42-
Na+
Ca2+
含杂质Mg2+、Ca2+ 、SO42-
Mg2+
4. 流程分析
Cl-
4
SO
2-
Na+
Ca2+
Ba2+
加入过量的BaCl2溶液
Mg2+
Ba2+
BaSO4
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
NaCl
BaSO4
MgCl2
CaCl2
BaSO4
第1步
BaCl2
4. 流程分析
Cl
-
Na+
Ca2+
OH-
OH-
OH-
OH-
2+
Mg
Mg(OH)2
Ba2+
过量
NaOH
BaSO4
Mg(OH)2
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
NaCl
BaSO4
Mg(OH)2
CaCl2
BaCl2
NaOH
4. 流程分析
Cl-
Na+
Ca
2+
2+
Ba
OH-
OH-
CO32-
CO32-
CO32-
CaCO3
BaCO3
CaCO3
BaCO3
BaSO4
Mg(OH)2
BaCO3
CaCO3
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
加入过量的Na2CO3溶液
第3步
过量
NaOH
NaCl
MgCl2
Na2SO4
CaCl2
过量
BaCl2
BaSO4
Mg(OH)2
NaCl
NaOH
过量
Na2CO3
Na2CO3
过滤
4. 流程分析
Cl-
Na+
OH
-
OH
-
3
CO
2-
H+
H+
H+
H+
H2CO3
H2O
H2O
H2O
CO2
加入过量的BaCl2溶液
第1步
加入过量的NaOH溶液
第2步
加入过量的Na2CO3溶液
第3步
加入过量的稀盐酸
第4步
NaCl
NaOH
Na2CO3
过量
稀盐酸
NaCl
HCl
蒸发结晶
NaCl
晶体
精盐
NaCl
①过量BaCl2溶液
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
②过滤
滤液
( Na+、Cl-、 CO32-、OH-)
③过量稀HCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
【小结】除杂可选用合适的试剂,将杂质转化为沉淀、气体或水而除去。
④加热浓缩、
蒸发结晶
【总结】粗盐的提纯
Na2SO4+BaCl2=BaSO4↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
Na2CO3溶液、
NaOH溶液
1. 除去食盐水中CaCl2和Na2SO4杂质的操作有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是(提示:BaSO4、BaCO3难溶于水) ( )
A. ③①②⑤④ B. ①⑤③②④ C. ①③⑤④② D. ①③②⑤④
2. 食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为_______________。
D
NaCl和Na2CO3
3.硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某Na2SO4粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:____________________________________、____________________________________。
(2)NaOH和Na2CO3如果添加过量了,可加入适量_________ 溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至___(填序号)
A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
Na2CO3+CaCl2=CaCO3↓+2NaCl
稀H2SO4
C
同课章节目录
