2023浙江中考一轮复习 第32课时 常见的化合物(一)(课件 68张ppt)
文档属性
| 名称 | 2023浙江中考一轮复习 第32课时 常见的化合物(一)(课件 68张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-06 14:11:40 | ||
图片预览








文档简介
(共68张PPT)
第32课时 常见的化合物(一)
H+
无色
黄色
(含Fe3+)
无色
刺激性
易
不易
H+
红
NaCl+H2O
CuSO4+2H2O
CuCl2+H2O
Fe2(SO4)3+3H2O
ZnCl2+H2↑
FeSO4+H2↑
AgCl↓+HNO3
BaSO4↓+2HNO3
酸碱度
pH试纸
标准比色卡
红色
蓝色
无色
有刺激性
易挥发
将浓硫酸沿着容器壁慢慢
注入水中,并用玻璃棒不断搅拌
C
Zn+H2SO4===ZnSO4+H2↑
氢氧根离子
极易
微
烧碱
熟石灰
蓝
红
Na2SO3+H2O
CaSO3↓+H2O
CaCO3↓+H2O
Na2SO4+Cu(OH)2↓
3NaCl+Fe(OH)3↓
2NaOH+CaCO3↓
全部是OH-
腐蚀性
OH-
中和酸性土壤(或中和酸性废液等)
CuSO4+Ca(OH)2===Cu(OH)2↓+CaSO4(X是可
溶性铜盐即可)
CO2能溶于水且能与水反
应
取A瓶中少量液体于试管中,滴
加足量的稀盐酸,观察到有气泡产生(或取A瓶中少
量液体于试管中,滴加氯化钡溶液,观察到有白色
沉淀产生)
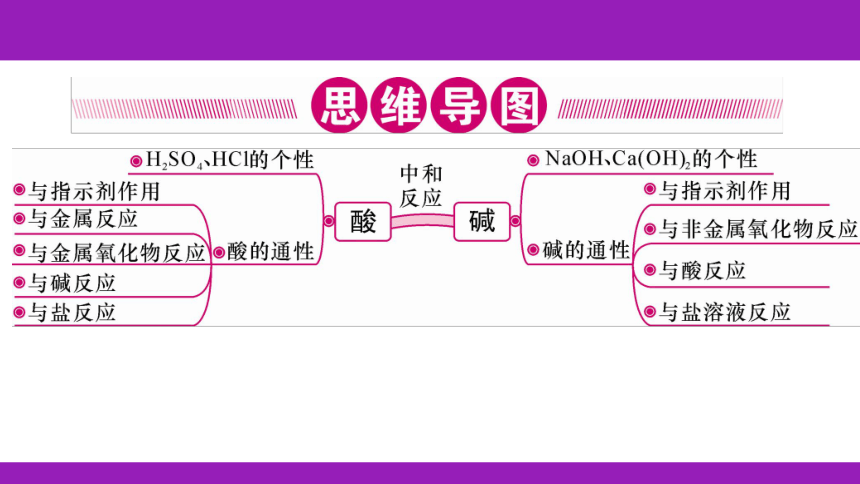
酸与碱作用生成盐和水的反应
H++OH-===H2O
C
两者恰好完全反应
该实验结论错误,
因为盐酸和氢氧化钡反应会生成氯化钡,无论盐酸
是否过量,都会有白色沉淀生成
先出现气泡,后出现
白色沉淀
AC
C
例1 C 【解析】A.稀H2SO4与紫色石蕊试液反应
后,溶液变红色,故选项说法错误。B.若能与X反
应制取H2,则X不可能是Cu,在金属活动性顺序
中,铜的位置排在氢的后面,不与稀硫酸反应,故
选项说法错误。C.稀硫酸和金属氧化物反应,有盐
和水生成,故选项说法正确。D.若与Y发生中和反
应,但Y不一定是NaOH,也可能是氢氧化钙等
碱,故选项说法错误。故选C。
A
D
例2 D 【解析】A、氢氧化钠先和硫酸反应生成
硫酸钠和水,反应的化学方程式及其质量关系:
2NaOH+H2SO4===Na2SO4+2H2O
80 98 142
随着反应进行,溶质质量增大,完全反应后氢氧化
钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应
的化学方程式及其质量关系:
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 80 98
随着反应进行,溶质质量减小,完全反应后继续加
入氢氧化钠溶液,溶质质量增大,乙代表溶质质
量,该选项说法正确;B.Q点时,硫酸、硫酸铜与
氢氧化钠完全反应,溶液中溶质为Na2SO4,该选项
说法正确;C.O→P过程反应的化学方程式为
2NaOH+H2SO4===Na2SO4+2H2O,该选项说法正
确;D.由图中信息可知,硫酸和硫酸铜消耗氢氧化
钠质量相等,则原溶液中CuSO4质量大于H2SO4质
量,该选项说法不正确。故选D。
C
稀盐酸
NaCl和HCl
盐酸与氢氧化
钠反应放出热量,溶液温度逐渐上升,完全反应
时,溶液温度升到最高
例3 (1)稀盐酸 NaCl和HCl (2)盐酸与氢氧化钠
反应放出热量,溶液温度逐渐上升,完全反应时,
溶液温度升到最高
【解析】(1)由图可知,该反应是向氢氧化钠溶液中
加入稀盐酸,胶头滴管中液体为稀盐酸,150秒时
烧杯中溶液pH小于7,则含有的溶质是NaCl和
HCl;(2)盐酸与氢氧化钠反应属于中和反应,中和
反应为放热反应,故烧杯内溶液温度逐渐上升,当
完全反应时,溶液温度升到最高。
A
C
例4 C 【解析】盛有硫酸和硫酸铜混合溶液的烧
杯中滴入Ba(OH)2溶液,钡离子和硫酸根离子直接
结合产生硫酸钡沉淀,氢离子和一部分氢氧根离子
直接结合产生水,另一部分氢氧根离子与铜离子结
合生成氢氧化铜沉淀。A.a→b段产生沉淀,沉淀的
质量不一定大于加入的溶液中所含水的质量,故溶
液的质量不一定减小,说法错误;B.氢氧化钡先和
硫酸反应生成硫酸钡沉淀和水,再与硫酸铜反应生
成氢氧化铜沉
淀和硫酸钡沉淀,所以b→c段是氢氧化钡和硫酸铜
的反应,没有水生成,说法错误;C.反应开始是钡
离子和硫酸根离子直接结合产生硫酸钡沉淀,氢离
子和氢氧根离子直接结合产生水,故达到b点时阳
离子只剩下铜离子,故溶质为硫酸铜,说法正确;
D.b点开始硫酸铜和氢氧化钡反应继续产生沉淀,c
点沉淀大于b点沉淀,而c点沉淀和d点沉淀质量
相等,故d点沉淀质量大于b点沉淀质量,说法错
误。故选C。
C
例5 C 【解析】一定温度下,向ag FeCl3溶液中
加入NaOH固体,氢氧化钠与氯化铁反应生成氢氧
化铁沉淀和氯化钠,则开始加入的ng氢氧化钠与氯
化铁溶液反应生成氢氧化铁沉淀和氯化钠,由图像
可知,Fe(OH)3沉淀完全时消耗NaOH的质量为
ng;再加入的(m-n)g氢氧化钠固体溶解于水中,
当加到mg氢氧化钠固体时,溶液的质量不再增
加,说明氢氧化钠溶液已达到饱和状态,即P点对
应的溶液中
NaOH达到饱和状态。A.由以上分析可知,Fe(OH)3
沉淀完全时消耗NaOH的质量为ng,选项说法正
确;B.由以上分析可知,P点对应的溶液中NaOH
达到饱和状态,选项说法正确;C.由化学方程式
FeCl3+3NaOH=Fe(OH)3↓+3NaCl可知,加入氢
氧化钠固体的质量并不是溶液增重的质量,即m≠c
-a,选项说法错误;D.由质量守恒定律可知,当加
入的氢氧化钠固体与氯化铁溶液恰好反应时,氯化
铁溶液的质量
与加入的氢氧化钠固体质量的总和等于生成氢氧化
铁沉淀的质量与氯化钠溶液质量的总和,即ag+ng
=生成Fe(OH)3沉淀质量+bg,则生成Fe(OH)3的
质量为(n-b+a)g,选项说法正确。故选C。
C
A
D
C
D
5.D 【解析】A.M点时,氧化铜部分反应,剩余
固体是铜和氧化铜,该选项说法正确;B.M点时氧
化铜部分反应,N点时氧化铜完全反应,溶液中的
溶质均只有CuCl2,该选项说法正确;C.N点时,
氧化铜恰好完全反应,溶液显中性,pH=7。P点
时,稀盐酸过量,溶液显酸性,pH小于7,溶液的
pH是N>P,该选项说法正确;D.混合物中铜的质
量为bg,该选项说法不正确。故选D。
C
6.C 【解析】A.0~t1段曲线呈现这种形态,是因
为还没有注入氢氧化钠溶液,该选项说法不正确;
B.t1~t2段曲线呈现这种形态,是因为注入氢氧化钠
溶液后,未进行振荡,少量的二氧化碳和氢氧化钠
发生了反应,该选项说法不正确;C.a、b、c三种
曲线所示的实验中,t3时烧瓶内压强由大到小的顺
序是a>b>c,该选项说法正确;D.a、b、c三种曲
线所示的实验中,t3时被吸收的二氧化碳的体积由
大到小
的顺序是c>b>a,该选项说法不正确。故选C。
烧碱、火碱、苛性钠
氯化
钠
MgCl2+
2NaOH===Mg(OH)2↓+2NaCl
Mg(OH)2
Zn+H2SO4===ZnSO4+H2↑
产生黑色固体
引流
CO2
NaOH、Na2CO3、
Na2SO4
【答案】设反应生成的氯化钠的质量为x
Na2SO4+BaCl2===BaSO4↓+2NaCl
233 117
4.66克 x
= x=2.34克
设反应生成的氯化钠的质量为y
Na2CO3+BaCl2===BaCO3↓+2NaCl
197 117
7.88克 y
= y=4.68克
氯化钠的质量为2.34克+4.68克=7.02克
谢谢观看
第32课时 常见的化合物(一)
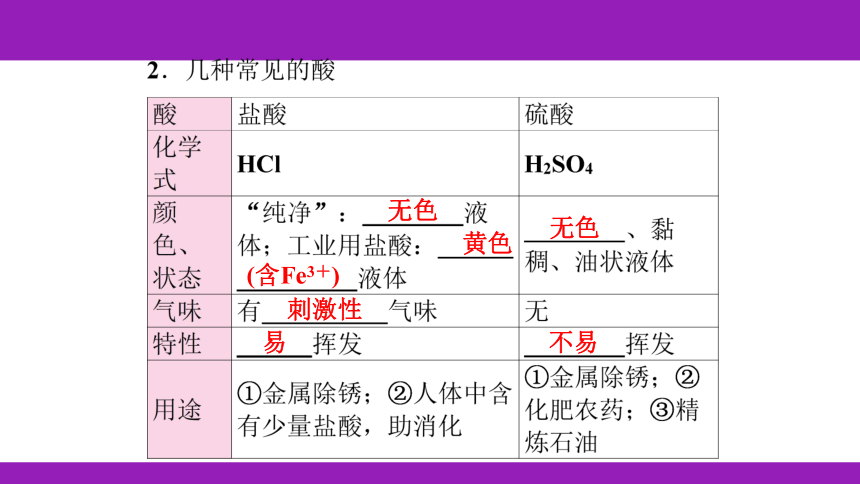
H+
无色
黄色
(含Fe3+)
无色
刺激性
易
不易
H+
红
NaCl+H2O
CuSO4+2H2O
CuCl2+H2O
Fe2(SO4)3+3H2O
ZnCl2+H2↑
FeSO4+H2↑
AgCl↓+HNO3
BaSO4↓+2HNO3
酸碱度
pH试纸
标准比色卡
红色
蓝色
无色
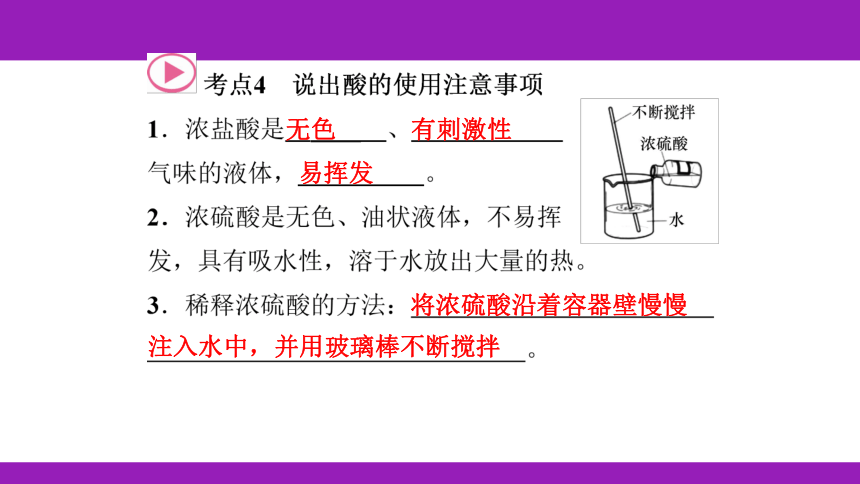
有刺激性
易挥发
将浓硫酸沿着容器壁慢慢
注入水中,并用玻璃棒不断搅拌
C
Zn+H2SO4===ZnSO4+H2↑
氢氧根离子
极易
微
烧碱
熟石灰
蓝
红
Na2SO3+H2O
CaSO3↓+H2O
CaCO3↓+H2O
Na2SO4+Cu(OH)2↓
3NaCl+Fe(OH)3↓
2NaOH+CaCO3↓
全部是OH-
腐蚀性
OH-
中和酸性土壤(或中和酸性废液等)
CuSO4+Ca(OH)2===Cu(OH)2↓+CaSO4(X是可
溶性铜盐即可)
CO2能溶于水且能与水反
应
取A瓶中少量液体于试管中,滴
加足量的稀盐酸,观察到有气泡产生(或取A瓶中少
量液体于试管中,滴加氯化钡溶液,观察到有白色
沉淀产生)
酸与碱作用生成盐和水的反应
H++OH-===H2O
C
两者恰好完全反应
该实验结论错误,
因为盐酸和氢氧化钡反应会生成氯化钡,无论盐酸
是否过量,都会有白色沉淀生成
先出现气泡,后出现
白色沉淀
AC
C
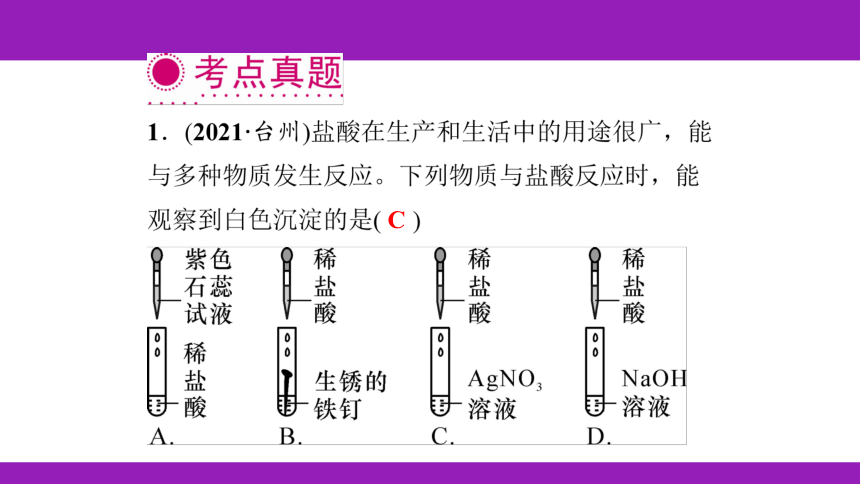
例1 C 【解析】A.稀H2SO4与紫色石蕊试液反应
后,溶液变红色,故选项说法错误。B.若能与X反
应制取H2,则X不可能是Cu,在金属活动性顺序
中,铜的位置排在氢的后面,不与稀硫酸反应,故
选项说法错误。C.稀硫酸和金属氧化物反应,有盐
和水生成,故选项说法正确。D.若与Y发生中和反
应,但Y不一定是NaOH,也可能是氢氧化钙等
碱,故选项说法错误。故选C。
A
D
例2 D 【解析】A、氢氧化钠先和硫酸反应生成
硫酸钠和水,反应的化学方程式及其质量关系:
2NaOH+H2SO4===Na2SO4+2H2O
80 98 142
随着反应进行,溶质质量增大,完全反应后氢氧化
钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应
的化学方程式及其质量关系:
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 80 98
随着反应进行,溶质质量减小,完全反应后继续加
入氢氧化钠溶液,溶质质量增大,乙代表溶质质
量,该选项说法正确;B.Q点时,硫酸、硫酸铜与
氢氧化钠完全反应,溶液中溶质为Na2SO4,该选项
说法正确;C.O→P过程反应的化学方程式为
2NaOH+H2SO4===Na2SO4+2H2O,该选项说法正
确;D.由图中信息可知,硫酸和硫酸铜消耗氢氧化
钠质量相等,则原溶液中CuSO4质量大于H2SO4质
量,该选项说法不正确。故选D。
C
稀盐酸
NaCl和HCl
盐酸与氢氧化
钠反应放出热量,溶液温度逐渐上升,完全反应
时,溶液温度升到最高
例3 (1)稀盐酸 NaCl和HCl (2)盐酸与氢氧化钠
反应放出热量,溶液温度逐渐上升,完全反应时,
溶液温度升到最高
【解析】(1)由图可知,该反应是向氢氧化钠溶液中
加入稀盐酸,胶头滴管中液体为稀盐酸,150秒时
烧杯中溶液pH小于7,则含有的溶质是NaCl和
HCl;(2)盐酸与氢氧化钠反应属于中和反应,中和
反应为放热反应,故烧杯内溶液温度逐渐上升,当
完全反应时,溶液温度升到最高。
A
C
例4 C 【解析】盛有硫酸和硫酸铜混合溶液的烧
杯中滴入Ba(OH)2溶液,钡离子和硫酸根离子直接
结合产生硫酸钡沉淀,氢离子和一部分氢氧根离子
直接结合产生水,另一部分氢氧根离子与铜离子结
合生成氢氧化铜沉淀。A.a→b段产生沉淀,沉淀的
质量不一定大于加入的溶液中所含水的质量,故溶
液的质量不一定减小,说法错误;B.氢氧化钡先和
硫酸反应生成硫酸钡沉淀和水,再与硫酸铜反应生
成氢氧化铜沉
淀和硫酸钡沉淀,所以b→c段是氢氧化钡和硫酸铜
的反应,没有水生成,说法错误;C.反应开始是钡
离子和硫酸根离子直接结合产生硫酸钡沉淀,氢离
子和氢氧根离子直接结合产生水,故达到b点时阳
离子只剩下铜离子,故溶质为硫酸铜,说法正确;
D.b点开始硫酸铜和氢氧化钡反应继续产生沉淀,c
点沉淀大于b点沉淀,而c点沉淀和d点沉淀质量
相等,故d点沉淀质量大于b点沉淀质量,说法错
误。故选C。
C
例5 C 【解析】一定温度下,向ag FeCl3溶液中
加入NaOH固体,氢氧化钠与氯化铁反应生成氢氧
化铁沉淀和氯化钠,则开始加入的ng氢氧化钠与氯
化铁溶液反应生成氢氧化铁沉淀和氯化钠,由图像
可知,Fe(OH)3沉淀完全时消耗NaOH的质量为
ng;再加入的(m-n)g氢氧化钠固体溶解于水中,
当加到mg氢氧化钠固体时,溶液的质量不再增
加,说明氢氧化钠溶液已达到饱和状态,即P点对
应的溶液中
NaOH达到饱和状态。A.由以上分析可知,Fe(OH)3
沉淀完全时消耗NaOH的质量为ng,选项说法正
确;B.由以上分析可知,P点对应的溶液中NaOH
达到饱和状态,选项说法正确;C.由化学方程式
FeCl3+3NaOH=Fe(OH)3↓+3NaCl可知,加入氢
氧化钠固体的质量并不是溶液增重的质量,即m≠c
-a,选项说法错误;D.由质量守恒定律可知,当加
入的氢氧化钠固体与氯化铁溶液恰好反应时,氯化
铁溶液的质量
与加入的氢氧化钠固体质量的总和等于生成氢氧化
铁沉淀的质量与氯化钠溶液质量的总和,即ag+ng
=生成Fe(OH)3沉淀质量+bg,则生成Fe(OH)3的
质量为(n-b+a)g,选项说法正确。故选C。
C
A
D
C
D
5.D 【解析】A.M点时,氧化铜部分反应,剩余
固体是铜和氧化铜,该选项说法正确;B.M点时氧
化铜部分反应,N点时氧化铜完全反应,溶液中的
溶质均只有CuCl2,该选项说法正确;C.N点时,
氧化铜恰好完全反应,溶液显中性,pH=7。P点
时,稀盐酸过量,溶液显酸性,pH小于7,溶液的
pH是N>P,该选项说法正确;D.混合物中铜的质
量为bg,该选项说法不正确。故选D。
C
6.C 【解析】A.0~t1段曲线呈现这种形态,是因
为还没有注入氢氧化钠溶液,该选项说法不正确;
B.t1~t2段曲线呈现这种形态,是因为注入氢氧化钠
溶液后,未进行振荡,少量的二氧化碳和氢氧化钠
发生了反应,该选项说法不正确;C.a、b、c三种
曲线所示的实验中,t3时烧瓶内压强由大到小的顺
序是a>b>c,该选项说法正确;D.a、b、c三种曲
线所示的实验中,t3时被吸收的二氧化碳的体积由
大到小
的顺序是c>b>a,该选项说法不正确。故选C。
烧碱、火碱、苛性钠
氯化
钠
MgCl2+
2NaOH===Mg(OH)2↓+2NaCl
Mg(OH)2
Zn+H2SO4===ZnSO4+H2↑
产生黑色固体
引流
CO2
NaOH、Na2CO3、
Na2SO4
【答案】设反应生成的氯化钠的质量为x
Na2SO4+BaCl2===BaSO4↓+2NaCl
233 117
4.66克 x
= x=2.34克
设反应生成的氯化钠的质量为y
Na2CO3+BaCl2===BaCO3↓+2NaCl
197 117
7.88克 y
= y=4.68克
氯化钠的质量为2.34克+4.68克=7.02克
谢谢观看
同课章节目录
