2023浙江中考一轮复习 第33课时 常见的化合物(二)(课件 59张ppt)
文档属性
| 名称 | 2023浙江中考一轮复习 第33课时 常见的化合物(二)(课件 59张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 97.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-01-06 14:13:20 | ||
图片预览








文档简介
(共59张PPT)
第33课时 常见的化合物(二)
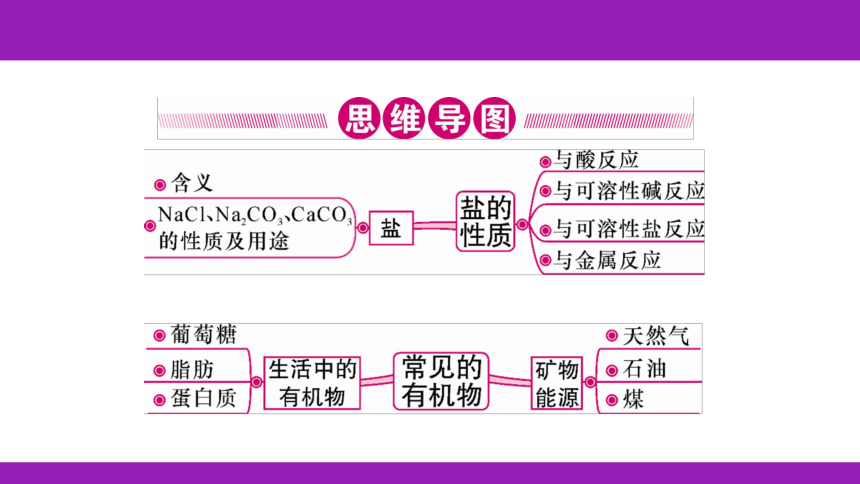
碱
性
2NaCl
+CO2↑
+H2O
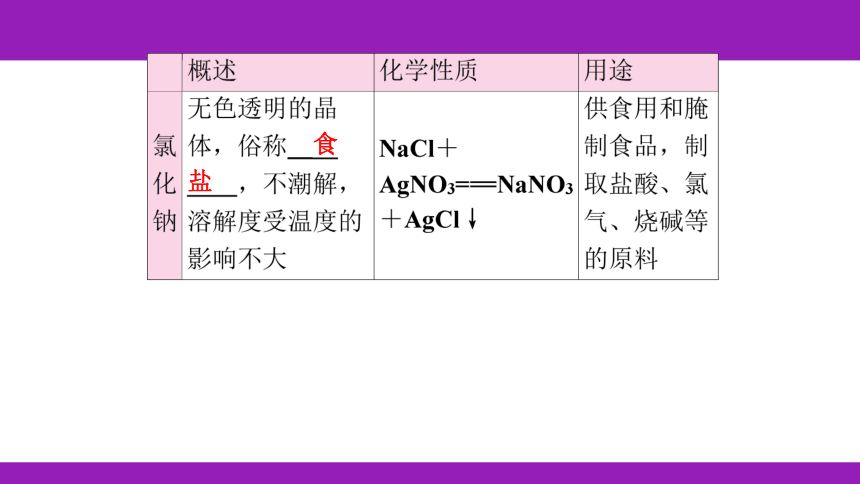
食
盐
易
溶
不溶
AgCl
BaSO4
活泼
酸
盐
两种新盐
AgNO3
Ba(NO3)2
稀盐酸
C
D
蛋白质
C、H
有机物
燃烧产物为二氧化碳和水
可燃
4H2+CO2CH4+2H2O
A、C
BaSO4
BaCl2
+Na2CO3===BaCO3↓+2NaCl
钾离子未除去
例1 (1)BaSO4
(2)BaCl2+Na2CO3BaCO3↓+2NaCl
(3)钾离子未除去
【解析】(1)粗盐水中有少量含S、K+的杂质,加入过量
氯化钡,Ba2+与S结合生成硫酸钡白色沉淀,化学式为B
aSO4;(2)溶液A中有过量氯化钡,加入过量碳酸钠溶液,氯
化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,化学方程式
为BaCl2+Na2CO3BaCO3↓+2NaCl;(3)溶液B中含过量
的碳酸钠,还有氯化钠和K+,加过量盐酸,碳酸钠与盐酸反
应生成氯化钠、水和二氧化碳,溶液C含有氯化钠、过量
的盐酸和K+,若将溶液C蒸发至出现大量固体时停止加
热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净
的氯化钠,理由是钾离子未除去。
D
A
例2 A 【解析】A.四种离子间不能结合成沉淀、
气体或水,能大量共存,且不存在有色离子,故选
项符合题意;B.Ag+和Cl-两种离子能结合成氯化银
沉淀,不能大量共存,故选项不符合题意;
C.N、OH-两种离子能结合成氨气,不能大量共
存,故选项不符合题意;D.四种离子间不能结合成
沉淀、气体或水,能大量共存,但铁离子是有色离
子,故选项不符合题意。故选A。
B
B
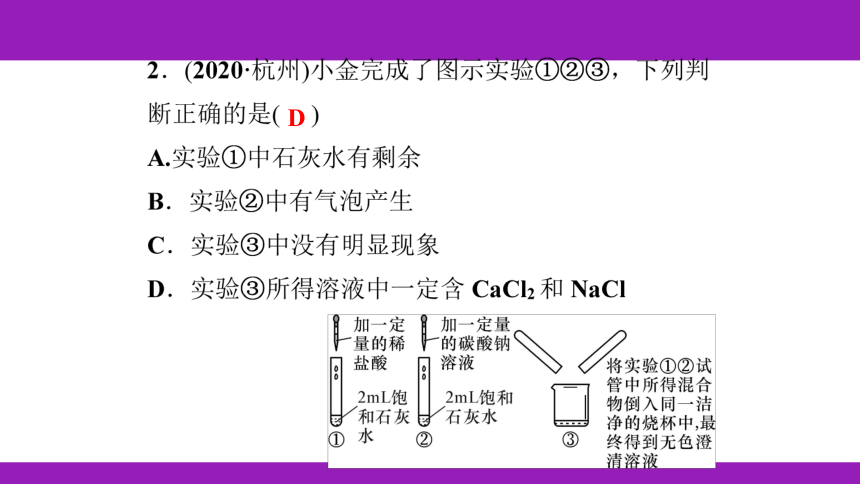
例3 B 【解析】鉴别碳酸钠和氢氧化钠时,除用
指示剂,检验碳酸根的存在,利用提示的试剂可选
①氯化钡溶液(与碳酸钠反应有沉淀生成,与氢氧化
钠不反应)或④稀盐酸(与碳酸钠反应有气泡生成,
与氢氧化钠反应,但无明显现象);鉴别氢氧化钠与
氢氧化钙溶液,可选②碳酸钠(与氢氧化钙反应有沉
淀生成,与氢氧化钠不反应)或③二氧化碳(与氢氧
化钙反应有沉淀生成,与氢氧化钠反应,但无明显
现象);
鉴别氢氧化钙和氯化钙,只能选择③二氧化碳(与氢
氧化钙反应有沉淀生成,与氯化钙不反应);鉴别盐
酸和硫酸只能选择①氯化钡溶液(与硫酸反应有沉淀
生成,与盐酸不反应)。综上所述,顺序为④②③
①。
Na2CO3和Na2SO4
BaCl2、NaOH;
BaCl2、NaOH、NaNO3
①②
③⑤
2C8H10+21O216CO2+10H2O
密封保存、严禁烟
火
例4 (1)①②③⑤
(2)2C8H10+21O216CO2+10H2O
(3)密封保存、严禁烟火
【解析】(1)PX的颜色、状态、熔点、沸点、密
度、气味、挥发性等性质不需要通过化学变化表现
出来,属于物理性质。
(2)PX在空气中完全燃烧能够生成水和二氧化碳,
反应的化学方程式为2C8H10+21O216CO2+
10H2O。
(3)根据PX的性质可知,它有毒,具有挥发性,遇
火可以爆炸,所以应该密封保存、严禁烟火。
一种无色、无味的气体
难溶于水
在1500℃以上的高温下能分解为碳和氢气
充分
燃烧后生成二氧化碳和水
①②
C3H8+
5O23CO2+4H2O
C
NaCl~AgCl
58.5 143.5
11.7g x
= x=28.7g
例5 C 【解析】取该样品11.7克溶于适量水中,得到澄清的无色溶液,说明一定不含有蓝色的氯化铜溶液,故A错误;然后向其中加入足量AgNO3溶液,得到30.7克白色沉淀,假设11.7g是纯的氯化钠,生成氯化银的质量为x
设纯净的氯化镁反应生成氯化银沉淀的质量为y
MgCl2~2AgCl
95 287
11.7g y
= y≈35.3g
设纯净的氯化钡反应生成氯化银沉淀的质量为z
BaCl2~2AgCl
208 287
11.7g z
=,z≈16.1g
因为纯氯化钠与AgNO3反应产生的沉淀是28.7g,故
一定有MgCl2,可能有BaCl2,故选C。
A
C
B
B
A
产生白
色沉淀
Mg(NO3)2和MgSO4
产
生蓝色沉淀
CuSO4+
2NaOH===Cu(OH)2↓+Na2SO4
酸
NaCl
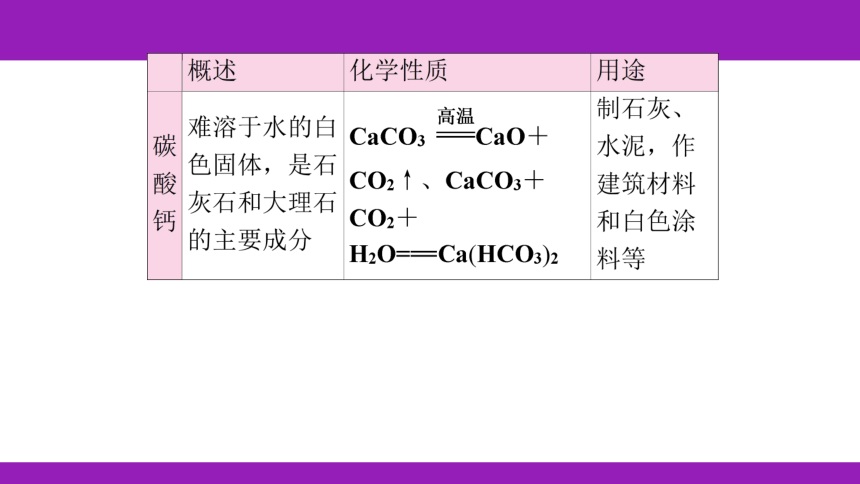
Ca(OH)2+K2CO3===CaCO3↓+2KOH
KOH、K2CO3
作钾肥
玻璃棒
Na2CO3+CaCl2===CaCO3↓+2NaCl或
BaCl2+Na2CO3===BaCO3↓+2NaCl
氯化钙、氯化镁、氯化钡
二
人体内温度不能达到
50℃或人体的胃内有盐酸
【答案】mCO2=105g-100g=5g
2NaHCO3+H2SO4===Na2SO4+2H2O+2CO2↑
168 88
x 5g
= x≈9.55g
碳酸氢钠的质量分数为×100%≈95.5%,包装
袋上的标注不准确。
偏大
谢谢观看
第33课时 常见的化合物(二)
碱
性
2NaCl
+CO2↑
+H2O
食
盐
易
溶
不溶
AgCl
BaSO4
活泼
酸
盐
两种新盐
AgNO3
Ba(NO3)2
稀盐酸
C
D
蛋白质
C、H
有机物
燃烧产物为二氧化碳和水
可燃
4H2+CO2CH4+2H2O
A、C
BaSO4
BaCl2
+Na2CO3===BaCO3↓+2NaCl
钾离子未除去
例1 (1)BaSO4
(2)BaCl2+Na2CO3BaCO3↓+2NaCl
(3)钾离子未除去
【解析】(1)粗盐水中有少量含S、K+的杂质,加入过量
氯化钡,Ba2+与S结合生成硫酸钡白色沉淀,化学式为B
aSO4;(2)溶液A中有过量氯化钡,加入过量碳酸钠溶液,氯
化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,化学方程式
为BaCl2+Na2CO3BaCO3↓+2NaCl;(3)溶液B中含过量
的碳酸钠,还有氯化钠和K+,加过量盐酸,碳酸钠与盐酸反
应生成氯化钠、水和二氧化碳,溶液C含有氯化钠、过量
的盐酸和K+,若将溶液C蒸发至出现大量固体时停止加
热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净
的氯化钠,理由是钾离子未除去。
D
A
例2 A 【解析】A.四种离子间不能结合成沉淀、
气体或水,能大量共存,且不存在有色离子,故选
项符合题意;B.Ag+和Cl-两种离子能结合成氯化银
沉淀,不能大量共存,故选项不符合题意;
C.N、OH-两种离子能结合成氨气,不能大量共
存,故选项不符合题意;D.四种离子间不能结合成
沉淀、气体或水,能大量共存,但铁离子是有色离
子,故选项不符合题意。故选A。
B
B
例3 B 【解析】鉴别碳酸钠和氢氧化钠时,除用
指示剂,检验碳酸根的存在,利用提示的试剂可选
①氯化钡溶液(与碳酸钠反应有沉淀生成,与氢氧化
钠不反应)或④稀盐酸(与碳酸钠反应有气泡生成,
与氢氧化钠反应,但无明显现象);鉴别氢氧化钠与
氢氧化钙溶液,可选②碳酸钠(与氢氧化钙反应有沉
淀生成,与氢氧化钠不反应)或③二氧化碳(与氢氧
化钙反应有沉淀生成,与氢氧化钠反应,但无明显
现象);
鉴别氢氧化钙和氯化钙,只能选择③二氧化碳(与氢
氧化钙反应有沉淀生成,与氯化钙不反应);鉴别盐
酸和硫酸只能选择①氯化钡溶液(与硫酸反应有沉淀
生成,与盐酸不反应)。综上所述,顺序为④②③
①。
Na2CO3和Na2SO4
BaCl2、NaOH;
BaCl2、NaOH、NaNO3
①②
③⑤
2C8H10+21O216CO2+10H2O
密封保存、严禁烟
火
例4 (1)①②③⑤
(2)2C8H10+21O216CO2+10H2O
(3)密封保存、严禁烟火
【解析】(1)PX的颜色、状态、熔点、沸点、密
度、气味、挥发性等性质不需要通过化学变化表现
出来,属于物理性质。
(2)PX在空气中完全燃烧能够生成水和二氧化碳,
反应的化学方程式为2C8H10+21O216CO2+
10H2O。
(3)根据PX的性质可知,它有毒,具有挥发性,遇
火可以爆炸,所以应该密封保存、严禁烟火。
一种无色、无味的气体
难溶于水
在1500℃以上的高温下能分解为碳和氢气
充分
燃烧后生成二氧化碳和水
①②
C3H8+
5O23CO2+4H2O
C
NaCl~AgCl
58.5 143.5
11.7g x
= x=28.7g
例5 C 【解析】取该样品11.7克溶于适量水中,得到澄清的无色溶液,说明一定不含有蓝色的氯化铜溶液,故A错误;然后向其中加入足量AgNO3溶液,得到30.7克白色沉淀,假设11.7g是纯的氯化钠,生成氯化银的质量为x
设纯净的氯化镁反应生成氯化银沉淀的质量为y
MgCl2~2AgCl
95 287
11.7g y
= y≈35.3g
设纯净的氯化钡反应生成氯化银沉淀的质量为z
BaCl2~2AgCl
208 287
11.7g z
=,z≈16.1g
因为纯氯化钠与AgNO3反应产生的沉淀是28.7g,故
一定有MgCl2,可能有BaCl2,故选C。
A
C
B
B
A
产生白
色沉淀
Mg(NO3)2和MgSO4
产
生蓝色沉淀
CuSO4+
2NaOH===Cu(OH)2↓+Na2SO4
酸
NaCl
Ca(OH)2+K2CO3===CaCO3↓+2KOH
KOH、K2CO3
作钾肥
玻璃棒
Na2CO3+CaCl2===CaCO3↓+2NaCl或
BaCl2+Na2CO3===BaCO3↓+2NaCl
氯化钙、氯化镁、氯化钡
二
人体内温度不能达到
50℃或人体的胃内有盐酸
【答案】mCO2=105g-100g=5g
2NaHCO3+H2SO4===Na2SO4+2H2O+2CO2↑
168 88
x 5g
= x≈9.55g
碳酸氢钠的质量分数为×100%≈95.5%,包装
袋上的标注不准确。
偏大
谢谢观看
同课章节目录
