2.1.3 活化能 课件(共21张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 2.1.3 活化能 课件(共21张PPT)化学(人教版)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 14:30:38 | ||
图片预览








文档简介
(共21张PPT)
活化能(第3课时)
化学(人教版)选择性必修1 第二章 第一节 第三课时
复习回顾
对于在某体积固定的密闭容器进行的合成氨反应,
①增大H2浓度,反应速率________________;
②升高温度,反应速率___________,正反应速率__________,
逆反应速率________.
③使用更高效催化剂,反应速率_________,正反应速率________,
逆反应速率__________.
增大
增大
增大
增大
增大
增大
增大
2021诺贝尔化学奖公布,
发明新催化剂2学者获奖
表彰两人在构建分子领域的贡献,促成
开发第三类催化剂“不对称有机催化剂(asymmetric organocatalysis)”
生活中环绕有许多催化剂。
通过汽车排气管中的金属催化剂——可以将废气中的有害物质转换成无害分子,又或是我们人体内的各种酶——帮助我们分解消化食物、新陈代谢等等。在这些过程中“催化剂”是控制与改变化学反应重要物质。
化学反应过程中的反应物分子断键和生成物分子成键
分子碰撞
反应历程
基元反应
碰撞理论
2HI = H2 + I2 是分两步完成的:
①2HI→H2 +2I·(自由基) ②2I·→I2
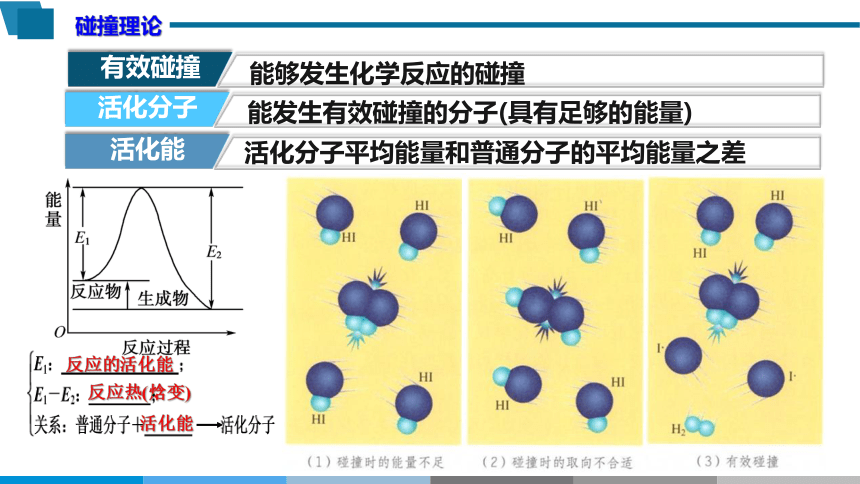
能够发生化学反应的碰撞
有效碰撞
碰撞理论
能够发生化学反应的碰撞
有效碰撞
碰撞理论
活化分子
活化能
能发生有效碰撞的分子(具有足够的能量)
活化分子平均能量和普通分子的平均能量之差
活化能
反应的活化能
反应热(焓变)
碰撞理论
不发生化学反应
无效碰撞
普通分子
发生化学反应
有效碰撞
活化分子
取向合适
取向不合适
活
化
能
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
运用碰撞理论解释:对于在某体积固定的密闭容器进行的合成氨反应,
增大H2浓度,反应速率增大;升高温度,反应速率增大。
改变因素 分子总数 活化分子百分数 活化分子数 反应速率
增大H2浓度
升高温度
增大
不变
增大
增大
增大
不变
增大
增大
——普通分子
——活化分子
催化剂
催化剂
SO2(g)+1/2O2(g) ===SO3(g)
2VO2+1/2O2 = V2O5
SO2+V2O5 = 2VO2+SO3
A
B
催化剂能改变反应历程
SO2(g)
+ 1/2O2(g)
SO3(g)
能量
SO2(g)
+ 1/2O2(g)
SO3(g)
反应过程
E1
E2
E3
通过改变反应历程降低反应活化能
[例题]Ni可活化C2H6放出CH4,其反应历程如下图所示:
下列关于活化历程的说法错误的是( )
A.决速步骤:中间体2→中间体3 B.总反应为Ni+C2H6→NiCH2+CH4
C.Ni-H键的形成有利于原子的迁移 D.涉及非极性键的断裂和生成
D
催化剂
催化剂
阅读课文p27 了解催化剂在现代化学工业和研究中作用
阅读课文p28 科学 技术 社会 了解飞秒化学
课堂小结
改变浓度
改变压强
改变温度
催化剂
课堂练习
1.下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
课堂练习
2.在有气体参加的反应中,能使反应物中活化分子总数和活化分子百分数都增大的措施有( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A.①②
B.②④
C.①③
D.③④
课堂练习
课堂练习
课堂练习
课堂练习
课堂练习
答案
1.C
2.D
3.C
4.D
5.C
6.C
7.B
活化能(第3课时)
化学(人教版)选择性必修1 第二章 第一节 第三课时
复习回顾
对于在某体积固定的密闭容器进行的合成氨反应,
①增大H2浓度,反应速率________________;
②升高温度,反应速率___________,正反应速率__________,
逆反应速率________.
③使用更高效催化剂,反应速率_________,正反应速率________,
逆反应速率__________.
增大
增大
增大
增大
增大
增大
增大
2021诺贝尔化学奖公布,
发明新催化剂2学者获奖
表彰两人在构建分子领域的贡献,促成
开发第三类催化剂“不对称有机催化剂(asymmetric organocatalysis)”
生活中环绕有许多催化剂。
通过汽车排气管中的金属催化剂——可以将废气中的有害物质转换成无害分子,又或是我们人体内的各种酶——帮助我们分解消化食物、新陈代谢等等。在这些过程中“催化剂”是控制与改变化学反应重要物质。
化学反应过程中的反应物分子断键和生成物分子成键
分子碰撞
反应历程
基元反应
碰撞理论
2HI = H2 + I2 是分两步完成的:
①2HI→H2 +2I·(自由基) ②2I·→I2
能够发生化学反应的碰撞
有效碰撞
碰撞理论
能够发生化学反应的碰撞
有效碰撞
碰撞理论
活化分子
活化能
能发生有效碰撞的分子(具有足够的能量)
活化分子平均能量和普通分子的平均能量之差
活化能
反应的活化能
反应热(焓变)
碰撞理论
不发生化学反应
无效碰撞
普通分子
发生化学反应
有效碰撞
活化分子
取向合适
取向不合适
活
化
能
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
运用碰撞理论解释:对于在某体积固定的密闭容器进行的合成氨反应,
增大H2浓度,反应速率增大;升高温度,反应速率增大。
改变因素 分子总数 活化分子百分数 活化分子数 反应速率
增大H2浓度
升高温度
增大
不变
增大
增大
增大
不变
增大
增大
——普通分子
——活化分子
催化剂
催化剂
SO2(g)+1/2O2(g) ===SO3(g)
2VO2+1/2O2 = V2O5
SO2+V2O5 = 2VO2+SO3
A
B
催化剂能改变反应历程
SO2(g)
+ 1/2O2(g)
SO3(g)
能量
SO2(g)
+ 1/2O2(g)
SO3(g)
反应过程
E1
E2
E3
通过改变反应历程降低反应活化能
[例题]Ni可活化C2H6放出CH4,其反应历程如下图所示:
下列关于活化历程的说法错误的是( )
A.决速步骤:中间体2→中间体3 B.总反应为Ni+C2H6→NiCH2+CH4
C.Ni-H键的形成有利于原子的迁移 D.涉及非极性键的断裂和生成
D
催化剂
催化剂
阅读课文p27 了解催化剂在现代化学工业和研究中作用
阅读课文p28 科学 技术 社会 了解飞秒化学
课堂小结
改变浓度
改变压强
改变温度
催化剂
课堂练习
1.下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
课堂练习
2.在有气体参加的反应中,能使反应物中活化分子总数和活化分子百分数都增大的措施有( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A.①②
B.②④
C.①③
D.③④
课堂练习
课堂练习
课堂练习
课堂练习
课堂练习
答案
1.C
2.D
3.C
4.D
5.C
6.C
7.B
