2.1.2 影响化学反应速率的因素 课件(共23张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 2.1.2 影响化学反应速率的因素 课件(共23张PPT)化学(人教版)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 636.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
化学(人教版)选择性必修1 第二章 第一节 第二课时
影响化学反应速率的因素
工业生产合成氨
N2(g) +3H2(g) 2NH3(g)
高温高压
催化剂
科学史话
影响化学反应速率的因素
科学探究的基本步骤
提出问题
收集化学
事实和信息
实验探究
得出结论
设计
实验方案
提出假设
哪些因素会影响化学反应速率?
影响化学反应速率的因素
收集化学
事实和信息
Na与水的反应比Mg与水的反应剧烈
夏天食物变质快
食物真空保存变质慢
向H2O2中加入MnO2后会迅速分解产生气泡
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快
反应物本身的性质
提出假设
温度
反应物的浓度
催化剂
接触面积
内因
外因
影响化学反应速率的因素
设计
实验方案
在探究某一条件对化学反应速率的影响时,要保证其他条件完全相同,即采用“变量控制法”。
任务1 任务2 任务3
待研究的变量
需控制不变的量
温度
催化剂
浓度
温度、浓度等
温度、催化剂等
催化剂、浓度等
思考:如何借助反应现象来体现化学反应速率?
颜色变化快慢,产生气泡快慢,产生浑浊快慢,固体减少快慢等
影响化学反应速率的因素
设计
实验方案
选择实验用品,设计实验探究影响化学反应速率的因素
任务1 任务2 任务3
待研究的变量
需控制不变的量
探究的反应
观察的现象
温度
催化剂
浓度
温度、浓度等
温度、催化剂等
催化剂、浓度等
实验用品:烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
2H2O2 = O2↑ + 2H2O
产生浑浊快慢
产生气泡快慢
影响化学反应速率的因素
实验探究
浓度对化学反应速率的影响
影响因素 实验步骤 实验现象 实验结论
浓度
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
均出现浑浊,但后者出现浑浊更快
增大反应物浓度,化学反应速率增大
影响化学反应速率的因素
实验探究
浓度对化学反应速率的影响
(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。
(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。
(3)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
影响化学反应速率的因素
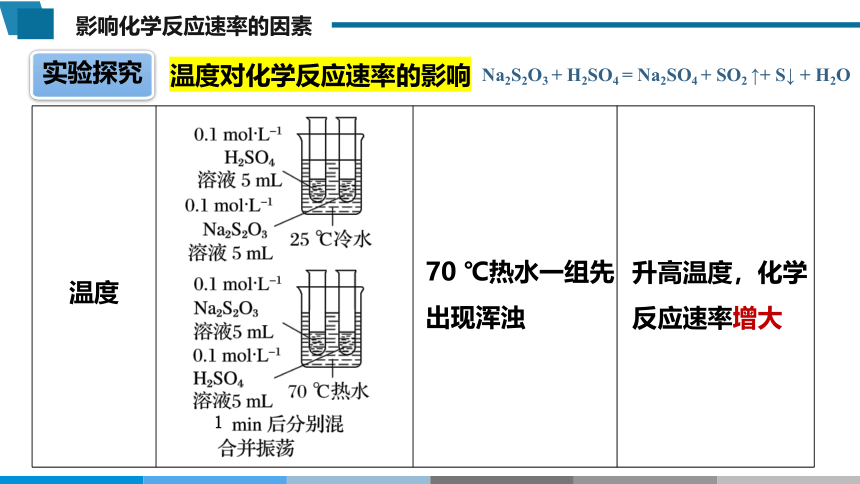
实验探究
温度对化学反应速率的影响
温度
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
70 ℃热水一组先出现浑浊
升高温度,化学反应速率增大
1
影响化学反应速率的因素
实验探究
温度对化学反应速率的影响
(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
(2)温度对反应速率的影响,无论固体、液体、气体都适用。
(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
影响化学反应速率的因素
实验探究
催化剂对化学反应速率的影响
2H2O2 = O2↑ + 2H2O
催化剂
前者无明显现象,后者出现大量气泡
催化剂能加快化学反应速率
影响化学反应速率的因素
实验探究
催化剂对化学反应速率的影响
(1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。
(2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。
工业生产合成氨
N2(g) +3H2(g) 2NH3(g)
高温高压
催化剂
回归生产
条件分析:
高温、高压、催化剂是为了增大工业合成氨的反应速率
为什么高压可以加快工业合成氨的化学反应速率?
影响化学反应速率的因素
动画展示
压强对化学反应速率的影响
通过缩小容器体积使压强增大,气体分子间间隙减小,相当于增大反应物浓度,化学反应速率加快
如果压缩固体或液体呢?
体积变化不明显
压强对反应速率的影响是通过浓度对反应的影响实现的
影响化学反应速率的因素
得出结论
(1)内因:反应物本身的 是影响化学反应速率的主要因素。
(2)外因(其他条件不变,只改变一个条件)
加快
减小
加快
减小
减小
表面积
性质
定性研究
定量研究
有没有比观察沉淀和气泡生成快慢更准确的方法来分析实验结果呢?
决定性因素。
影响化学反应速率的因素
定量研究浓度对化学反应速率的影响
实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。根据产生相同体积的氢气所需要的时间来判断化学反应速率的快慢。
实验结论:在其他条件不变时,反应物浓度越高,反应速率越大。
影响化学反应速率的因素
【思考】在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?
①锌的颗粒(即表面积)大小基本相同;
②稀硫酸要迅速加入;
③装置气密性良好,且计时要迅速准确。
(2)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?
①在恒容反应装置中,测定一段时间内压强的变化;
②测定一段时间内H+的浓度变化;
③测定一段时间内锌粒的质量变化。
影响化学反应速率的因素
(1)内因:反应物本身的 是影响化学反应速率的主要因素。
(2)外因(其他条件不变,只改变一个条件)
加快
减小
加快
减小
减小
表面积
性质
实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
随堂练习
1.控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是
A.浓度 B.温度 C.催化剂 D.固体质量
√
随堂练习
2.在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一
定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应
速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次
平衡时反应速率一定加快
√
随堂练习
3.亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量ClO2,这是因为
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
√
随堂练习
4.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液 B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液 D.5 mL 10% H2O2溶液
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
√
随堂练习
5.碳酸钙与稀盐酸反应(放热反应)生成CO2的
量与反应时间的关系如图所示,下列结论错
误的是
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=
0.1 mol·min-1
√
化学(人教版)选择性必修1 第二章 第一节 第二课时
影响化学反应速率的因素
工业生产合成氨
N2(g) +3H2(g) 2NH3(g)
高温高压
催化剂
科学史话
影响化学反应速率的因素
科学探究的基本步骤
提出问题
收集化学
事实和信息
实验探究
得出结论
设计
实验方案
提出假设
哪些因素会影响化学反应速率?
影响化学反应速率的因素
收集化学
事实和信息
Na与水的反应比Mg与水的反应剧烈
夏天食物变质快
食物真空保存变质慢
向H2O2中加入MnO2后会迅速分解产生气泡
将等质量的铁片与铁粉放入稀硫酸中,铁粉产生气泡较快
反应物本身的性质
提出假设
温度
反应物的浓度
催化剂
接触面积
内因
外因
影响化学反应速率的因素
设计
实验方案
在探究某一条件对化学反应速率的影响时,要保证其他条件完全相同,即采用“变量控制法”。
任务1 任务2 任务3
待研究的变量
需控制不变的量
温度
催化剂
浓度
温度、浓度等
温度、催化剂等
催化剂、浓度等
思考:如何借助反应现象来体现化学反应速率?
颜色变化快慢,产生气泡快慢,产生浑浊快慢,固体减少快慢等
影响化学反应速率的因素
设计
实验方案
选择实验用品,设计实验探究影响化学反应速率的因素
任务1 任务2 任务3
待研究的变量
需控制不变的量
探究的反应
观察的现象
温度
催化剂
浓度
温度、浓度等
温度、催化剂等
催化剂、浓度等
实验用品:烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
2H2O2 = O2↑ + 2H2O
产生浑浊快慢
产生气泡快慢
影响化学反应速率的因素
实验探究
浓度对化学反应速率的影响
影响因素 实验步骤 实验现象 实验结论
浓度
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
均出现浑浊,但后者出现浑浊更快
增大反应物浓度,化学反应速率增大
影响化学反应速率的因素
实验探究
浓度对化学反应速率的影响
(1)固体和纯液体的浓度可视为常数,改变其物质的量,对反应速率无影响。
(2)若某物质的浓度变化改变了其性质,反应实质可能发生改变,要具体分析反应速率的变化(如铁与稀硫酸反应,在一定浓度范围内反应速率与浓度有关,但常温下铁遇浓硫酸钝化)。
(3)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
影响化学反应速率的因素
实验探究
温度对化学反应速率的影响
温度
Na2S2O3 + H2SO4 = Na2SO4 + SO2 ↑+ S↓ + H2O
70 ℃热水一组先出现浑浊
升高温度,化学反应速率增大
1
影响化学反应速率的因素
实验探究
温度对化学反应速率的影响
(1)温度对反应速率的影响适用于任何反应,无论是放热反应还是吸热反应,升高温度,反应速率都增大,降低温度,反应速率都减小。
(2)温度对反应速率的影响,无论固体、液体、气体都适用。
(3)大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍,利用这一规律可以对一些化学反应速率进行粗略估算。
影响化学反应速率的因素
实验探究
催化剂对化学反应速率的影响
2H2O2 = O2↑ + 2H2O
催化剂
前者无明显现象,后者出现大量气泡
催化剂能加快化学反应速率
影响化学反应速率的因素
实验探究
催化剂对化学反应速率的影响
(1)催化剂只能改变化学反应速率,不能改变反应方向,也不能改变反应热的大小。
(2)同一催化剂能同等程度地改变化学反应的正、逆反应速率。
工业生产合成氨
N2(g) +3H2(g) 2NH3(g)
高温高压
催化剂
回归生产
条件分析:
高温、高压、催化剂是为了增大工业合成氨的反应速率
为什么高压可以加快工业合成氨的化学反应速率?
影响化学反应速率的因素
动画展示
压强对化学反应速率的影响
通过缩小容器体积使压强增大,气体分子间间隙减小,相当于增大反应物浓度,化学反应速率加快
如果压缩固体或液体呢?
体积变化不明显
压强对反应速率的影响是通过浓度对反应的影响实现的
影响化学反应速率的因素
得出结论
(1)内因:反应物本身的 是影响化学反应速率的主要因素。
(2)外因(其他条件不变,只改变一个条件)
加快
减小
加快
减小
减小
表面积
性质
定性研究
定量研究
有没有比观察沉淀和气泡生成快慢更准确的方法来分析实验结果呢?
决定性因素。
影响化学反应速率的因素
定量研究浓度对化学反应速率的影响
实验操作:按如图所示安装两套装置A、B,在锥形瓶内各盛大小相同的2 g锌粒,通过分液漏斗分别加入40 mL 1 mol·L-1和40 mL 4 mol·L-1的硫酸溶液。根据产生相同体积的氢气所需要的时间来判断化学反应速率的快慢。
实验结论:在其他条件不变时,反应物浓度越高,反应速率越大。
影响化学反应速率的因素
【思考】在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?
①锌的颗粒(即表面积)大小基本相同;
②稀硫酸要迅速加入;
③装置气密性良好,且计时要迅速准确。
(2)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?
①在恒容反应装置中,测定一段时间内压强的变化;
②测定一段时间内H+的浓度变化;
③测定一段时间内锌粒的质量变化。
影响化学反应速率的因素
(1)内因:反应物本身的 是影响化学反应速率的主要因素。
(2)外因(其他条件不变,只改变一个条件)
加快
减小
加快
减小
减小
表面积
性质
实际生产生活中,影响一个化学反应速率的因素可能是多方面的。
随堂练习
1.控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是
A.浓度 B.温度 C.催化剂 D.固体质量
√
随堂练习
2.在一密闭容器中充入1 mol H2和1 mol I2,在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0。下列说法正确的是
A.保持容器容积不变,向其中加入1 mol H2(g),反应速率加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一
定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应
速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),再次
平衡时反应速率一定加快
√
随堂练习
3.亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量ClO2,这是因为
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
√
随堂练习
4.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
A.5 mL 2% H2O2溶液 B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液 D.5 mL 10% H2O2溶液
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
√
随堂练习
5.碳酸钙与稀盐酸反应(放热反应)生成CO2的
量与反应时间的关系如图所示,下列结论错
误的是
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=
0.1 mol·min-1
√
