2.2.2 化学平衡常数 课件(共27张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 2.2.2 化学平衡常数 课件(共27张PPT)化学(人教版)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 14:32:46 | ||
图片预览








文档简介
(共27张PPT)
化学平衡常数
化学(人教版)选择性必修1 第二章 第二节 第二课时
课堂引入
可逆反应到达平衡状态的标志:
(1)ν正= ν逆≠0
(2)各组分浓度(或含量)保持不变
能否从定量的角度研究一个可逆反应是否到达平衡状态呢?
——化学平衡常数
课堂引入
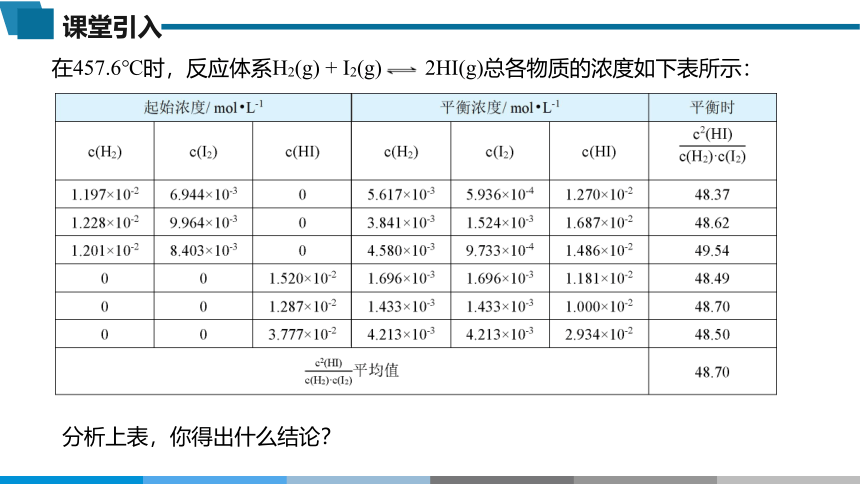
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)总各物质的浓度如下表所示:
分析上表,你得出什么结论?
课前引入
通过分析实验数据得出:
结论2:常数与反应物的起始浓度大小无关;
与正向建立还是逆向建立平衡无关。
c2(HI)
c(H2) · c(I2)
结论1: 为常数
浓度商的概念与表达式
一、浓度商的概念与表达式
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g),浓度商Q = 。
在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,常用Q表示。
1.浓度商的概念
化学平衡常数的概念与表达式
二、化学平衡常数的概念与表达式
1.化学平衡常数的概念
在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,该常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示。
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g),化学平衡常数K= 。
化学平衡常数的概念与表达式
【思考】浓度商与平衡常数有什么区别?
1. 在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,都为浓度商,而化学平衡常数,则是在一定温度下,可逆反应达到平衡时的浓度商。
2. 当反应中有关物质的浓度商等于平衡常数时,表明该反应已达到化学平衡状态。
随堂练习
写出下列反应的化学平衡常数:
1. 固体或液体纯物质一般不列入浓度商和平衡常数。
2. 当H2O为液态时,其浓度为固定常数,不能代入平衡常数表达式;
当H2O是气态时,则需要代入平衡常数表达式。
【注意】
c(H2)·c(I2)
c2(HI)
c(H2O)
c(CO) · c(H2)
思考交流
写出下列平衡常数表达式,并思考,K1、K2、K3之间有何关系?
c(H2)·c(I2)
c2(HI)
c(H2)·c(I2)
c2(HI)
c2 (H2)·c2 (I2)
c4(HI)
平衡常数与方程式的关系
三、平衡常数与方程式的关系
1.对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
2.若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
3.若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。
随堂练习
已知方程式A(g) C(g) K1 和 B(g) D(g) K2
用K1、K2表示下列反应的平衡常数。
(1)C(g) A(g) K3 = __________
(2)2B(g) 2D(g) K4 = __________
(3)A(g) + B(g) C(g) + D(g) K5 = __________
(4)2A(g) + D(g) B(g) + 2C(g) K6 = __________
1/ K1
K1·K2
K2
2
K1/K2
2
平衡常数的影响因素及意义
四、平衡常数的影响因素及意义
1.化学平衡常数的影响因素
化学平衡常数是表明化学反应限度的一个特征值,通常情况下只受________影响。
温度
只要温度不变,化学平衡常数就不变。哪怕改变浓度等。
温度不变,化学平衡常数不变。可以利用这一点求相同温度下,不同体系的平衡状态。
典例详解
【例1】在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入10 L 的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.0080 mol·L-1:
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.2 mol,试求达到化学平衡时各物质的浓度。
【解】(1)依题意可知,平衡时c(H2)=0.0080 mol·L-1
I2(g) + H2(g) 2HI(g)
起始浓度/(mol·L-1) 0.010 0.010 0
变化浓度/(mol·L-1)
平衡浓度/(mol·L-1)
K=
c(H2)·c(I2)
c2(HI)
=
(0.0080)2
(0.0040)2
= 0.25
0.0020
0.0080
0.0040
0.0080
0.0040
0.0020
典例详解
【例1】在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入10 L 的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.0080 mol·L-1:
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.2 mol,试求达到化学平衡时各物质的浓度。
I2(g) + H2(g) 2HI(g)
【解】(2)依题意可知,c(H2)=0.020 mol·L-1,c(I2)=0.020 mol·L-1mol·L-1。
起始浓度/(mol·L-1) 0.020 0.020 0
变化浓度/(mol·L-1) x x 2x
平衡浓度/(mol·L-1) 0.020-x 0.020-x 2x
K只随温度发生变化,因此:
K=
c(H2)·c(I2)
c2(HI)
=
(0.020-x)2
(2x)2
= 0.25
解得:x=0.0040
平衡时:c(H2)=c(I2)=0.016 mol·L-1,c(HI)=0.0080 mol·L-1
平衡常数的影响因素及意义
2.化学平衡常数的意义
(1)通常,K越大,说明平衡体系中________所占的比例越大,______反应进行的程度越大,即该反应进行得越完全,平衡时反应物的转化率越大;反之,K越小,该反应进行得越不完全,平衡时反应物的转化率越小。
(2)一般来说,当K>______时,该反应就进行得基本完全了。
生成物
正
105
平衡常数的影响因素及意义
3.化学平衡常数的应用
(1)判断正在进行的可逆反应进行的方向
Q < K:反应向正反应方向进行,v正 > v逆 ;
Q = K:反应处于化学平衡状态,v正 = v逆 ;
Q > K:反应向逆反应方向进行,v正 < v逆 。
典例详解
【例2】已知反应C(s)+H2O(g) CO(g)+H2(g) 的平衡常数K=1.0,某时刻H2O(g)、CO(g)、H2(g)的浓度分别为1.0mol/L,2.0mol/L,1.5mol/L。试回答:
(1)此时反应是否处于平衡状态?
(2)如果不平衡,此时反应朝哪个方向进行?
Q>K,v正<v逆,反应向逆方向进行
【解析】
Q=
c(CO)·c(H2)
c(C)· c(H2O)
=
2.0×1.5
1.0
=3.0 >K
平衡常数的影响因素及意义
3.化学平衡常数的应用
(2)用平衡常数计算反应物的平衡转化率
(1)判断正在进行的可逆反应进行的方向
Q < K:反应向正反应方向进行,v正 > v逆 ;
Q = K:反应处于化学平衡状态,v正 = v逆 ;
Q > K:反应向逆反应方向进行,v正 < v逆 。
典例详解
【例3】在容积不变的密闭容器中,将2.0 mol CO与10 mol H2O混合加热到830℃,达到下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g)此时该反应的K为1.0。求达到平衡时CO转化为CO2的转化率。
【解】设到达平衡时CO转化为CO2的物质的量为x mol,容器的容积为y L。
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1) 2.0/y 10/y 0 0
变化浓度/(mol·L-1) x/y x/y x/y x/y
平衡浓度/(mol·L-1) (2.0-x)/y (10-x)/y x/y x/y
x2=(2.0-x)(10-x)
=20-12x+x2
x=5/3
CO转化为CO2的转化率为:
mol/2.0mol×100%=83%
c(CO)· c(H2O)
c(CO2)· c(H2)
课堂小结
对点训练
1. 下列关于化学平衡常数的说法中正确的是( )
A. 在任何条件下,化学平衡常数都是一个定值
B. 由化学平衡常数K可以推断一个可逆反应进行的限度
C. 化学平衡常数K与温度、反应物浓度、体系的压强都有关
D. 当改变反应物的浓度时,化学平衡常数一定会发生改变
B
对点训练
C
对点训练
3. 某温度时N2+3H2 2NH3的平衡常数K=a,则此温度下NH3 H2+ N2的平衡常数为
A
对点训练
4.将4 mol SO2与2 mol O2放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K为
A.4 B.0.25 C.0.4 D.0.2
A
对点训练
5.在1 000 K时,已知反应Ni(s)+H2O(g) NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
A.已达到平衡状态
B.未达到平衡状态,反应正向进行
C.未达到平衡状态,反应逆向进行
D.无法确定
C
对点训练
6. 在773 K时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=9,若CO、H2O的起始浓度均为0.020 mol·L-1,则在此条件下CO的转化率是
A.60% B.50% C.75% D.25%
C
谢谢观看 !
人教版化学 选择性必修一 第二章 化学反应速率与化学平衡
第二节 化学平衡 第二课时 化学平衡常数
化学平衡常数
化学(人教版)选择性必修1 第二章 第二节 第二课时
课堂引入
可逆反应到达平衡状态的标志:
(1)ν正= ν逆≠0
(2)各组分浓度(或含量)保持不变
能否从定量的角度研究一个可逆反应是否到达平衡状态呢?
——化学平衡常数
课堂引入
在457.6℃时,反应体系H2(g) + I2(g) 2HI(g)总各物质的浓度如下表所示:
分析上表,你得出什么结论?
课前引入
通过分析实验数据得出:
结论2:常数与反应物的起始浓度大小无关;
与正向建立还是逆向建立平衡无关。
c2(HI)
c(H2) · c(I2)
结论1: 为常数
浓度商的概念与表达式
一、浓度商的概念与表达式
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g),浓度商Q = 。
在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,常用Q表示。
1.浓度商的概念
化学平衡常数的概念与表达式
二、化学平衡常数的概念与表达式
1.化学平衡常数的概念
在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,该常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示。
2.表达式
对于可逆反应mA(g) + nB(g) pC(g) + qD(g),化学平衡常数K= 。
化学平衡常数的概念与表达式
【思考】浓度商与平衡常数有什么区别?
1. 在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,都为浓度商,而化学平衡常数,则是在一定温度下,可逆反应达到平衡时的浓度商。
2. 当反应中有关物质的浓度商等于平衡常数时,表明该反应已达到化学平衡状态。
随堂练习
写出下列反应的化学平衡常数:
1. 固体或液体纯物质一般不列入浓度商和平衡常数。
2. 当H2O为液态时,其浓度为固定常数,不能代入平衡常数表达式;
当H2O是气态时,则需要代入平衡常数表达式。
【注意】
c(H2)·c(I2)
c2(HI)
c(H2O)
c(CO) · c(H2)
思考交流
写出下列平衡常数表达式,并思考,K1、K2、K3之间有何关系?
c(H2)·c(I2)
c2(HI)
c(H2)·c(I2)
c2(HI)
c2 (H2)·c2 (I2)
c4(HI)
平衡常数与方程式的关系
三、平衡常数与方程式的关系
1.对于同一可逆反应,正反应和逆反应的平衡常数互为倒数;
2.若化学方程式中各物质的化学计量数都扩大或缩小至原来的n倍,则化学平衡常数变为原来的 n 次幂或 1/n 次幂。
3.若干方程式相加,则总反应的平衡常数等于分步平衡常数之乘积;若干方程式相减,则总反应的平衡常数等于分步平衡常数之商。
随堂练习
已知方程式A(g) C(g) K1 和 B(g) D(g) K2
用K1、K2表示下列反应的平衡常数。
(1)C(g) A(g) K3 = __________
(2)2B(g) 2D(g) K4 = __________
(3)A(g) + B(g) C(g) + D(g) K5 = __________
(4)2A(g) + D(g) B(g) + 2C(g) K6 = __________
1/ K1
K1·K2
K2
2
K1/K2
2
平衡常数的影响因素及意义
四、平衡常数的影响因素及意义
1.化学平衡常数的影响因素
化学平衡常数是表明化学反应限度的一个特征值,通常情况下只受________影响。
温度
只要温度不变,化学平衡常数就不变。哪怕改变浓度等。
温度不变,化学平衡常数不变。可以利用这一点求相同温度下,不同体系的平衡状态。
典例详解
【例1】在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入10 L 的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.0080 mol·L-1:
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.2 mol,试求达到化学平衡时各物质的浓度。
【解】(1)依题意可知,平衡时c(H2)=0.0080 mol·L-1
I2(g) + H2(g) 2HI(g)
起始浓度/(mol·L-1) 0.010 0.010 0
变化浓度/(mol·L-1)
平衡浓度/(mol·L-1)
K=
c(H2)·c(I2)
c2(HI)
=
(0.0080)2
(0.0040)2
= 0.25
0.0020
0.0080
0.0040
0.0080
0.0040
0.0020
典例详解
【例1】在某温度下,将含有H2和I2各0.10 mol 的气态混合物充入10 L 的密闭容器中,充分反应并达到平衡后,测得c(H2)=0.0080 mol·L-1:
(1)计算该反应的平衡常数。
(2)在上述温度下,若起始时向该容器中通入H2和I2(g)各0.2 mol,试求达到化学平衡时各物质的浓度。
I2(g) + H2(g) 2HI(g)
【解】(2)依题意可知,c(H2)=0.020 mol·L-1,c(I2)=0.020 mol·L-1mol·L-1。
起始浓度/(mol·L-1) 0.020 0.020 0
变化浓度/(mol·L-1) x x 2x
平衡浓度/(mol·L-1) 0.020-x 0.020-x 2x
K只随温度发生变化,因此:
K=
c(H2)·c(I2)
c2(HI)
=
(0.020-x)2
(2x)2
= 0.25
解得:x=0.0040
平衡时:c(H2)=c(I2)=0.016 mol·L-1,c(HI)=0.0080 mol·L-1
平衡常数的影响因素及意义
2.化学平衡常数的意义
(1)通常,K越大,说明平衡体系中________所占的比例越大,______反应进行的程度越大,即该反应进行得越完全,平衡时反应物的转化率越大;反之,K越小,该反应进行得越不完全,平衡时反应物的转化率越小。
(2)一般来说,当K>______时,该反应就进行得基本完全了。
生成物
正
105
平衡常数的影响因素及意义
3.化学平衡常数的应用
(1)判断正在进行的可逆反应进行的方向
Q < K:反应向正反应方向进行,v正 > v逆 ;
Q = K:反应处于化学平衡状态,v正 = v逆 ;
Q > K:反应向逆反应方向进行,v正 < v逆 。
典例详解
【例2】已知反应C(s)+H2O(g) CO(g)+H2(g) 的平衡常数K=1.0,某时刻H2O(g)、CO(g)、H2(g)的浓度分别为1.0mol/L,2.0mol/L,1.5mol/L。试回答:
(1)此时反应是否处于平衡状态?
(2)如果不平衡,此时反应朝哪个方向进行?
Q>K,v正<v逆,反应向逆方向进行
【解析】
Q=
c(CO)·c(H2)
c(C)· c(H2O)
=
2.0×1.5
1.0
=3.0 >K
平衡常数的影响因素及意义
3.化学平衡常数的应用
(2)用平衡常数计算反应物的平衡转化率
(1)判断正在进行的可逆反应进行的方向
Q < K:反应向正反应方向进行,v正 > v逆 ;
Q = K:反应处于化学平衡状态,v正 = v逆 ;
Q > K:反应向逆反应方向进行,v正 < v逆 。
典例详解
【例3】在容积不变的密闭容器中,将2.0 mol CO与10 mol H2O混合加热到830℃,达到下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g)此时该反应的K为1.0。求达到平衡时CO转化为CO2的转化率。
【解】设到达平衡时CO转化为CO2的物质的量为x mol,容器的容积为y L。
CO(g) + H2O(g) CO2(g) + H2(g)
起始浓度/(mol·L-1) 2.0/y 10/y 0 0
变化浓度/(mol·L-1) x/y x/y x/y x/y
平衡浓度/(mol·L-1) (2.0-x)/y (10-x)/y x/y x/y
x2=(2.0-x)(10-x)
=20-12x+x2
x=5/3
CO转化为CO2的转化率为:
mol/2.0mol×100%=83%
c(CO)· c(H2O)
c(CO2)· c(H2)
课堂小结
对点训练
1. 下列关于化学平衡常数的说法中正确的是( )
A. 在任何条件下,化学平衡常数都是一个定值
B. 由化学平衡常数K可以推断一个可逆反应进行的限度
C. 化学平衡常数K与温度、反应物浓度、体系的压强都有关
D. 当改变反应物的浓度时,化学平衡常数一定会发生改变
B
对点训练
C
对点训练
3. 某温度时N2+3H2 2NH3的平衡常数K=a,则此温度下NH3 H2+ N2的平衡常数为
A
对点训练
4.将4 mol SO2与2 mol O2放入4 L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K为
A.4 B.0.25 C.0.4 D.0.2
A
对点训练
5.在1 000 K时,已知反应Ni(s)+H2O(g) NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
A.已达到平衡状态
B.未达到平衡状态,反应正向进行
C.未达到平衡状态,反应逆向进行
D.无法确定
C
对点训练
6. 在773 K时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=9,若CO、H2O的起始浓度均为0.020 mol·L-1,则在此条件下CO的转化率是
A.60% B.50% C.75% D.25%
C
谢谢观看 !
人教版化学 选择性必修一 第二章 化学反应速率与化学平衡
第二节 化学平衡 第二课时 化学平衡常数
