1.1.3 热化学方程式的书写 燃烧热 课件 (共23张PPT)化学(人教版)选择性必修1
文档属性
| 名称 | 1.1.3 热化学方程式的书写 燃烧热 课件 (共23张PPT)化学(人教版)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 14:33:42 | ||
图片预览








文档简介
(共23张PPT)
热化学方程式 燃烧热
化学(人教版)选择性必修1 第一章 第一节 第三课时
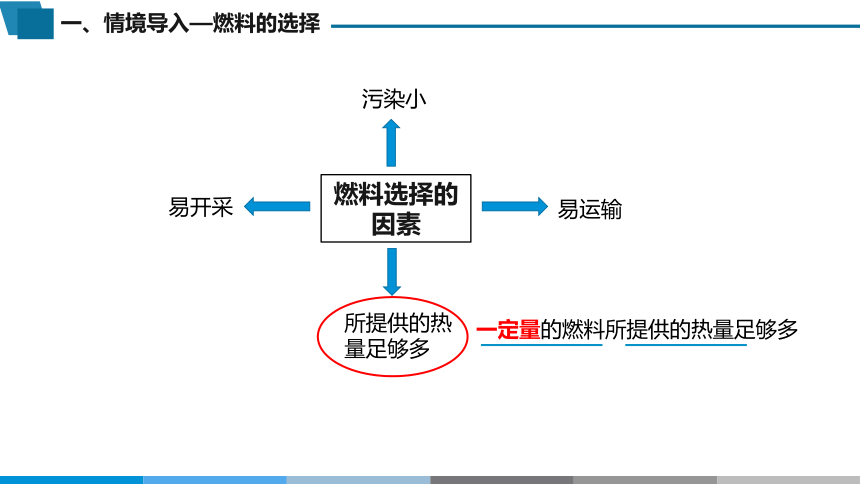
一、情境导入—燃料的选择
以上场景的热能都是由什么物质提供的呢?
天然气(CH4)
汽油(C5~C12烷烃类)
火箭推进剂
燃料选择的因素
所提供的热量足够多
污染小
易开采
易运输
一定量的燃料所提供的热量足够多
一、情境导入—燃料的选择
【知识回顾—焓变的计算】已知断裂1 mol H-H键、1 mol O=O键时所吸收的热量分别为436 kJ、496 kJ,形成1 mol O-H键时所释放的热量为463 kJ,计算以下化学反应的反应热:1 mol H2与0.5 mol O2反应生成H2O(g)
△H = E反应物断键 – E生成物成键
△H = (436+496/2) – 463×2 = – 242 kJ/mol
表示反应物的量与放出的热量之间的关系:
2H2(g)+ O2 (g) = 2H2O (g) △H = – 484 kJ/mol
H2(g)+O2(g)= H2O(g) △H = –242 kJ/mol
一、情境导入—燃料的选择
二、符号表征—热化学方程式
H2(g)+O2(g)= H2O(g) △H = –242 kJ/mol
H2(g)+O2(g)= H2O(l) △H = –286 kJ/mol
1、热化学方程式:能表明反应所释放或吸收的热量的化学方程式
2、热化学方程式的书写
物质后都用括号注明物质的聚集状态
不用注明反应条件
指明反应温度和压强(常温常压:25℃、101kPa 可以不注明)
方程式后正确书写焓变△H: “+、 –”、kJ/mol
同一个反应中,化学计量数与△H成正比,且可为整数或分数
2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
H2O(g) = H2O(l) △H = – 44 kJ/mol
g:气态 l:液态 s:固态 aq:溶液
①H2(g)+O2(g)= H2O(g) △H = – 242 kJ/mol
【思考】△H单位中“每摩尔”表示什么?
课本 P9:
答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。
对于反应①:1 mol H2(g) 与 mol O2(g)反应生成1 mol H2O(g)表示“每摩尔反应”,
“每摩尔反应”放出242 kJ的热量。
二、符号表征—热化学方程式
②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”,
“每摩尔反应”放出484 kJ的热量。
因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。
【课堂练习】判断热化学方程式是否正确,正确的打√,错误的打×。
(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol
(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ
(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则
2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol
( )
( )
( )
( )
×
物质状态、反应条件
×
△H 单位:kJ/mol
√
×
化学计量数与△H 不成正比
(4)500℃、101kpPa下,将2 mol SO2(g)与1 mol O2(g)置于密闭容器中充分反应生成
SO3(g)放热 a kJ,则2SO2(g) + O2(g) 2SO3(g) △H = – a kJ/mol
(1)4NH3 + 5O2 ==== 4NO + 6H2O △H = – 906.8 kJ/mol
催化剂
△
( )
×
可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化
二、符号表征—热化学方程式
(1)28 g CO(g)在氧气中燃烧生成CO2(g)放出283 kJ的热量
(2)11.2 L(标准状况)N2(g)在氧气中反应生成NO(g)放出68 kJ的热量
2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol
CO(g)+O2(g)= CO2(g) △H = –283 kJ/mol
【课堂练习】依据事实,写出下列反应的热化学方程式。
N2(g) + O2(g) = 2NO(g) △H = – 136 kJ/mol
二、符号表征—热化学方程式
N2(g) + O2(g)= NO(g) △H = –68 kJ/mol
三、反应热的应用—燃烧热
【思考】一定量的燃料燃烧到什么程度放出的热量多?
燃料完全燃烧生成指定的产物
H
C
S
N
H2O(l)
而不是H2O(g)
CO2 (g)
而不是CO(g)
SO2 (g)
N2 (g)
1、燃烧热:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量,
单位为 kJ/mol
【思考】根据燃烧热的定义,解释“甲烷的燃烧热为890 kJ/mol” 表示什么?
1 mol 甲烷完全燃烧生成CO2、液态H2O所放出的热量为890 kJ
而不是SO3(g)
【课堂练习】
下列热化学方程式中,ΔH 能正确表示物质的燃烧热的是( )
A. CH4(g)+O2(g) = CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
B. H2(g)+Cl2(g) = 2HCl(g) ΔH=-184.6 kJ·mol-1
C.CO(g)+ O2(g) = CO2(g)ΔH=-283.0 kJ·mol-1
D.2C8H18(l)+25O2(g) = 16CO2(g)+18H2O(l)ΔH=-11036 kJ·mol-1
C
产物应为CO2(g)
H2的燃烧热是指生成液态H2O的燃烧反应所放出的热量
燃料C8H18应为1 mol
燃烧热的热化学方程式
三、反应热的应用—燃烧热
(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ
(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJ
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
CO(g)+O2(g)= CO2(g) △H = – 283 kJ/mol
【课堂练习】依据事实,写出以下物质燃烧热的热化学方程式
2、燃烧热的热化学方程式:
以1 mol 燃料为标准配平方程式
完全燃烧生成指定产物
2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol
×
√
三、反应热的应用—燃烧热
【课堂练习】下列有关热化学方程式及其叙述正确的是( )
A.乙烷的燃烧热为-1559 kJ/mo1,则乙烷燃烧热的热化学方程式为:
2C2H6(g) + 7O2(g) = 4CO2(g) + 6H2O(1) △H= – 3118 kJ/mo1
B.1mol甲醇(l)完全燃烧生成CO2和H2O(1)时放出726 kJ热量,则其燃烧的热化学方程式为
2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol
C.已知2C(s) +O2(g) = 2CO(g) △H=-221kJ·mol-1,则C的燃烧热为110.5kJ/mo1
D.稀醋酸与NaOH溶液反应:H+(aq) + OH—(aq) = H2O(1) △H= – 57.3kJ/mol
B
A. 燃烧热的热化学方程式:
C2H6(g) + O2(g) = 2CO2(g) + 3H2O(1) △H= –1559 kJ/mo1
B. 燃烧的热化学方程式:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol
② CH3OH(l) + O2(g) = CO2(g) + 2H2O(1) △H= –726 kJ/mol
三、反应热的应用—燃烧热
弱酸
四、联系实际—燃料的选择
【思考】以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。
燃料 燃烧热(kJ/mol)
S(s) 296
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
大气污染,一般不作燃料
不易制备、运输,但无污染且燃烧热较大,是未来新能源
西气东输工程,家庭常用燃料
可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液体火箭推进剂的发展
液氧汽油
肼类燃料(肼、偏二甲肼)
四、联系实际—燃料的选择
2N2H4(l) + N2O4(l) = 3N2(g) + 4H2O(l) △H = – 1225 kJ/mol
液态肼为常用火箭燃料推进剂
稳定、易储存、燃烧热大、生成气体可作推进作用
四、联系实际—燃料的选择
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液体火箭推进剂的发展
液氧汽油
肼类燃料(肼、偏二甲肼)
液氧煤油
液氢液氧
“长征七号”运载火箭采用液氧煤油推进剂
“长征五号”运载火箭采用液氢液氧推进剂
四、联系实际—燃料的选择
【思考】根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)
完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。
燃料 燃烧热(kJ/mol) 1 g燃料完全燃烧放出的热量(kJ)
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
142.9
55.6
29.7
由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。
四、联系实际—燃料的选择
随堂练习
1.热化学方程式与普通化学方程式不同,下列有关热化学方程式
CO(g) + O2(g) = CO2(g) ΔH = -283.0 kJ·mol-1的说法错误的是 ( )
A.既表示化学反应中的物质变化,又表示化学反应中的能量变化
B.表示1 mol CO(g)与 mol O2(g)完全反应生成1 mol CO2(g)放出283.0 kJ的热量
C.一氧化碳的燃烧热为283.0 kJ·mol-1
D.CO与O2反应生成CO2只能实现化学能向热能的转化
随堂练习
2.燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是( )
A.燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B.实验测定H2的燃烧热时与所用H2量的多少无关
C.含碳物质燃烧生成1 mol CO2时所放出的热量是燃烧热
D.1 mol C燃烧生成CO时放出的热量是燃烧热
随堂练习
3.下列热化学方程式中的反应热为可燃物的燃烧热的是( )
A.H2(g) +O2(g) = H2O(g) △H =-241.8 kJ·mol—1
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H =-846.3 kJ·mol—1
C.C(s) + O2(g) = CO2(g) △H =-393.5 kJ·mol—1
D.C3H8(g) + 5O2(g) = 3CO(g) + 4H2O(l)△H = -2044.0 kJ·mol—1
随堂练习
4.1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为 ( )
A.C+H2O = CO+H2 ΔH= +131.3 kJ·mol-1
B.C(s)+H2O(g)= CO(g)+H2(g) ΔH= +10.94 kJ·mol-1
C.C(s)+H2O(l) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1
D.C(s)+H2O(g) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1
随堂练习
5.下列叙述正确的是( )
A.在25℃、101kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,则该反应热化学方程式为:2H2(g) + O2(g) = 2H2O(l) △H = -285.8 kJ·mol—1
B.500℃、30Mpa下,将0.5 mol N2与1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) △H = -38.6 kJ·mol—1
C.在稀溶液中,H+(aq) + OH-(aq) = H2O(l) △H = -57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.1 mol硫蒸气与1 mol硫粉完全燃烧放出的热量相同
随堂练习
参考答案:
1、D
2、B
3、C
4、D
5、C
热化学方程式 燃烧热
化学(人教版)选择性必修1 第一章 第一节 第三课时
一、情境导入—燃料的选择
以上场景的热能都是由什么物质提供的呢?
天然气(CH4)
汽油(C5~C12烷烃类)
火箭推进剂
燃料选择的因素
所提供的热量足够多
污染小
易开采
易运输
一定量的燃料所提供的热量足够多
一、情境导入—燃料的选择
【知识回顾—焓变的计算】已知断裂1 mol H-H键、1 mol O=O键时所吸收的热量分别为436 kJ、496 kJ,形成1 mol O-H键时所释放的热量为463 kJ,计算以下化学反应的反应热:1 mol H2与0.5 mol O2反应生成H2O(g)
△H = E反应物断键 – E生成物成键
△H = (436+496/2) – 463×2 = – 242 kJ/mol
表示反应物的量与放出的热量之间的关系:
2H2(g)+ O2 (g) = 2H2O (g) △H = – 484 kJ/mol
H2(g)+O2(g)= H2O(g) △H = –242 kJ/mol
一、情境导入—燃料的选择
二、符号表征—热化学方程式
H2(g)+O2(g)= H2O(g) △H = –242 kJ/mol
H2(g)+O2(g)= H2O(l) △H = –286 kJ/mol
1、热化学方程式:能表明反应所释放或吸收的热量的化学方程式
2、热化学方程式的书写
物质后都用括号注明物质的聚集状态
不用注明反应条件
指明反应温度和压强(常温常压:25℃、101kPa 可以不注明)
方程式后正确书写焓变△H: “+、 –”、kJ/mol
同一个反应中,化学计量数与△H成正比,且可为整数或分数
2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
H2O(g) = H2O(l) △H = – 44 kJ/mol
g:气态 l:液态 s:固态 aq:溶液
①H2(g)+O2(g)= H2O(g) △H = – 242 kJ/mol
【思考】△H单位中“每摩尔”表示什么?
课本 P9:
答:“每摩尔”不是指“每摩尔某物质”,而是指“每摩尔反应”。
对于反应①:1 mol H2(g) 与 mol O2(g)反应生成1 mol H2O(g)表示“每摩尔反应”,
“每摩尔反应”放出242 kJ的热量。
二、符号表征—热化学方程式
②2H2(g)+ O2(g) = 2H2O(g) △H = – 484 kJ/mol
对于反应②:2 mol H2(g) 与1 mol O2(g) 反应生成2 mol H2O(g)表示“每摩尔反应”,
“每摩尔反应”放出484 kJ的热量。
因此,书写热化学方程式时, △H 必须与化学方程式的化学计量数一一对应。
【课堂练习】判断热化学方程式是否正确,正确的打√,错误的打×。
(5)2H2(g) + O2(g) = 2H2O(l) △H = – 571.6 kJ/mol
(2)H2(g) + Cl2(g) = 2HCl(g) △H = – 183 kJ
(3)已知强酸与强碱稀溶液发生中和反应生成1mol H2O放热57.3 kJ,则
2KOH(aq) + H2SO4(aq) = K2SO4(aq) + 2H2O(l) △H = – 57.3 kJ/mol
( )
( )
( )
( )
×
物质状态、反应条件
×
△H 单位:kJ/mol
√
×
化学计量数与△H 不成正比
(4)500℃、101kpPa下,将2 mol SO2(g)与1 mol O2(g)置于密闭容器中充分反应生成
SO3(g)放热 a kJ,则2SO2(g) + O2(g) 2SO3(g) △H = – a kJ/mol
(1)4NH3 + 5O2 ==== 4NO + 6H2O △H = – 906.8 kJ/mol
催化剂
△
( )
×
可逆反应实际转化率<100%,热化学方程式指该反应完全进行的能量变化
二、符号表征—热化学方程式
(1)28 g CO(g)在氧气中燃烧生成CO2(g)放出283 kJ的热量
(2)11.2 L(标准状况)N2(g)在氧气中反应生成NO(g)放出68 kJ的热量
2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol
CO(g)+O2(g)= CO2(g) △H = –283 kJ/mol
【课堂练习】依据事实,写出下列反应的热化学方程式。
N2(g) + O2(g) = 2NO(g) △H = – 136 kJ/mol
二、符号表征—热化学方程式
N2(g) + O2(g)= NO(g) △H = –68 kJ/mol
三、反应热的应用—燃烧热
【思考】一定量的燃料燃烧到什么程度放出的热量多?
燃料完全燃烧生成指定的产物
H
C
S
N
H2O(l)
而不是H2O(g)
CO2 (g)
而不是CO(g)
SO2 (g)
N2 (g)
1、燃烧热:在101 kPa时,1 mol 纯物质完全燃烧生成指定产物时所放出的热量,
单位为 kJ/mol
【思考】根据燃烧热的定义,解释“甲烷的燃烧热为890 kJ/mol” 表示什么?
1 mol 甲烷完全燃烧生成CO2、液态H2O所放出的热量为890 kJ
而不是SO3(g)
【课堂练习】
下列热化学方程式中,ΔH 能正确表示物质的燃烧热的是( )
A. CH4(g)+O2(g) = CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
B. H2(g)+Cl2(g) = 2HCl(g) ΔH=-184.6 kJ·mol-1
C.CO(g)+ O2(g) = CO2(g)ΔH=-283.0 kJ·mol-1
D.2C8H18(l)+25O2(g) = 16CO2(g)+18H2O(l)ΔH=-11036 kJ·mol-1
C
产物应为CO2(g)
H2的燃烧热是指生成液态H2O的燃烧反应所放出的热量
燃料C8H18应为1 mol
燃烧热的热化学方程式
三、反应热的应用—燃烧热
(1)1 mol 甲烷在氧气中完全燃烧释放的能量为890 kJ
(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJ
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/mol
CO(g)+O2(g)= CO2(g) △H = – 283 kJ/mol
【课堂练习】依据事实,写出以下物质燃烧热的热化学方程式
2、燃烧热的热化学方程式:
以1 mol 燃料为标准配平方程式
完全燃烧生成指定产物
2CO(g)+ O2(g) = 2CO2(g) △H = – 566 kJ/mol
×
√
三、反应热的应用—燃烧热
【课堂练习】下列有关热化学方程式及其叙述正确的是( )
A.乙烷的燃烧热为-1559 kJ/mo1,则乙烷燃烧热的热化学方程式为:
2C2H6(g) + 7O2(g) = 4CO2(g) + 6H2O(1) △H= – 3118 kJ/mo1
B.1mol甲醇(l)完全燃烧生成CO2和H2O(1)时放出726 kJ热量,则其燃烧的热化学方程式为
2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol
C.已知2C(s) +O2(g) = 2CO(g) △H=-221kJ·mol-1,则C的燃烧热为110.5kJ/mo1
D.稀醋酸与NaOH溶液反应:H+(aq) + OH—(aq) = H2O(1) △H= – 57.3kJ/mol
B
A. 燃烧热的热化学方程式:
C2H6(g) + O2(g) = 2CO2(g) + 3H2O(1) △H= –1559 kJ/mo1
B. 燃烧的热化学方程式:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(1) △H= – 1452 kJ/mol
② CH3OH(l) + O2(g) = CO2(g) + 2H2O(1) △H= –726 kJ/mol
三、反应热的应用—燃烧热
弱酸
四、联系实际—燃料的选择
【思考】以下为部分燃料的燃烧热,结合燃料本身的特点及燃料的选择条件,讨论以下燃料的应用。
燃料 燃烧热(kJ/mol)
S(s) 296
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
大气污染,一般不作燃料
不易制备、运输,但无污染且燃烧热较大,是未来新能源
西气东输工程,家庭常用燃料
可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液体火箭推进剂的发展
液氧汽油
肼类燃料(肼、偏二甲肼)
四、联系实际—燃料的选择
2N2H4(l) + N2O4(l) = 3N2(g) + 4H2O(l) △H = – 1225 kJ/mol
液态肼为常用火箭燃料推进剂
稳定、易储存、燃烧热大、生成气体可作推进作用
四、联系实际—燃料的选择
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
液体火箭推进剂的发展
液氧汽油
肼类燃料(肼、偏二甲肼)
液氧煤油
液氢液氧
“长征七号”运载火箭采用液氧煤油推进剂
“长征五号”运载火箭采用液氢液氧推进剂
四、联系实际—燃料的选择
【思考】根据以下物质的燃烧热数据,计算相同质量的H2(g)、CH4(g)、C2H5OH(l)
完全燃烧放出的热量,说明用液氢作为火箭燃料的优点。
燃料 燃烧热(kJ/mol) 1 g燃料完全燃烧放出的热量(kJ)
H2(g) 285.8
CH4(g) 890.3
C2H5OH(l) 1366.8
142.9
55.6
29.7
由计算可知,相同质量的上述三种燃料, H2(g) 完全燃烧放出的热量最多,同时, H2(g) 燃烧产物无污染,这是用液氢作为火箭燃料的优点。
四、联系实际—燃料的选择
随堂练习
1.热化学方程式与普通化学方程式不同,下列有关热化学方程式
CO(g) + O2(g) = CO2(g) ΔH = -283.0 kJ·mol-1的说法错误的是 ( )
A.既表示化学反应中的物质变化,又表示化学反应中的能量变化
B.表示1 mol CO(g)与 mol O2(g)完全反应生成1 mol CO2(g)放出283.0 kJ的热量
C.一氧化碳的燃烧热为283.0 kJ·mol-1
D.CO与O2反应生成CO2只能实现化学能向热能的转化
随堂练习
2.燃烧是人们利用热能的重要方式。下列有关燃烧热的说法正确的是( )
A.燃烧热所指的燃烧产物一定是相应元素的最高价氧化物
B.实验测定H2的燃烧热时与所用H2量的多少无关
C.含碳物质燃烧生成1 mol CO2时所放出的热量是燃烧热
D.1 mol C燃烧生成CO时放出的热量是燃烧热
随堂练习
3.下列热化学方程式中的反应热为可燃物的燃烧热的是( )
A.H2(g) +O2(g) = H2O(g) △H =-241.8 kJ·mol—1
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H =-846.3 kJ·mol—1
C.C(s) + O2(g) = CO2(g) △H =-393.5 kJ·mol—1
D.C3H8(g) + 5O2(g) = 3CO(g) + 4H2O(l)△H = -2044.0 kJ·mol—1
随堂练习
4.1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为 ( )
A.C+H2O = CO+H2 ΔH= +131.3 kJ·mol-1
B.C(s)+H2O(g)= CO(g)+H2(g) ΔH= +10.94 kJ·mol-1
C.C(s)+H2O(l) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1
D.C(s)+H2O(g) = CO(g)+H2(g) ΔH= +131.3 kJ·mol-1
随堂练习
5.下列叙述正确的是( )
A.在25℃、101kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,则该反应热化学方程式为:2H2(g) + O2(g) = 2H2O(l) △H = -285.8 kJ·mol—1
B.500℃、30Mpa下,将0.5 mol N2与1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) △H = -38.6 kJ·mol—1
C.在稀溶液中,H+(aq) + OH-(aq) = H2O(l) △H = -57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.1 mol硫蒸气与1 mol硫粉完全燃烧放出的热量相同
随堂练习
参考答案:
1、D
2、B
3、C
4、D
5、C
